Präzisere und einfachere Bestimmung von Zellproliferation und Zytotoxizität mit dem CM20 Inkubationsüberwachungssystem
Einführung
Der Zellproliferations-/Zytotoxizitäts-Assay ist einer der am häufigsten eingesetzten Assays in Forschungsanwendungen mit Zellkulturen. Er ist ein wesentlicher Vortest zur Untersuchung der Konzentrationen von Arzneistoffen, die für Behandlungen verwendet werden sollen, und dient als sehr wichtiger Test für die Bestimmung der Wirksamkeit und Sicherheit von Arzneistoffen in verschiedenen Forschungsbereichen wie der Onkologie und bei der Untersuchung von Zelltod.
Zur quantitativen Bewertung der Wachstumseigenschaften von Zellen werden üblicherweise der WST-8- oder ATP-Assay mit der Stoffwechselaktivität als Index und der BrdU- oder Thymidin-Assay mit dem Grad der DNA-Synthese als Index verwendet. Obwohl diese Assays aufgrund ihrer Einfachheit und ihres Durchsatzes Vorteile haben, handelt es sich um indirekte Bewertungsmethoden, so dass die Ergebnisse möglicherweise nicht mit der tatsächlichen Anzahl der Zellen korreliert sind. In vielen Fällen handelt es sich um Endpunktbewertungen, was manchmal dazu geführt hat, dass zeitliche Veränderungen nicht erfasst und infolgedessen wichtige Erkenntnisse übersehen wurden.
Aufgrund dieser Einschränkungen sind wir der Ansicht, dass die Entwicklung einer Methode zur direkten und zeitlichen Bewertung der Zellproliferation/Zytotoxizität für Forschungsbereiche mit Zellkulturen wichtig ist.
Experimenteller Abriss
Für die Überprüfung der Fähigkeit des OLYMPUS Provi CM20 Inkubationsüberwachungssystems zur Beurteilung von Zellproliferation/-toxizität haben wir die folgenden zwei Assays durchgeführt, um das CM20-System mit einem herkömmlichen Test (WST-8) zu vergleichen:
- Zelltodassay mit einem Krebsmedikament (5-FU) bei humanen Lungenadenokarzinom-Zellen (A549)
- Zelltodassay mit Neurotoxin (6-OHDA) bei humanen SH-SY5Y-Neuroblastomzellen
Experimentelle Verfahren
Krebszelltod-Assay mit einem Krebsmedikament (5-FU)
Humane Lungenadenokarzinom Zellen (A549) wurden auf einer Multiwell-Platte ausgesät und 24 Stunden nach der Aussaat 72 Stunden lang mit 5-FU (400 μM) behandelt, wobei die Zellzahl stündlich mit dem CM20-System erfasst und gezählt wurde. Die 5-FU-Konzentration für die Behandlung wurde so festgelegt, dass sich Zellproliferation und Zelltod die Waage hielten, wobei eine nicht mit 5-FU behandelte Gruppe als Kontrolle diente. Die Lebensfähigkeit der Zellen wurde mit herkömmlichen Methoden 0, 24, 48 und 72 Stunden nach Beginn der Behandlung mit dem WST-8-Assay gemessen.
Zelltodassay mit Neurotoxin (6-OHDA)
Humane SH-SY5Y-Neuroblastomzellen wurden auf eine Multiwell-Platte ausgesät und 24 Stunden nach der Aussaat 24 Stunden lang mit 6-OHDA (60 μM) behandelt, wobei die Zellzahl stündlich mit dem CM20-System erfasst und gezählt wurde. Die 6-OHDA-Konzentration für die Behandlung wurde so festgelegt, dass ein schneller Zelltod ausgelöst wurde, wobei eine nicht mit 6-OHDA behandelte Gruppe als Kontrolle diente. Bei der herkömmlichen Methode wurde die Lebensfähigkeit der Zellen 0, 6, 12 und 24 Stunden nach Beginn der Behandlung mit dem WST-8-Assay gemessen.
Ergebnisse
Krebszelltod-Assay mit einem Krebsmedikament (5-FU) und A549-Zellen
Abbildung 1. Bilder von A549-Zellen nach Behandlung mit 5-FU.
Obere Reihe: Nicht mit 5-FU behandelte Gruppe. Untere Reihe: Gruppe, die mit 400 μM 5-FU behandelt wurde.
In der nicht mit 5-FU behandelten Gruppe nahm die Zahl der Zellen mit der Dauer der Kultur zu, und es wurde beobachtet, dass die Zellen nach 72 Stunden Behandlung zu 100 % konfluent waren. In der mit 5-FU behandelten Gruppe nahm die Zahl der abgestorbenen Zellen mit der Dauer der Behandlung zu, ohne dass sich die Zelldichte nach der 24-Stunden-Behandlung signifikant veränderte.
|
|
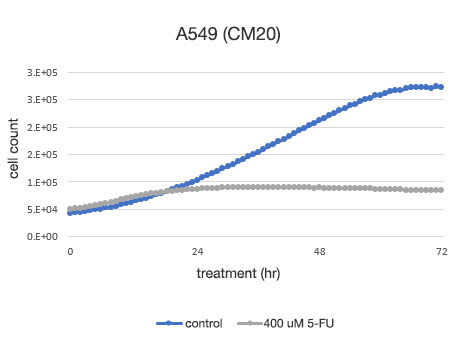
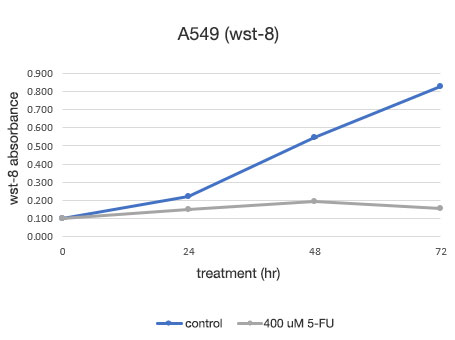
Abbildung 2: Quantitative Bestimmung der Lebensfähigkeit von A549-Zellen.
Links: Die mit CM20 ermittelte Anzahl der Zellen. Rechts: Die mit der herkömmlichen Methode (WST-8) bestimmte Anzahl der Zellen.
Die Analyse mit dem CM20-System zeigte, dass die Anzahl der Zellen in der nicht mit 5-FU behandelten Gruppe in einer sigmoidalen Kurve anstieg, während sich die Anzahl der Zellen in der mit 5-FU behandelten Gruppe nach 24 Stunden nicht signifikant veränderte, was darauf hindeutet, dass sich Zellproliferation und Zelltod die Waage hielten. Diese Ergebnisse stimmen mit der visuellen Beobachtung der Zellen überein. Sie stimmen auch mit den Ergebnissen überein, die mit der herkömmlichen Methode (WST-8-Test) erzielt wurden.
Krebszelltod-Assay mit Neurotoxin (6-OHDA) und SH-SY5Y-Zellen
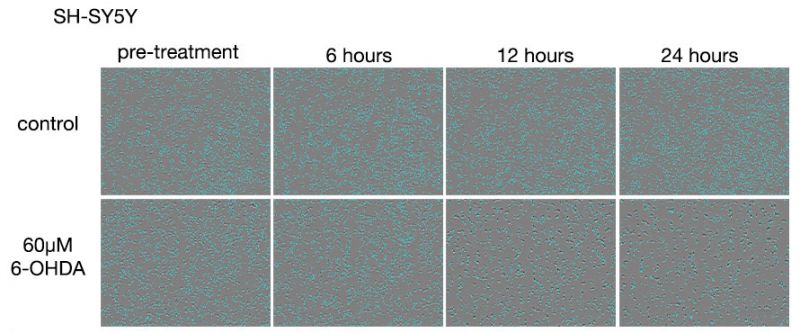
Abbildung 3: Bilder von SH-SY5Y-Zellen nach 6-OHDA-Behandlung.
Obere Reihe: Nicht mit 6-OHDA behandelte Gruppe. Untere Reihe: Gruppe, die mit 60 μM 6-OHDA behandelt wurde.
In der nicht mit 6-OHDA behandelten Gruppe wurde nach 24 Stunden ein leichter Anstieg der Zellzahl beobachtet. In der mit 6-OHDA behandelten Gruppe wurde nach 6 Stunden Behandlung ein Rückgang der Zellzahl beobachtet, und nach 12 Stunden Behandlung waren die meisten Zellen abgestorben.
|
|
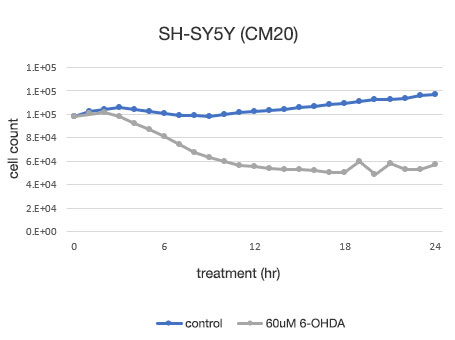
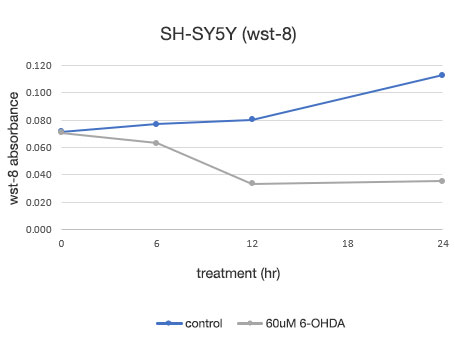
Abbildung 4: Quantitative Bestimmung der Lebensfähigkeit von SH-SY5Y-Zellen.
Links: Die mit CM20 ermittelte Anzahl der Zellen. Rechts: Die mit der herkömmlichen Methode (WST-8) bestimmte Anzahl der Zellen.
Die Analyse mit dem CM20-System zeigte, dass die Zahl der Zellen in der nicht mit 6-OHDA behandelten Gruppe innerhalb von 24 Stunden leicht anstieg, während in der mit 6-OHDA behandelten Gruppe die Zellzahl nach drei Stunden Behandlung zu sinken begann und danach weiter abnahm. Die Anzahl der Zellen zeigte nach der 12-stündigen Behandlung keine signifikante Veränderung, was darauf hindeutet, dass fast alle Zellen innerhalb von 12 Stunden nach der Behandlung abstarben. Diese Ergebnisse stimmen mit der visuellen Beobachtung der Zellen überein. Sie stimmen auch mit den Ergebnissen der herkömmlichen Methode (WST-8-Assay) überein.
Diskussion über die mit dem CM20 System erzielten Ergebnisse im Vergleich zum konventionellen Assay
Die Analyse der Wirkung des Krebsmedikaments auf Krebszellen und der Neurotoxizität eines anderen Medikaments für Zellen des Nervensystems mit Hilfe des CM20 Überwachungssystems lieferte fast die gleichen Ergebnisse wie die Bildbetrachtung und eine herkömmliche Methode (WST-8-Assay).
Vorteile der Bewertungen mit dem CM20 Inkubationsüberwachungssystem
Einer der Vorteile der Verwendung des CM20 Systems für die Beurteilung besteht darin, dass die Benutzer dank des kurzen Abtastintervalls Einzelheiten der zeitlichen Veränderungen ermitteln können. Der Test mit SH-SY5Y-Zellen zeigt zum Beispiel, dass fast alle Zellen etwa 12 Stunden nach der 6-OHDA-Behandlung abstarben. Im Gegensatz dazu liefern Endpunkt-Assays keine derartigen Informationen.
Ein weiterer Vorteil des CM20 Systems besteht darin, dass die Zeitverlaufsdaten mit nur einer Platte erfasst werden können. Bei der herkömmlichen Methode muss für jeden Messzeitpunkt eine Platte vorbereitet werden, was den Arbeitsaufwand um die Anzahl der Messzeitpunkte erhöht und die Anzahl der zu analysierenden Platten begrenzt. Darüber hinaus erhöht eine Zunahme der Messpunkte bei der Verwendung einer herkömmlichen Analysemethode auch die Komplexität der Datenanalyse, während das CM20 System die automatische Beobachtung mehrerer Punkte und die automatische Ausgabe von Diagrammen der Ergebnisse ermöglicht.
Ein zusätzlicher Vorteil des CM20 Systems ist die automatische Bildaufnahme, sodass der Benutzer den Zustand der Zellproliferation und der morphologischen Veränderungen auch nach Beginn der Datenanalyse überprüfen kann. Das CM20 System zeichnet die Bilder der Zellen während der gesamten Analyse auf, so dass weitere und potenziell wichtige Informationen gesammelt und analysiert werden können. Selbst in Fällen, in denen bei der herkömmlichen Methode eine Schätzung der angemessenen Behandlungsdauer durch die Analyse mehrerer Punkte und anschließende Wiederholungsprüfungen erfolgen muss, lässt sich mithilfe des CM20 Systems die angemessene Behandlungsdauer zu einem späteren Zeitpunkt in einem einzigen Test bestimmen, wobei die Daten innerhalb dieser Dauer anschließend extrahiert werden.
Kommentare von Dr. Yamaguchi
Zunächst einmal war ich beeindruckt von der Genauigkeit der Zellzahl bei der Verwendung des CM20 Inkubationsüberwachungssystems. Die vom CM20 System erkannten Zellen wurden einzeln auf einem Monitor angezeigt. Ich kann bestätigen, dass dieser Assay bei richtiger Einstellung der Ausgangsparameter äußerst reproduzierbare quantitative Bewertungen ermöglicht.
Anders als bei der herkömmlichen indirekten Zellzahlmessung ist beim CM20 System keine Markierung erforderlich. Da sich eine Markierung auf die Zellen auswirken kann, macht der Verzicht auf dieses Verfahren das CM20 System zu einer zuverlässigen Testmethode für die Bewertung der Zellzahl. Außerdem zeichnet sich das CM20 System dadurch aus, dass es eine nahezu automatische Erfassung von Daten für viele Zeitpunkte mit einer einzigen Platte ermöglicht, was den Arbeitsaufwand erheblich reduziert und das Risiko ausschließt, wichtige Daten zu übersehen.
Je nach Art und Konzentration der in den Experimenten verwendeten Wirkstoffe können in der Mitte der Behandlungen gewisse Abweichungen beobachtet werden, auch wenn beispielsweise am Endpunkt, an dem alle Zellen abgestorben sind oder Konfluenz erreicht haben, kein Unterschied zu beobachten ist. Ich bin der Meinung, dass die Verwendung des CM20 Systems den Zeit- und Arbeitsaufwand für die Abschätzung der Behandlungsdauer in solchen Fällen erheblich reduzieren kann, was die Effizienz und Geschwindigkeit der Forschung verbessern könnte.
Danksagungen
Dieser Anwendungshinweis wurde mit Hilfe des folgenden Wissenschaftlers erstellt:
Takahiro Yamaguchi, PhD, Principal Researcher, ACEL, Inc.
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.