Bildgebende Verfahren zur Beurteilung der Wirksamkeit von Arzneimitteln
Index
- Bildaufnahmen der Sphäroid-Arzneimittelwirkung (Kalzium-Ionen-Fluktuation)
- Chemilumineszenz-Mehrpunktbeobachtung von Multiwell-Platten
- Langzeitbeobachtung durch Mediumperfusion und automatische Substratzugabe
- Beobachtung der Embryogenese der Fruchtfliege
1. Bildaufnahmen der Sphäroid-Arzneimittelwirkung (Kalzium-Ionen-Fluktuation)
Organoide und Sphäroide (Zellaggregate) sind 3D-Modelle, die oft in einer Weise reagieren, die lebendem Gewebe stärker ähnelt als konventionelle Auswertungen mit 2D-Zellkulturen. In der Arzneimittelforschung steigt der Bedarf an Organoiden und Sphäroiden zur Prüfung der Wirksamkeit von Arzneimitteln. Auch das Interesse an der Lumineszenz-Bildgebung, bei der Lumineszenzproteine (LP) statt Fluoreszenzproteinen (FP) verwendet werden, nimmt aufgrund der Vorteile, beispielsweise der geringeren Phototoxizität und des fehlenden Hintergrundrauschens der Fluoreszenz, zu.
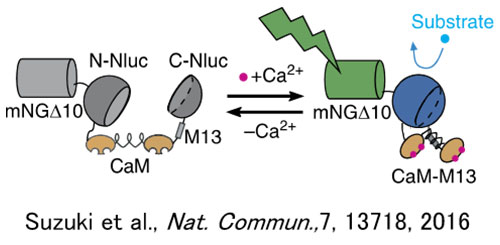
Bei der Untersuchung von Zellrezeptor-GPCR-Liganden, einer der wichtigsten Zielmolekülgruppen für Arzneimittel, werden häufig Schwankungen der Kalziumionenkonzentration als Indikator verwendet. Da Chemilumineszenz (CL) im Gegensatz zur Fluoreszenz kein Anregungslicht benötigt, stellt Autofluoreszenz von Sphäroiden und anderen Strukturen kein Problem dar. Aufgrund dieser Eigenschaft von CL-Sonden bietet sich die CL-Bildgebung zur Messung von Schwankungen der Kalziumionenkonzentration in Sphäroiden an und gewährleistet zugleich ein hohes Signal-Rausch-Verhältnis (SNR) und eine hohe Quantifizierung. Daher wurden GeNL (Ca2+)_520 (41), Kalziumlumineszenzsensoren mit grün verstärkter Nanolaterne (eNL), in Sphäroide aus kultivierten Zellen eingeführt. Nach Stimulierung mit Histamin, einem GPCR-H1-Rezeptor-Liganden für Sphäroide, wurde versucht, die Fluktuationen der internen Kalziumionenkonzentration der Zelle langfristig und kontinuierlich zu beobachten (21). Im Ergebnis konnten erfolgreich GeNL(Ca2+)_520-Leuchtsignale mit hohem SNR über einen Zeitraum von 50 Minuten beobachtet werden (siehe Abbildung 2).
Beobachtungsbedingungen
HEK293T-Zellen: Diese wurden eine Woche lang in einer 96-Well-Multiwell-Platte mit U-Boden mit adeno-assoziierten Viren kultiviert. Dabei wurden transient Chemilumineszenz-Kalziumionensensoren ((GeNL(Ca2+)_520) eingeführt.
Beobachtungsbehälter: Multiwell-Platte, 96 Vertiefungen, U-Boden
Beobachtungsmedium: DMEM/F-12 (Gibco) +10 % FBS
Lumineszierendes Substrat: 10 µM Furimazin (Promega)
Zellstimulation:2 µM Histamin
Mikroskop: Lumineszenz-Bildgebungssystem*, basierend auf dem IXplore™ Live-System
Objektiv: UPLSAPO20X (NA 0,75), Kameraadapter: 0,5x
EM-CCD: Andor iXon Ultra 888 (EM-Gain 1000x), Belichtungszeit: 20 Sekunden/Foto, Pinning: 1 × 1
|
|
Abbildung 1: Aktuatorbetrieb des Chemilumineszenz-Kalziumionensensors GeNL(Ca2+)_520 (links) und Beispiel für ein Lumineszenz-Bildgebungssystem basierend auf dem IXplore Live-System (rechts) |
Hellfeldbild | Lumineszenzbild |
Overlaybild
|
Video 1. Lumineszenzbeobachtung von Kalziumionenfluktuationen durch Histaminstimulation (Skalenleiste: 500 µm) |
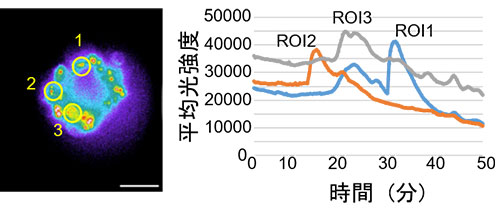
Abbildung 2: Messungen der durch Histaminstimulation verursachten Schwankungen der Kalziumionenkonzentration
2. Chemilumineszenz-Mehrpunktbeobachtung von Multiwell-Platten
Beim Screening neuer Wirkstoffkandidaten aus der Substanzbibliothek muss eine High-Content-Analyse der Zellen in einer Multiwell-Platte durchgeführt werden, um mehrere Zellphänotypen zu testen, z. B. die intrazelluläre Ionenkonzentration und Veränderungen der Zellmorphologie. In diesem Fall ist die Verwendung von chemilumineszierenden Proteinen mit hoher Leuchtkraft effektiv, da dadurch Veränderungen der Zellmorphologie und -bewegung mit hohem Kontrast quantitativ erfasst werden können.
Bei der Chemilumineszenz-Bildgebung für das Wirkstoff-Screening und die Bewertung der Wirksamkeit wurden kultivierte Zellen, die chemilumineszente Proteine exprimieren, in einer Multiwell-Platte ausgesät. Jede Vertiefung wurde mit Hilfe eines motorgesteuerten Tisches wiederholt automatisch gescannt, die erfassten Bilddaten wurden für alle Vertiefungen analysiert. Dies ermöglichte die Bildaufnahme der gesamten Multiwell-Platte in nur wenigen Minuten. So konnten wir sowohl Bilder mit niedriger Vergrößerung der Mikroplattenvertiefungen als auch Bilder mit hoher Vergrößerung der Morphologie der einzelnen Zellen mit hohem Kontrast betrachten. Die Bilder der Zellen mit Sichtfeldern von 1 mm bis 100 µm sind in Abbildung 3 dargestellt. Unser Experiment zeigte, dass mit einem Chemilumineszenz-Bildgebungssystem, das ein Mikroskop mit Mehrpunktabtastung enthält, eine Zellanalyse mit hohem Durchsatz und hohem Zellgehalt möglich ist.
Beobachtungsbedingungen
HeLa-Zellen: Stabile Expression des leuchtstarken Chemilumineszenzproteins, gelbverstärkter Nanolaternensensor
Beobachtungsbehälter: Multiwell-Platte, 96 Vertiefungen, flacher Boden
Beobachtungsmedium: HBSS(-) (Sigma)
Lumineszierendes Substrat: 10 µM Furimazin (Promega)
Mikroskop: Lumineszenz-Bildgebungssystem*, basierend auf dem IXplore Live-System
Objektiv: UPLFLN10X2PH (NA 0,3), Kameraadapter: 0,5xbr/> EM-CCD: Andor iXon Ultra 888 (EM-Gain 1000x), Belichtungszeit: 1 Sekunde/Foto, Pinning: 2 × 2
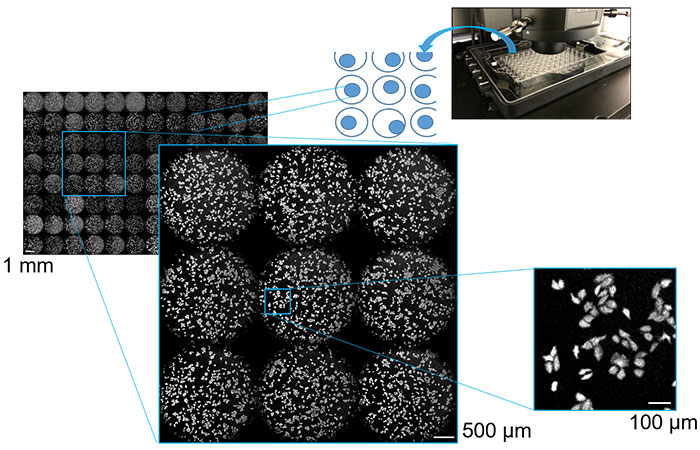
Abbildung 3: Zellkulturen in Multiwell-Platten bei 1 mm, 500 µm und 100 µm, aufgenommen mit Mehrpunkt-Scanning-Lumineszenzbildgebung
3. Langzeitbeobachtung durch Mediumperfusion und automatische Substratzugabe
Zur Bewertung der Wirksamkeit von Arzneimitteln ist für eine detaillierte Analyse der Wirkungen die Beobachtung von Zellen über einen langen Zeitraum unerlässlich. Aufgrund der charakteristischen kurzen Reifezeit und Halbwertszeit der Luciferase sind sie seit langem als wirksame Reportergene zur Überwachung der Dynamik der Genexpression im Zeitverlauf anerkannt. Da im Gegensatz zur Fluoreszenz kein Anregungslicht erforderlich ist, wird bei der Verwendung von Lumineszenzsonden für lange Bildaufnahmen die Phototoxizität der Zellen verringert. Da diese Technik jedoch ein lumineszierendes Substrat (Luciferin) erfordert, ist eine stabile Versorgung der Zellen mit Luciferin wichtig.
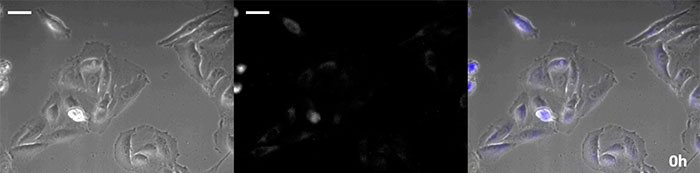
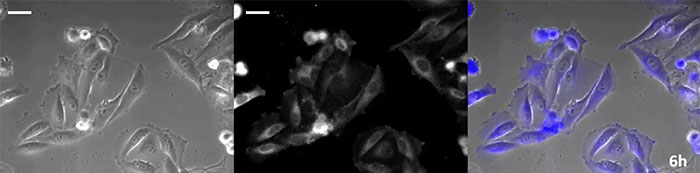
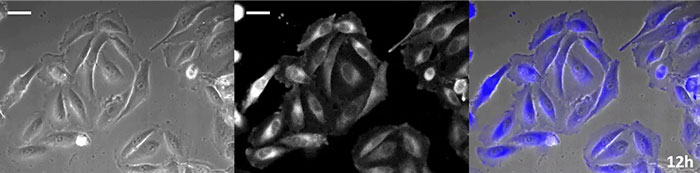
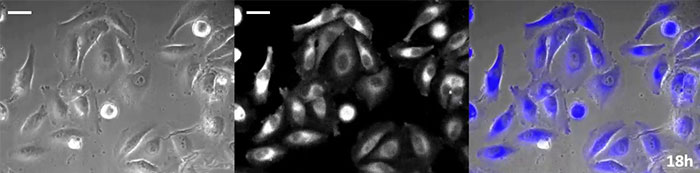
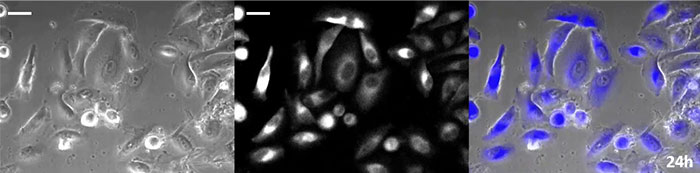
Luciferin vom Coelenterazin-Typ hat eine besonders hohe Leuchtkraft, aber da es in der Zelle innerhalb kurzer Zeit oxidiert, ist eine rechtzeitige Zugabe für Langzeitbeobachtungen unerlässlich. Um dieses Problem zu lösen, haben wir die Zellen mit hochintensivem lumineszierendem Protein perfundiert und das Coelenterazin über ein automatisches Gerät zugegeben, so dass die Lumineszenz kontinuierlich überwacht werden konnte. So konnten wir das Lumineszenzbild in Kombination mit der Phasenkontrast-Bildgebung 24 Stunden lang beobachten (Abbildung 4).
Phasenkontrastbild | Lumineszenzbild |
Overlaybild
|
0 Stunden |
|
6 Stunden |
|
12 Stunden |
|
18 Stunden |
|
24 Stunden |
|
Beobachtungsbedingungen
HeLa-Zellen†: Stabile Expression des leuchtstarken Chemilumineszenzproteins, gelbverstärkter Nanolaternensensor
Beobachtungsgefäß: 35-mm-Glasbodenschale
Beobachtungsmedium: DMEM/F12 (Gibco) +10 % FBS
Lumineszierendes Substrat: 2,5 mM Coelenterazin-h (FUJIFILM Wako Pure Chemical Corp.), 1,2 µl/7,5 Minuten
Perfusionsflussrate: 40 µl/Minute, mittlere Drainage: ca. 10 ml/Stunde
Mikroskop: Lumineszenz-Bildgebungssystem*, basierend auf dem IXplore™ Live-System
Objektiv: UPLFLN40XPH (NA 0,75), Kameraadapter: 0,5x
EM-CCD: Andor iXon Ultra 888 (EM-Gain 1000x), Belichtungszeit: 5 Minuten/Foto, Aufnahmeintervall: 7,5 Minuten, Pinning: 1 × 1
4. Beobachtung der Embryogenese der Fruchtfliege
Die Bewertung der Wirksamkeit von Arzneimitteln anhand von Modellorganismen ist eine wesentliche Voraussetzung für die nächste Phase klinischer Versuche. In den letzten Jahren haben Fliegen als hervorragendes Material zur Erforschung menschlicher Krankheiten an Bedeutung gewonnen. So wurde zum Beispiel Vandetanib, ein Medikament, das durch die Entwicklung und Verwendung eines Fliegenmodells für medullären Schilddrüsenkrebs entdeckt wurde, von der FDA als Medikament zur Behandlung von Menschen zugelassen.
Obwohl fluoreszierende Proteine häufig als Reporter zur Überwachung der Genexpression in lebenden Modellorganismen verwendet werden, müssen diverse Probleme berücksichtigt werden, darunter die Lichtübertragung von Embryonen und die Eigenfluoreszenz als Reaktion auf das Anregungslicht. Bei der Lumineszenz-Bildgebung hingegen ist kein Anregungslicht erforderlich, so dass ein Großteil dieser Probleme entfällt. Für dieses Experiment wurde D-Luciferin, gemischt mit Hefepaste, an Larven im dritten Larvenstadium verfüttert; mit dieser Verbindung als Reporter wurden dann die Veränderungen der Engrailed-Genexpression während der Embryogenese der Fruchtfliege im Zeitverlauf beobachtet. Die Ergebnisse zeigten, dass die Lumineszenz tief im Inneren der Puppe, durch die Puppenhülle hindurch, detektiert werden kann: Es gelang uns, Veränderungen der Expressionsorte und des Expressionsniveaus während des Transformationsprozesses in Echtzeit zu beobachten (Video 2).
Lumineszenzbild | Lumineszenzbild (Pseudofarbe) |
 |
Video 2. Lumineszenzaufnahmen von Fruchtfliegenembryonen (Skalenleiste: 500 µm)
Beobachtungsbedingungen
Fruchtfliege: Lumineszenzreporter für die Engrailed-Genexpression (Luciferase: Pmat)
Nach der Verfütterung von mit Hefepaste vermischtem D-Luciferin an die Larven im dritten Larvenstadium wurden die Puppen zur Beobachtung auf eine 24-Well-Platte gesetzt.
Mikroskop: Lumineszenz-Bildgebungssystem*, basierend auf dem IXplore Live System Objektiv: UPLFLN4XPH (NA 0,13), Kameraadapter: 0,5x
EM-CCD: Andor iXon Ultra 888 (EM-Gain 300x), Belichtungszeit: 120 Sekunden/Foto, Pinning: 1 × 1
Danksagungen
Diese Anwendungshinweise wurden mit Hilfe folgender Forscher erstellt:
Professor Kenji Nagai und Assistenzprofessor Mitsuru Hattori
Institut für wissenschaftliche und industrielle Forschung der Universität Osaka, Nagai-Labor
Die Embryo-Proben der Fruchtfliege wurden mit Hilfe folgender Forscher vorbereitet:
Professorin Toshie Kai und Assistenzprofessorin Ritsuko Sugiyama
Graduate School of Frontier Biosciences Osaka University, Labor für Reproduktionsbiologie
*Das für diese Experimente verwendete Lumineszenz-Bildgebungssystem ist das Ergebnis einer gemeinsamen Entwicklung von Professor Kenji Nagai et al. vom Institut für Wissenschaft und Technologie der Universität Osaka, Tokai Hit Co. Ltd., und der Olympus Corporation im Rahmen eines Programms zur Entwicklung moderner Mess- und Analysetechnologien und -geräte und zur Kombination bestehender Produktkomponenten, einschließlich des Olympus IXplore Live Mikroskops. Obwohl dieses spezielle System nur in bestimmten Regionen verfügbar ist, bietet Evident Life Sciences ähnliche Lumineszenzlösungen für seine Kunden weltweit an. Wenden Sie sich an Ihren örtlichen Evident-Vertreter, um weitere Einzelheiten zu erfahren.
Zitierte Arbeiten:
Biochem. Biophys. Rep., 23 (2020) 100771
†Hinweis: HeLa-Zellen sind einer der wichtigsten und bekanntesten Zellstämme für die medizinische Forschung und wissenschaftliche Entwicklung. Sie haben zu wichtigen Entdeckungen in der Immunologie, bei Infektionskrankheiten und in der Krebsforschung beigetragen und ernste Fragen zur Ethik im medizinischen Bereich aufgeworfen. Weitere Informationen über das Leben von Henrietta Lacks und ihren Beitrag zur modernen Medizin finden Sie unter http://henriettalacksfoundation.org/.
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.