Betrachtung eines Tumorsphäroids mit Gefäßsystem auf einem Biochip bei der Untersuchung mit einem konfokalen Mikroskop
In Studien wurde nachgewiesen, dass Tumore die Bildung neuer Blutgefäße induzieren, um weiter wachsen zu können. Mit diesen Blutgefäßen wird das Tumorgewebe am Leben erhalten, und sie spielen eine wichtige Rolle für die Tumormikroumgebung (TME). Bisher wurden die Reaktionen von Tumoren auf biochemische und biomechanische Reize unter statischen Bedingungen ausgewertet, d. h. ohne Berücksichtigung der Auswirkungen der Tumordurchblutung. In diesem Anwendungsbeispiel wird eine Tumor-on-a-Chip-Plattform zur Untersuchung der Tumormikroumgebung mit Mediumfluss in einem perfundierbaren Gefäßsystem und zur Messung der Auswirkungen von Arzneimitteln im Blutstrom vorgestellt.
3D-Betrachtung des Tumorsphäroids auf dem Mikrofluidik-Biochip
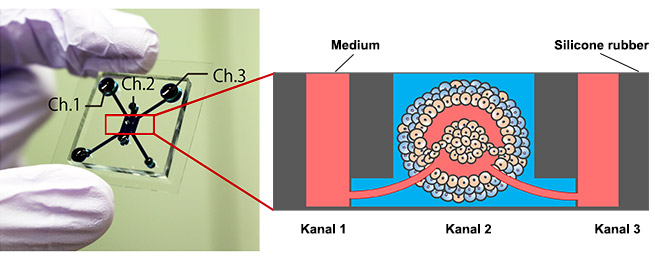
Abbildung 1: Mikrofluidik-Biochip mit Tumormodell.
Links: Mikrofluidik-Biochip, rechts: Tumormodell mit perfundierbarem Gefäßsystem.
In dieser Studie ging es um die Untersuchung der Tumormikroumgebung und des Gefäßsystems durch Cokultur von Endothelzellkulturen aus der menschlichen Nabelschnurvene (HUVEC) mit Sphäroiden, die menschliche Brustadenokarzinomzellen (MCF-7) enthielten, auf Mikrofluidik-Biochips. Zur Bestätigung der Perfundierbarkeit des Gefäßsystems auf dem Mikrofluidik-Biochip wurde mithilfe des konfokalen FV3000RS Mikroskops untersucht, ob Fluoreszenzbeads (grün) kontinuierlich durch das Gefäßsystem und das Sphäroid strömen. Die Bildgebung von 3D-Zellkulturen ist aufgrund der Dicke der Masse schwierig. In der Regel ist ein Anregungslicht mit höherer Intensität erforderlich, um ein Fluoreszenzsignal zu erzeugen, das stark genug ist, um erfasst zu werden. Ein intensiveres Anregungslicht erhöht jedoch auch die Fototoxizität und schädigt die Zellen. Zur Lösung dieses Problems verwendeten wir das konfokale FV3000 Mikroskop, das mit der TruSpectral Detektionstechnologie von Olympus und hochempfindlichen GaAsP-Detektoren ausgestattet ist, um schwache Fluoreszenzsignale zu erfassen und die Laserleistung zu minimieren.
(a)
| (b)
|
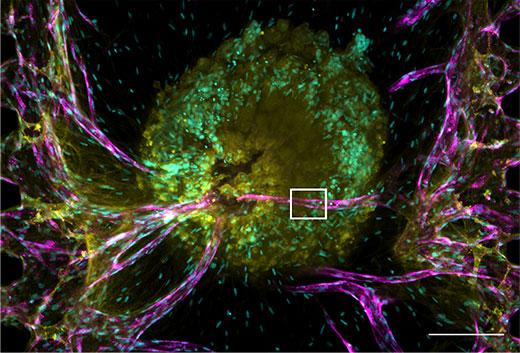
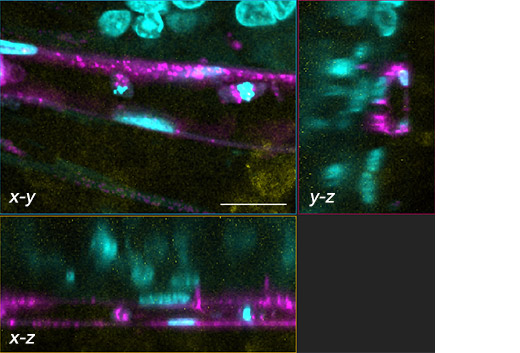
Abbildung 2: Tumorsphäroid mit Gefäßsystem.
Kernfärbung: Cyan (405 nm, Hoechst 33342), RFP-HUVEC: Magenta (561 nm, RFP), E-Cadherin: Gelb (640 nm, Alexa Fluor 633).
(a) Darstellung des Tumorsphäroids. Maßstab: 200 μm, Objektiv: UPLSAPO10X2.
(b) Darstellung von 3 Bildebenen (x-y, x-z, y-z) des weiß eingerahmten Bereichs in (a). Maßstab: 20 μm, Objektiv: UPLSAPO40X2.
Schnelle Bildgebung des Blutflusses mit dem Resonanz- Scanner
Wir untersuchten ferner den Fluss fluoreszierender Mikrobeads (grün, Durchmesser: 3.1 μm) im sGefäßsystem des Tumorsphäroids. Bei einem schnellen Blutfluss ist die Scangeschwindigkeit des normalen Galvanometers möglicherweise nicht ausreichend. Bei dieser Untersuchung wurden Bilder mit dem konfokalen Mikroskop FV3000RS von Olympus erfasst, das zusätzlich mit einem Hochgeschwindigkeitsresonanz-Scanner ausgestattet ist. Wir konnten nachweisen, dass fluoreszierende Mikrobeads nach Injektion in Kanal 3 des Mikrofluidik-Biochips durch die Lumenstrukturen des Sphäroids strömten und zu Kanal 1 gelangten, was auf die Perfundierbarkeit des hergestellten Gefäßsystems bestätigt. Nach Bestätigung der Validität dieses Tumorsphäroid-Modells zur Untersuchung der Auswirkungen des Blutflusses auf die Tumormikroumgebung wurde in nachfolgenden Untersuchungen festgestellt, dass die Arzneimittelwirkung in der Tumormikroumgebung, einschließlich des Blutgefäßsystems, variiert, je nachdem, ob ein intravaskulärer Durchfluss vorhanden ist oder nicht. Wir hoffen, dass unser 3D-System als Modell für transvaskuläre Arzneimittelgabe die Entwicklung von Medikamenten in Zukunft erleichtern kann.
Video: Strom von Fluoreszenzbeads in Blutgefäßen und Tumorsphäroiden auf einem Mikrofluidik-Biochip.
Imagingbedingung: 65 ms/Bild Maßstab: 100 μm
Kommentar von Dr. Yokokawa
Das Neue in dieser Studie war ein perfundierbares Gefäßsystem in einem Tumorsphäroid. Es war wichtig zu zeigen, wie das Gefäßsystem die Sphäroid- und Mikrofluidik-Kanäle miteinander verband. Zudem war es wichtig, die Gefäßlumen und den Fluss des Gefäßsystems gleichzeitig zu betrachten und so die Perfundierbarkeit zu demonstrieren. Der Hochgeschwindigkeitsresonanz-Scanner des konfokalen FV3000 Mikroskops ermöglichte das Imaging des Gefäßsystems (RFP-markiert) und des dynamischen Flusses der Mikrobeads (grün).
Dr. Ryuji Yokokawa1 |
Dr. Yuji Nashimoto2 |
Anmerkungen
Dieses Anwendungsbeispiel wurde durch Mitwirkung folgender Forscher erstellt:
Department of Micro Engineering, Kyoto University1
Frontier Research Institute for Interdisciplinary Sciences (FRIS), Tohoku University2
Vorteile des konfokalen Mikroskops FV3000 für unseren Versuch
Hohe Empfindlichkeit für die Bildgebung von Lebendzellen durch Vollspektrum-System mit hocheffizienten GaAsP-Detektoren
Related Videos |
|
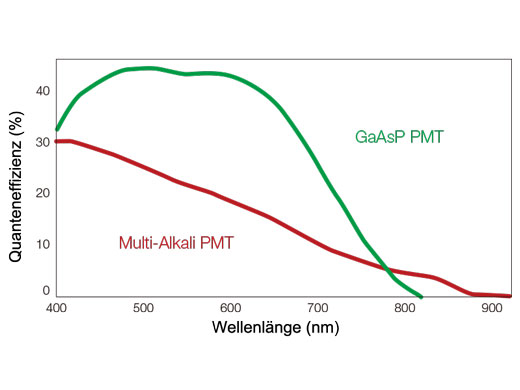
In der Serie FV3000 kommt die TruSpectral Erkennungstechnologie von Olympus zur Anwendung, bei der das Licht durch Transmission durch eine Volumen-Phasen-Hologramm-Einheit gebeugt wird. Diese Technologie ermöglicht einen wesentlich höheren Lichtdurchsatz als herkömmliche spektrale Erkennungseinheiten mit Reflexionsgittern. Der hochempfindliche Zweikanal-Spektraldetektor (HSD) des Mikroskops FV3000 erreicht durch die TruSpectral Technologie mit Peltier-gekühlten GaAsP-PMTs eine hohe Quanteneffizienz von 45 % bei einem hohen Signal-Rausch-Verhältnis. Diese Kombination der Erkennungstechnologien ermöglicht eine leistungsstarke, hochempfindliche Erkennung und eine Minimierung der für die Betrachtung von lebendem Gewebe erforderlichen Laserstärke.
Zwei Systemoptionen
Related VideosVideo: Thrombose mit Thrombozyten im Blutgefäß einer Maus. Full Frame-Bilder, 30 fps, aufgenommen mit einem Resonanzsystem mit Zweikanal-GaAsP-PMTs. Bildquelle: Dr. Takuya Hiratsuka, Dr. Michiyuki Matsuda, Graduate School of Biostudies, Kyoto University. | Auswahl zwischen zwei Scan-Systemen: herkömmliches Laser-Scanning-Mikroskop (Galvanometer, FV3000) und erweitertes Laser-Scanning-Mikroskop (Galvanometer- und Resonanzsystem, FV3000RS). Das Resonanzsystem ermöglicht Aufnahmen von 30 Bildern pro Sekunde mit vollem Sichtfeld von 512 × 512 Pixeln oder von bis zu 438 Bildern pro Sekunde mit Anpassung der Y-Achse, um kritische physiologische Vorgänge im Lebendobjekt (z. B. den Calciumionen-Fluss) in Echtzeit zu erfassen. |
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.