Vielleicht mussten Sie aufgrund einer vorübergehenden Laborschließung, eines Urlaubs oder eines plötzlichen Notfalls eine Pause in Ihrer Forschung einlegen. Unabhängig von der Situation kann die Rückkehr ins Labor nach einer Auszeit eine Herausforderung sein. Wie gehen Sie am besten vor, um sich zu organisieren, Ihre Versuche zu planen und Ihre Ziele zu erreichen?
Um die Wiederaufnahme der Labortätigkeiten zu erleichtern, haben wir diese 4-Schritte-Anleitung erstellt, mit der Sie Ihre Versuche wieder zum Laufen bringen.
1. Einschalten der Geräte
Dieser Punkt mag unwichtig erscheinen, aber tatsächlich kann das unsachgemäße Einschalten Ihrer Geräte die Systemleistung negativ beeinflussen. Hier sind einige allgemeine Richtlinien zu beachten:
- Schalten Sie zuerst den PC ein: Ihr PC ist das „Gehirn“ des Mikroskopsystems – denken Sie also daran, als erstes den PC einzuschalten und sich anzumelden.
- Schalten Sie alle Komponenten des Systems ein: Je nach System kann die Reihenfolge, in der Sie die Komponenten einschalten, eine Rolle spielen. So muss z. B. das CBH bei Olympus-Systemen vor dem TPC eingeschaltet werden. Spezifische Anweisungen finden Sie in Ihrem Handbuch.
- Starten Sie die Software: Wenn Sie beim Starten der Software auf Fehler stoßen, sind wir für Sie da! Wenden Sie sich an Ihren lokalen Vertriebsmitarbeiter oder kontaktieren Sie uns, wenn Sie technische Unterstützung benötigen.
2. Vorbereitung der Bilderfassung
Sobald Ihr Gerät eingeschaltet ist, nehmen Sie sich die Zeit, Ihre Probe für die Bilderfassung richtig vorzubereiten, zu laden und zu nivellieren. Hier sind einige hilfreiche Tipps:
Vorbereiten der Probe
Wählen Sie zunächst das passende Deckglas aus. Die Deckgläser sollten die Größe 1,5 haben bzw. 0,17 mm (170 µm) dick sein. Olympus-Objektive für Deckgläser benötigen für eine gute Bildqualität die richtige Dicke. Wenn das Deckglas zu dick oder zu dünn ist, können optische Artefakte auftreten.
Überprüfen Sie unbedingt die Deckglasdicke und verwenden Sie Standard-Glasobjektträger. Bei einigen Anwendungen sind Kunststoffgläser akzeptabel. Bei der Fluoreszenzbildgebung ist Kunststoff jedoch stark autofluoreszierend. Dies verursacht ein starkes Hintergrundrauschen im blauen und grünen Kanal und mitunter auch in den roten Kanälen.
Die Reinigung des Deckglases und des Objektträgers vor der Bildgebung ist ebenfalls wichtig. Eine gute Reinigungslösung ist 70 % Ethanol in destilliertem Wasser. Eine weitere Möglichkeit ist ein optischer Reiniger, z. B. Sparkle Optical Lens Cleaner von A.J. Funk and Co.
Verwenden Sie zum Reinigen der Optik immer Linsenpapier. Gesichtstücher oder Labortücher sind abrasiv und können optische Oberflächen beschädigen.
Laden der Probe
Laden Sie als nächstes das vorbereitete Präparat in der richtigen Ausrichtung für Ihr Mikroskop. Laden Sie die Deckgläser bei einem aufrechten Mikroskop immer mit der Oberseite nach oben und bei einem inversen Mikroskop nach unten.
Prüfen Sie bei einem inversen Mikroskop, ob die Probe gut versiegelt ist. Wenn die Probe nicht gut versiegelt ist, kann Flüssigkeit mit den Objektiven oder dem Objektivrevolver in Kontakt kommen. Diese Flüssigkeit kann optische Beschichtungen, optischen Klebstoff oder andere Teile der Mikroskop-Hardware und -Elektronik angreifen oder oxidieren.
Achten Sie beim Laden der Probe besonders auf den Arbeitsabstand des Objektivs. Vereinfacht ausgedrückt bestimmt der Arbeitsabstand, wie nah das Objektiv sein muss, um die Probe scharf zu stellen. Der Arbeitsabstand kann zwischen 100 µm und mehreren Millimetern liegen.
Sie möchten den Arbeitsabstand Ihres Objektivs ermitteln? Prüfen Sie einfach die eingravierten Spezifikationen oder sehen Sie in unserem Online-Objektivkatalog nach.

Abbildung 1: Bei inversen Mikroskopen müssen die Objektträger kopfüber geladen werden. Ein häufiger Fehler ist es, Objektträger mit dem Deckglas nach oben auf ein inverses Mikroskop zu legen, was zu einem unscharfen Bild führt. Prüfen Sie immer, ob die optischen Oberflächen sauber sind, und verwenden Sie Linsenpapier, um diese Oberflächen zu reinigen.
Nivellierung der Probe
In vielen Situationen ist die Flachheit einer Probe kein Problem. Der Tisch ist fest und flach, des Probenhalter ist flach, und der Objektträger ist flach.
Bei empfindlicheren Anwendungen wie der konfokalen Mikroskopie, TIRF oder Tiling hat die Flachheit der Proben aber eine entscheidende Bedeutung. Wenn die Probe schräg ist, kann es zu Abschattungen kommen. Abschattungen können zu Artefakten beim Zusammenfügen von Bildern oder zu Änderungen der Helligkeit je nach Position im Bild führen.
Eine Möglichkeit, die Probenflachheit verbessern, sind die Nivellierschrauben, die an einigen Tischeinsätzen, üblicherweise in den Ecken, zu finden sind. Falsch eingestellte Nivellierschrauben sind eine häufige Ursache für schräge Proben. Wenn die Schräglage der Probe durch den Tischeinsatz bedingt ist, empfiehlt es sich, diese Schrauben vollständig herauszudrehen.
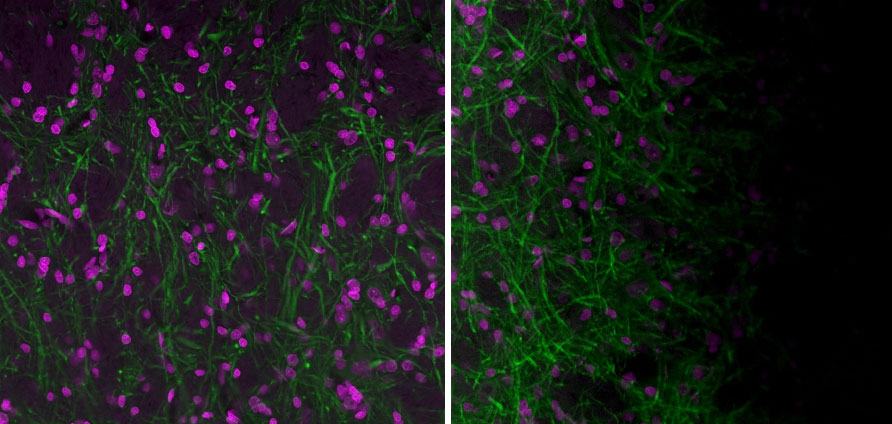
Abbildung 3: Links: Bild, aufgenommen mit einem gut ausgerichteten konfokalen Laser-Scanning-Mikroskop FV3000 von Olympus und einer flachen Probe. Rechts: Bild, das mit einem gut ausgerichteten Mikroskop FV3000 aufgenommen wurde, bei dem die Probe aber nicht flach ist. Mitunter ist es schwierig, die Quelle der Abschattung zu bestimmen. Oft kann eine Probe, die nicht flach im Probenhalter liegt, ein Artefakt durch Abschattung verursachen. Bilder, die mit einem UPlanXApo 20X Objektiv aufgenommen wurden. Magenta ist Hoechst und grün ist MAP2 (MCA-5H11), gefärbt mit Alexa 488.
Bestimmen des Immersionsmediums
Olympus bietet fünf Haupttypen von Objektiven an: Luft-, Wasserimmersions-, Wassereintauch-, Standardöl- und Silikonöl-Objektive. Wenn das falsche Immersionsmedium am Objektiv verwendet wird, verschlechtert sich die Bildqualität. Außerdem kann es zu Schäden kommen, wenn Öl in bestimmte Teile eines Objektivs eindringt, das nicht für die Verwendung von Öl ausgelegt ist.
Aus diesen Gründen müssen Sie das für Ihre Objektive vorgesehene Immersionsmedium kennen. Unsere Objektive sind farblich gekennzeichnet, so dass Sie das benötigte Immersionsmedium leicht feststellen und nicht verwechseln können.
Berücksichtigen Sie auch Ihren Arbeitsablauf. Sie sollten nicht bei 60X mit Silikonöl abbilden und dann sofort zu einem 60X Wasserimmersionsobjektiv wechseln. Die Mischung von Silikonöl und Wasser führt zu unscharfen Bildern. Außerdem müsste der Objektträger vor der Wasserimmersion herausgenommen und gereinigt werden.
Achten Sie auch darauf, dass Sie das Öl des Herstellers Ihrer Objektive verwenden, da es für die jeweilige Optik ausgelegt ist.

Abbildung 4: Standardöl oder Immersionsöl Typ-F (links) und Silikon-Immersionsöl (rechts). Olympus bietet viele Objektive für Standardöl und einige für Silikon-Immersionsöl an. Die Verwendung des richtigen Öls ist entscheidend für den Erfolg der Bildgebung. Vermeiden Sie es, diese beiden Öle auf einem Deckglas zu mischen.
3. Bilder erfassen
Nachdem Sie nun Ihre Probe vorbereitet haben, können Sie mit der Bildaufnahme fortfahren. Hier finden Sie einige nützliche Tipps zur Bildaufnahme:
Bewährte Praktiken zur Bildaufnahme
Bei der Aufnahme von Bildern durch konfokale oder Weitfeld-Fluoreszenzmikroskope werden in der Regel eine schwächere Beleuchtung und eine höhere Detektionsempfindlichkeit oder Verstärkung bevorzugt. Dadurch wird die schädliche Laser- oder Bogenlampenbestrahlung reduziert, die Photobleiche und biologische Veränderungen verursacht.
Durch Anregungslicht können bestimmte Ionenkanäle und Signalisierungswege, die zu Tod der Zelle führen, aktiviert werden. Dennoch muss die Beleuchtung stark genug sein, um ein Bild von ausreichender Qualität zu erzeugen. Eine hohe Ausleuchtung kann ein schönes Bild erzeugen. Überlegen Sie, wie Sie einen Kompromiss zwischen dem Licht für die Anregung und dem Licht für die Detektion und dem letztendlichen Ziel des Versuchs finden können.
Korrekturring
Einige unserer Objektive haben einen Korrekturring. Die Einstellung kann ohne entsprechende Schulung verwirrend sein. Allgemeine Richtlinien sind:
- Verwenden Sie die Einstellung 0,0 ohne Deckglas oder 0,17 für Deckgläser der Größe 1,5.
- Prüfen Sie, ob der Korrekturring für die Temperaturgekennzeichnet ist. Einige Objektive haben unterschiedliche Skalen für die Raumtemperatur oder 37 °C. Stellen Sie den Korrekturring ein, beginnen Sie mit der Bildaufnahme und optimieren Sie die Bildhelligkeit mit dem Korrekturring unter Beibehaltung des Fokus. Dieser letzte Schritt erfordert Geduld und Übung. Wenn eine Optimierung nicht möglich ist, dann halten Sie sich in einem ersten Schritt an die allgemeinen Korrekturringeinstellungen von 0,0 oder 0,17.

Abbildung 5: Drei 60X Objektive. Das UplanXApo 60X Objektiv (rechts) verwendet Standardöl und hat keinen Korrekturring. Das UplanApo 60X Ölobjektiv (links) verwendet einen auf 0,17 eingestellten Korrekturring (Deckgläser der Größe 1,5). Das UPlanSApo Objektiv (Mitte) verwendet Silikonöl; der Korrekturring ist auf 0,17 (#1,5) bei 37 ˚C eingestellt. Die Optimierung der Position des Korrekturrings kann der Schlüssel für ein scharfes Bild sein.
Ausrichten des Kondensors
Wenn Sie hauptsächlich mit Fluoreszenz arbeiten, wird der Kondensor während des normalen Mikroskopbetriebs ggf. gar nicht genutzt. Bewegen Sie in diesem Fall den Kondensor mit den Kondensor-Drehknöpfen vom Proben weg.
Wenn Sie Hellfeld-, Phasenkontrast- oder DIC-Bildgebung verwenden möchten, besteht der erste Schritt in der Regel darin, die Ausrichtung des Kondensors zu überprüfen. Fokussieren Sie im Hellfeldmodus auf die Probe und schließen Sie dann die Feldblende, um die Kondensorlamellen sichtbar zu machen. Dieser Vorgang lässt sich am einfachsten bei 10- oder 20-facher Vergrößerung durchführen.
Wenn die Lamellen des Kondensors nicht scharf oder zentriert sind, richten Sie den Kondensor in der Höhe und/oder die Zentrierung durch Köhlern aus. Informationen zur Ausrichtung des Kondensors durch Köhlern finden Sie in unserem Microscopy Resource Center im Internet.
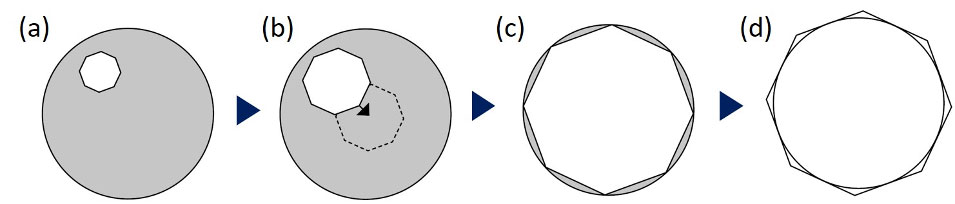
Abbildung 6: Verfahren zur Ausrichtung des Kondensors: (a) Schließen Sie die Feldblende, (b) zentrieren Sie auf die Mitte der Blendenlamellen, (c) bestätigen Sie die genaue Mitte, machen Sie die eingravierte Lamelle zum Rand des Sichtfeldes und (d) definieren Sie den Rand mit den Lamellen.
Dateigrößen
Mikroskopdateien können recht groß sein. Dennoch lassen sich mit bestimmten Maßnahmen die Dateigrößen reduzieren. Wenn Sie zum Beispiel keine Daten benötigen, kann die Idee, alles „für den Fall der Fälle“ zu sichern, Ihr Leben nur erschweren.
Nehmen Sie die Bilder auf, die Sie brauchen, mit der Auflösung, der Bittiefe und dem Sichtfeld, das Sie brauchen. Vermeiden Sie es, mehr oder weniger als nötig zu speichern, da unnötig große Dateien eine unerwünschte Belastung für Datenspeicherung und Datenverarbeitung darstellen.
Speichern von Dateien
Speichern Sie Dateien so schnell wie möglich. Computer- und Festplattenausfälle können jederzeit auftreten, speichern Sie daher an mehr als einem Ort.
Seien Sie bitte vorsichtig, wenn Sie einen USB-Stick oder eine externe Festplatte verwenden. Diese sind anfälliger für Infektionen und können Viren oder Malware verbreiten.
Es mag nicht sofort ersichtlich sein, dass ein PC des Bildgebungssystems infiziert ist. Das System kann aber langsamer werden oder gelegentlich abstürzen. Viele Bildgebungssysteme verfügen nicht über eine Antiviren-Software, damit diese nicht die Systemleistung beeinträchtigt. Infolgedessen sind bildgebende System-PCs anfällig für Virusinfektionen.
Um solche Risiken zu vermindern, scannen Sie bitte externe Speicherlaufwerke, bevor Sie sie an den PC des Bildgebungssystems anschließen.
Dateiformate
Olympus verwendet proprietäre Dateiformate, wie OIR, OIF, VSI und OIB. Diese Formate:
- speichern unkomprimierte Bilder in voller Auflösung,
- behalten die für das Olympus-Bildgebungssystem geeignete Dateiarchitektur,
- speichern Metadaten aus den Bildgebungsparametern.
FIJI/ImageJ kann diese Olympus-Dateien öffnen, wenn die entsprechenden Plugins installiert sind. Wir empfehlen, die Bilder nach Möglichkeit in den Olympus-Dateiformaten zu belassen, wissen aber, dass der Export der Dateien in TIFF, JPEG 2000 oder andere Formate manchmal notwendig ist.
Bitte beachten Sie eine mögliche Komprimierung oder reduzierte Auflösung durch Exportdatei-Optionen oder durch den Bilddateityp. Vermeiden Sie die Verwendung von JPEG-Bildern, da die Bilder oft komprimiert sind und es zu Datenverlusten kommt.
4. Herunterfahren des Systems
Das korrekte Herunterfahren Ihres Systems ist ebenso wichtig wie das ordnungsgemäße Hochfahren. Hier sind einige bewährte Verfahren:
Reinigen des Mikroskopsystems nach Gebrauch
Wenn die Bildgebung abgeschlossen ist, ist Aufräumen nicht nur ein Gebot der Höflichkeit, sondern verhindert auch Schäden an der Hardware.
So kann z. B. Standardöl für Ölimmersionsobjektive eintrocknen und aushärten, wenn es auf den Objektiven verbleibt. Öl, das tagelang nicht benutzt wurde, lässt sich nur schwer entfernen und kann sogar auf andere Mikroskopoberflächen laufen. Wie Sie Objektivlinsen reinigen, erfahren Sie in unserem Artikel 6 Tipps zur korrekten Entfernung von Immersionsöl von Objektiven .
Häufig sind auf dem Mikroskoptisch oder im Bildgebungsbereich noch Reste von Nagellack von Objektträgern oder ätzenden Klärungsreagenzien vorhanden. Reinigen Sie diese Flächen, insbesondere dort, wo Flüssigkeit oder andere Rückstände sichtbar sind. Häufig berührte Oberflächen wie Okularlinsen, die Touchpanel-Bedienung und Fokussiergriffe sind allesamt mögliche Bereiche für Kontamination und Infektion von einem Benutzer zum nächsten.
Um die Verbreitung von Viren zu reduzieren, müssen diese Oberflächen unbedingt gereinigt werden. Wir empfehlen die Verwendung von 70 % Ethanol in destilliertem Wasser und Linsenpapier für den Touchpanel-Controller und die Okulare. Vergessen Sie nicht, die Gummiaugenmuscheln der Okulare zu entfernen, damit der Alkohol das Gummi nicht angreift. Es wird auch empfohlen, die Tischoberfläche, den Lufttisch oder den Arbeitstisch mit 70%igem Ethanol in destilliertem Wasser und Kimwipes oder Papiertüchern zu reinigen.
Ein guter Grundsatz ist, das Mikroskopsystem in besserem Zustand zu verlassen, als Sie es vorgefunden haben. Entfernen Sie nach der Bildgebung alle Proben aus dem Mikroskopbereich. Die meisten Proben werden am besten bei 37 °C, Raumtemperatur, 4 ˚C, -20 ˚C oder -80 ˚C gelagert. Die meisten Objektträger oder Schalen werden bruchsicher und im Dunkeln aufbewahrt. Manche Proben müssen zurück in den Zellinkubator gestellt werden.
Weitere Reinigungstipps finden Sie in unserem beliebten Leitfaden: So reinigen und sterilisieren Sie Ihr Mikroskop.
Ausschalten des Mikroskopsystems
Durch korrektes Herunterfahren des Systems können Sie Folgendes sicherstellen:
- Die ordnungsgemäße Wartung der Hardware
- Die Einsatzbereitschaft des Systems für den nächsten Benutzer
Fragen Sie vor dem Herunterfahren des Systems nach, wann es das nächste Mal benutzt wird. Wenn das System sofort wieder benutzt wird, sollten Sie sich abmelden, aber die restliche Hardware eingeschaltet lassen. Wenn das System jedoch eine Stunde oder länger nicht benutzt wird, sollten Sie das System ausschalten. Dadurch werden Laser, Lampen, Lüfter und andere Komponenten, die abhängig von den Betriebsstunden ausgetauscht und gewartet werden müssen, geschont.
Beenden Sie immer die Software, bevor Sie die Hardwarekomponenten ausschalten. Wenn Sie z. B. eine Mikroskop-Steuerungsbox ausschalten, bevor Sie die Software beenden, kann dies zu einem Fehler und Problemen für den nächsten Benutzer führen. Denken Sie daran, dass die Software so etwas wie das Gehirn des Bildgebungssystems ist.
Kurzanleitung zur Fehlerbehebung bei der Rückkehr ins Labor
Wenn Sie bei der Bildgebung auf ein Problem stoßen, sind wir für Sie da! Hier finden Sie einige Lösungen für häufige Probleme, die Mikroskopiker bei der Rückkehr ins Labor haben können:
Problem 1: Mein Bild sieht unscharf aus. Ich kann das Bild fokussieren, aber es sieht nie scharf aus.
Vorschläge: Verwenden Sie Linsenpapier, um Objektive, Deckgläser und Okulare mit 70 % Ethanol in destilliertem Wasser zu reinigen. Stellen Sie sicher, dass Sie Deckgläser der Größe 1,5 verwenden. Prüfen Sie abschließend, ob Sie das richtige Immersionsmedium für dieses Objektiv verwenden.
Problem 2: Wenn ich das Objektiv wechsle, verliere ich völlig den Fokus.
Vorschläge: Vergewissern Sie sich, dass die parfokalen Korrekturen im TPC oder in der Software eingerichtet sind, falls verfügbar. Vergewissern Sie sich, dass die Objektive vollständig eingeschraubt sind. Überprüfen Sie die Anforderungen an die Immersion der Objektive. Dazu gehört auch die Überprüfung, ob das richtige Immersionsmedium verwendet wird und dass es nicht mit einem anderen Medium vermischt ist. Es ist nicht ungewöhnlich, dass Sie eine Schärfeanpassung benötigen, wenn Sie von einer niedrigen Vergrößerung zu einer hohen Vergrößerung wechseln. Ein Verlust der Schärfe beim Wechsel von hoher zu niedriger Vergrößerung deutet jedoch wahrscheinlich auf ein Problem mit der Parfokalität hin.
Problem 3: Wenn ich meine Fluoreszenzbilder ansehe, ist das Bild auf der einen Seite hell und auf der anderen dunkel. Das ist sicher nicht korrekt.
Vorschläge: Vergewissern Sie sich zunächst, ob dieses Muster (hell auf der einen und dunkler auf der anderen Seite) bestehen bleibt, wenn Sie den Tisch oder die Probe in XY-Richtung verschieben. Wenn das Muster bestehen bleibt, ist die Probe womöglich nicht flach. Wenn die Probe flach ist, könnte es sein, dass der Laser oder die Bogenlampe falsch ausgerichtet ist. Wenn Sie vermuten, dass der Fehler im Laser oder der Bogenlampe liegt, wenden Sie sich bitte an uns, bevor Sie versuchen, den Fluoreszenz-Anregungslichtweg auszurichten. Wenden Sie sich an Ihren örtlichen Vertriebsmitarbeiter oder an das Olympus Technical Assistance Center.
Problem 4: Wenn ich meine Bilder in einer anderen Software öffne, sehen die Bilder nicht so schön aus wie in der Olympus-Software.
Vorschläge: Können Sie die Dateien auf einer anderen Installation der Olympus-Software öffnen? Die Nutzung der Softwarelösungen von Olympus ist der bequemste Weg, um Auflösungs- oder Metadateninformationen zu erhalten. Wenn die Analysesoftware das Format TIFF oder ein anderes generisches Dateiformat erfordert, verwenden Sie TIFF-Rohdateien mit voller Auflösung. Diese TIFF-Rohdateien erscheinen oft schwarz, wenn sie nicht mit einer Bildbearbeitungssoftware geöffnet werden. Außerdem interpoliert Olympus-Software mitunter, wenn der Zoom auf das Bild angewendet wird. Nicht jede Software interpoliert die Pixel, wenn ausreichend Zoom angewendet wird. Dies kann manchmal dazu führen, dass Bilder in der Olympus-Software anders aussehen als in FIJI/ImageJ.
Problem 5: Mein Labor verwendet seit Jahren Deckgläser der Größe 1, und wir haben viele Kisten davon im Labor. Wie wichtig ist es für uns, auf Deckgläser der Größe 1,5 zu wechseln?
Vorschläge: Olympus-Objektive sind für Deckgläser der Größe 1,5 ausgelegt, es sei denn, es handelt sich um Wasserimmersionsobjektive. Es treten optische Artefakte auf, wenn sich nicht genügend Glas zwischen Objektiv und Proben befindet. Inwieweit dies von Bedeutung ist, hängt von dem Experiment und den Anforderungen an die Bildgebung ab. Unabhängig davon werden Ihre Bilder suboptimal aufgelöst, und auch die Bildgebung ist nicht optimal. Wir empfehlen, so bald wie möglich auf Deckgläser der Größe 1,5 umzustellen.
Ähnliche Themen
Empfehlungen für eine erfolgreiche Rückkehr ins Labor
Leitfaden für Remote-Mikroskopie: 6 Tipps zum erfolgreichen Einrichten Ihres Labors
5 praktische Möglichkeiten, Mikroskopie-Experimente zu beschleunigen
.jpg?rev=4C75)
