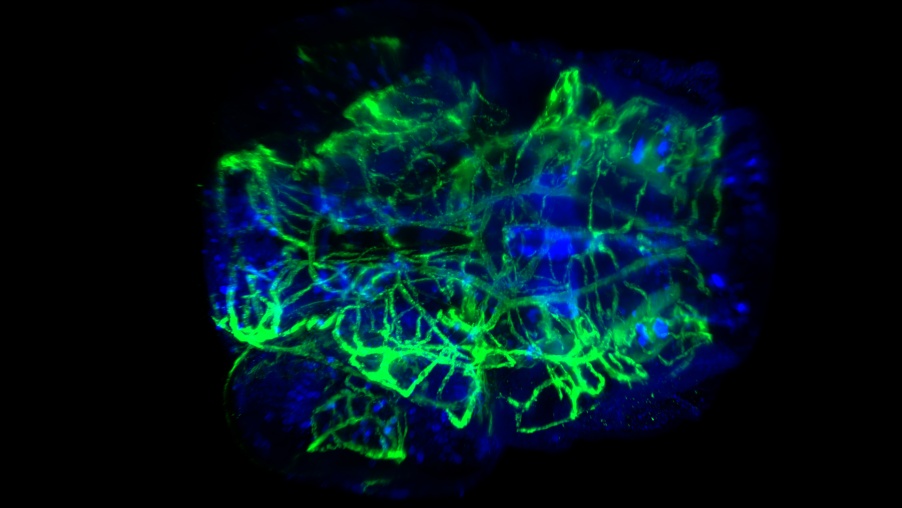
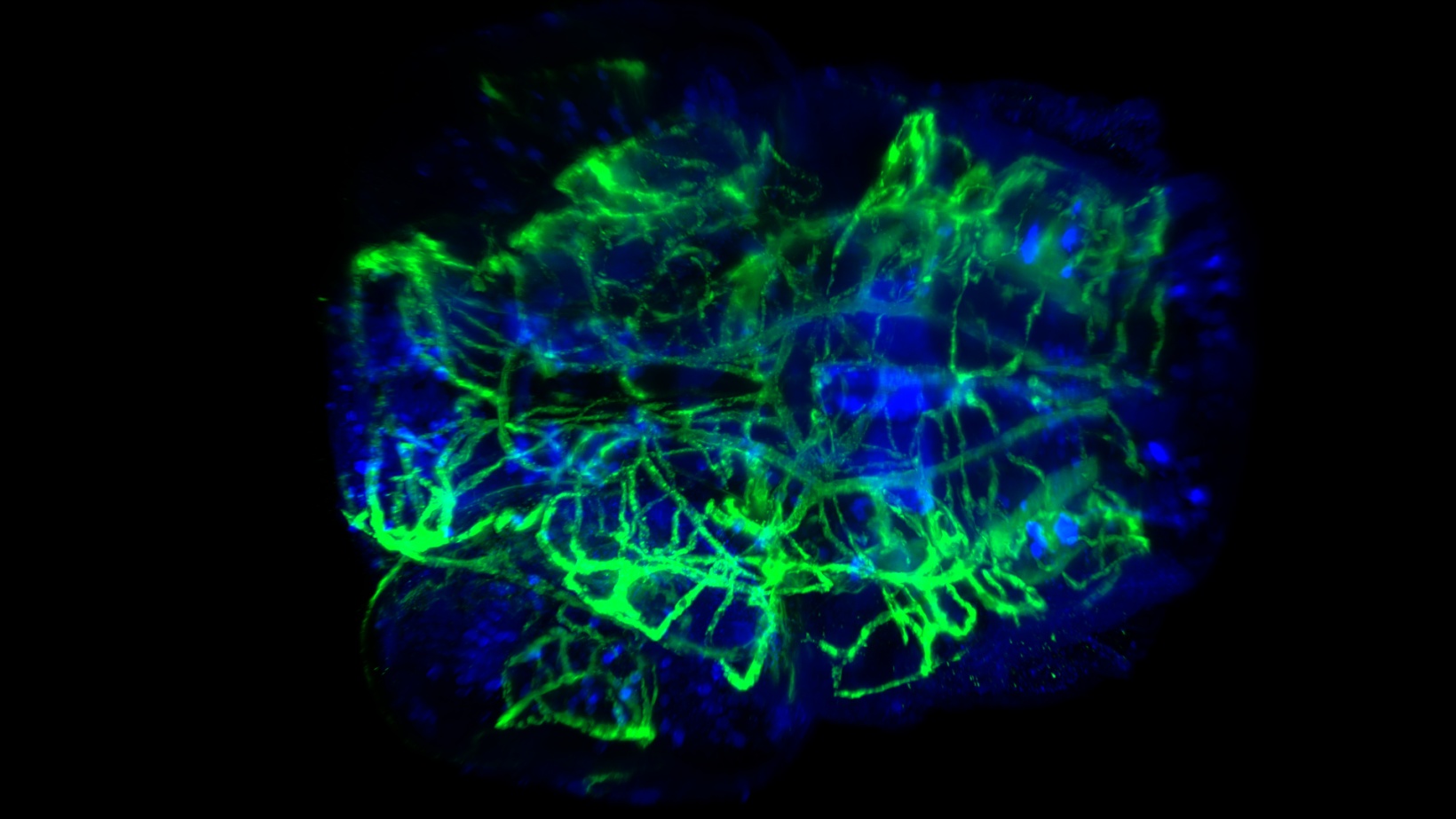
Färbung von Gefäßen und Nerven im Kopf einer transparenten Zebrafischlarve. Aufgenommen bei 20facher Vergrößerung mit 0,5 NA und CUBIC-2. Bild mit freundlicher Genehmigung von P. Affaticati und A. Jenett, Tefor Facility, Frankreich.
Wir leben in einer dreidimensionalen, sich ständig verändernden Welt. Doch in der Mikroskopie bleibt die dreidimensionale Bildgebung mit einer Geschwindigkeit, die für die Beobachtung schneller Lebensprozesse ausreicht, eine Herausforderung. Im Vergleich zu anderen Lichtmikroskopietechniken bietet die Fluoreszenzmikroskopie hohe Spezifität und hohen Kontrast, obwohl das Verfahren immer noch starken Einschränkungen durch das Signal-Rausch-Verhältnis und Phototoxizität unterliegt.
Bei herkömmlichen Ansätzen wie der Konfokalmikroskopie wird unscharfes Licht durch einen Prozess, der als optischer Schnitt bekannt ist, mithilfe einer Lochblende innerhalb der Fokusebene eliminiert. Diese Methode ergibt zwar ein besseres Signal-Rausch-Verhältnis, jedoch muss die Probe wiederholt großen Mengen von unfokussiertem Licht ausgesetzt werden, was die Wahrscheinlichkeit eines Photobleachings erhöht.
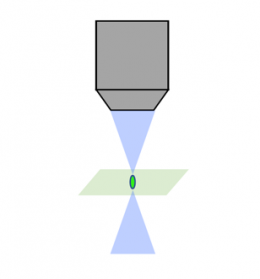 Laser-Scanning, konfokal | 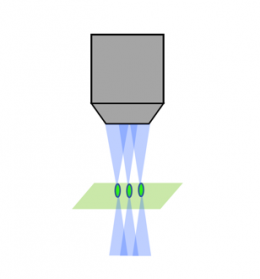 Spinning Disk, konfokal | 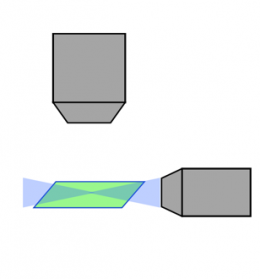 Lichtscheibe |
Und es ward Licht – die Einführung der Lichtscheibenmikroskopie
In den 1900er Jahren begannen Wissenschaftler nach einer Möglichkeit zu suchen, die Bildgebung in der Biologie zu verbessern. Eine dieser Technologien entstand 1902 mit einem optischen Gerät namens „Ultramikroskop“, das von Richard Zsigmondy und Henry Siedentopf entwickelt wurde (Heddleston und Chew, 2016; Adams et al., 2016). Dieses frühe Lichtscheibenmikroskop brach mit der herkömmlichen optischen Architektur durch die Trennung der Strahlengänge für Beleuchtung und Detektion, wodurch das erste orthogonale Lichtscheibenmikroskop entstand.
Fast 100 Jahre später veröffentlichten Voie et al. die ersten mit einem Lichtscheiben-Fluoreszenzmikroskop (LSFM) aufgenommenen Bilder, indem sie die Architektur orthogonaler Ebenen nutzten, um die Cochlea eines Meerschweinchens optisch zu zergliedern (Heddleston & Chew, 2016; Adams et al., 2016). In jüngerer Zeit wurden Variationen von LSFMs entwickelt, um Bakterien, Drosophila, Zebrafische und verschiedene andere Gewebe abzubilden.
Breite Einführung der Lichtscheiben-Fluoreszenzmikroskopie
Moderne Systeme für die LSFM, die auch unter der Bezeichnung Selective Plane Illumination Microscopy (SPIM) bekannt sind, basieren wie ihre Vorgänger auf Varianten der orthogonalen Architektur. Um die dünne Lichtscheibe für den optischen Schnitt zu erzeugen, werden jedoch Zylinderlinsen genutzt. Diese dünne Lichtscheibe regt nur eine Teilregion der Probe innerhalb der Brennebene des bildgebenden Objektivs an. In Kombination mit einer sCMOS-Hochgeschwindigkeitskamera zur Erfassung des emittierten Lichts bietet die LSFM im Vergleich zu herkömmlichen konfokalen Technologien größere Abtasttiefen, ein besseres Signal-Rausch-Verhältnis, höhere Abbildungsgeschwindigkeiten und damit auch eine Verringerung der Phototoxizität.
Das Lichtscheiben-Fluoreszenz-Imaging ist mittlerweile als Schlüsseltechnik der Mikroskopie zur Untersuchung ganzer Organe oder lebender Proben anerkannt. Ihrer Verbreitung in der wissenschaftlichen Gemeinschaft stehen jedoch nach wie vor der relativ limitierte Anwendungsbereich und die begrenzten Möglichkeiten der Anpassung an aktuelle Systeme im Weg. Seit einigen Jahren gibt es „serienmäßige“ LSFM-Systeme, um den Bedürfnissen von Wissenschaftlern in den biologischen Disziplinen gerecht zu werden. Allerdings sind nicht alle Systeme gleich aufgebaut, und es ist wichtig, zu überlegen, ob die unterschiedlichen Merkmale Ihren jeweiligen Anforderungen genügen.
4 wichtige Aspekte beim Vergleich von LSFM-Systemen
Bei der Entscheidung, welches Lichtscheiben-Fluoreszenzsystem für Sie am besten geeignet ist, sind einige wichtige Punkte zu beachten.
- Zunächst und vor allem ist die Probenvorbereitung zu berücksichtigen:
Anders als bei der traditionellen Mikroskopie, bei der große fixierte Proben typischerweise geschnitten und auf Objektträger aufgebracht werden, erfolgt die Bildgebung bei der Lichtscheibenmikroskopie an der intakten Probe. Diese muss daher optisch geklärt, also durchsichtig gemacht werden. Es gibt eine Reihe von Protokollen zur Klärung verschiedener Gewebe, und viele Klärlösungen sind auch kommerziell erhältlich. Ich empfehle die Lektüre von „A beginner’s guide to tissue clearing“ von Pablo Ariel (Int J Biochem Cell Biol. 2017 Mar. 84: 35–39) mit einem Überblick über einige gängige Methoden. - Optische Architektur:
Die optische Architektur für den Beleuchtungs- und den Detektionspfad kann erheblichen Einfluss auf die Größe und Art der Proben haben, die beobachtet werden können, ebenso wie auf die Qualität Ihres Bildes. Zum Beispiel entstehen durch die Brechung des emittierten Lichts an einer undurchsichtigen Struktur in der Probe streifenförmige Artefakte. Um dieses Problem zu lösen, wurde eine Vielzahl optischer Architekturen für die Bildaufnahme an lebenden oder transparenten Proben jeglicher Größe entwickelt. Ein Beispiel ist die multidirektionale SPIM (mSPIM) mit einer Architektur, bei der mehrere aufeinander abgestimmte Beleuchtungsstrahlengänge zur Beleuchtung der Probe eingesetzt werden, wodurch sich Streifenartefakte vermeiden lassen. Zwar können mSPIM-Systeme für bestimmte Anwendungen optimale Leistung bieten, jedoch bestehen stets Einschränkungen in Bezug auf Flexibilität, Modularität und praktische Anwendung, die bei der Auswahl des für Ihre Forschungsarbeiten am besten geeigneten Systems berücksichtigt werden sollten.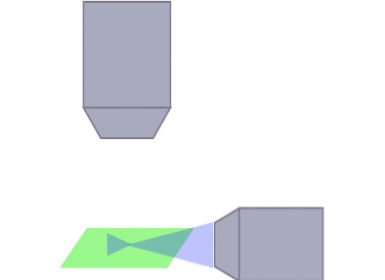
SPIM
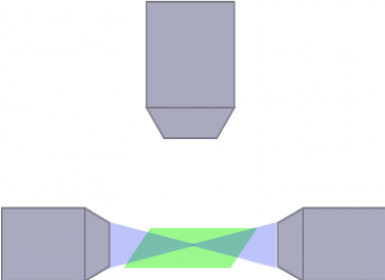
mSPIM
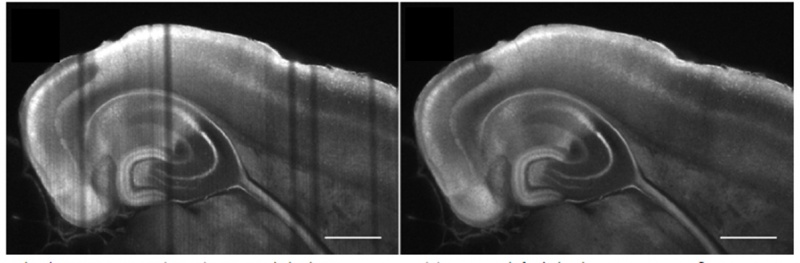
(Schwarz, et al. PLoS One, 2015)
- Probenflexibilität:
Die LSFM ist ein schnell expandierendes Feld, in dem jedes Jahr neue Systeme auf den Markt kommen. Die unterschiedlichen Bauweisen der einzelnen Geräte bedingen ein hohes Maß an Variation in Bezug auf die Probenarten, die damit untersucht werden können. Mit einigen Systemen können ausschließlich kleinere Proben wie zum Beispiel Sphäroide abgebildet werden, mit anderen dagegen nur größere Gewebe. Außerdem können sie beispielsweise auf die Abbildung entweder fixierter oder lebender Proben beschränkt sein. Diese Art der Spezialisierung mag vielleicht für einen Anwender, der sich auf einen bestimmten Probentyp konzentriert, ideal sein, aber die Möglichkeit, das Gerät in einer ganzen Forschungsabteilung zu nutzen oder damit neue Erkenntnisse in der Forschung zu gewinnen, ist begrenzt. Es ist wichtig, sämtliche potenziellen Probenarten zu berücksichtigen, die mit Ihrem LSFM untersucht werden sollen. Kürzlich wurden flexiblere LSFM-Systeme entwickelt, um diese Lücke hinsichtlich der Probenvariabilität zu schließen. Das Alpha3-Lichtscheiben-Fluoreszenzmikroskop zum Beispiel eignet sich für eine Vielzahl von Proben, von einzelnen Zellen bis hin zu ganzen Mäusehirnen, einschließlich lebender Organismen.* - Datenverwaltung:
Der letzte und möglicherweise wichtigste Punkt ist die Datenverwaltung. Nicht selten werden bei einem einzigen Experiment mehrere 100 Gigabyte (GB) oder sogar Terabyte (TB) an Daten produziert. Es empfiehlt sich dringend, mit der IT-Abteilung vor Ort zusammenarbeiten, um einen Plan für Ihren Datenverwaltungsbedarf aufzustellen. Seien Sie sich bewusst, dass Sie möglicherweise ein separates Analysesoftwarepaket erwerben müssen, um solch große Datensätze wiedergeben und analysieren zu können.
Ähnliche Themen
Hundert Jahre Kreativität – Die Geschichte unserer Imaging-Systeme für die Biowissenschaften
Olympus Galerie digitaler Fluoreszenzbilder
*Das Alpha3-System ist nicht in allen Regionen erhältlich. Für weitere Informationen kontaktieren Sie bitte Ihren zuständigen Olympus Händler.