Multimodales Imaging und Fluoreszenz-Multiplexing sind zu wichtigen Methoden für die effiziente Untersuchung verschiedener Elemente von Proben in einem einzigen Experiment geworden. Die quantitativen Ergebnisse solch eines Experiments hängen jedoch von der Möglichkeit ab, reiche Bilddaten zu extrahieren.
Die Bedeutung der Bildgebung ganzer Objektträger für die Quantifizierung
Das Grundprinzip der „Bildgebung ganzer Objektträger“ besteht darin, stark vergrößerte Bilder mit einem kleinen Sehfeld digital zu einem größeren Überblick über die Probe zusammenzusetzen. Wozu das?
Ganz einfach: Die Stärke der Bildgebung ganzer Objektträger, die manchmal auch als digitale Bildgebung ganzer Objektträger oder virtuelle Mikroskopie bezeichnet wird, besteht darin, einem mikroskopischen Bild einen vollständigeren biologischen Kontext zu geben. Eine oder zwei Zellen isoliert bei starker Vergrößerung zu betrachten, kann informativ sein – aber wenn man diese Zellen in den größeren Zusammenhang ganzer Gewebe stellt, bietet das noch umfassendere Untersuchungsmöglichkeiten.
Warum nimmt man dann nicht einfach ein Makrobild des Gewebes auf? Der Vorteil der Bildgebung ganzer Objektträger ist die Makro-zu-Mikro-Ansicht, wobei die mikroskopische Auflösung eine bessere Quantifizierung der Bilder ermöglicht, sei es beim Zählen von Kernen im gesamten Gewebe oder beim Aufspüren von Axonen über große Entfernungen im Gehirn.
Aufgrund dieser leistungsstarken Kombination von Auflösung und biologischem Kontext ist die automatisierte Bildgebung ganzer Objektträger zu einem Eckpfeiler vieler Forschungsprogramme geworden. Lesen Sie weiter, um mehr über die leistungsstarken Beobachtungsmöglichkeiten zu erfahren, mit denen Sie neue Informationen aus Ihren Proben gewinnen können.
Bildverarbeitungsfunktionalitäten von automatisierten Scan-Systemen für die Objektträger-Digitalisierung
Jahrelang waren Imaging-Systeme für die ganzer Objektträger in ihren Bildgebungsmodi eingeschränkt. Heute lassen sich mithilfe automatisierter Imaging-Systeme für ganze Objektträger wie unserem Objektträger-Scanner für die Forschung VS200 mehrere Mikroskopieverfahren kombinieren, sodass Strukturen betrachtet werden können, die nur unter bestimmten Bedingungen sichtbar sind. Das bedeutet, dass Sie Mikroskopieverfahren mischen und kombinieren können, beispielsweise:
- Hellfeld: Bei der Hellfeldbildgebung passiert transmittiertes Weißlicht die Probe und Gewebe werden durch chromogene Färbung sichtbar gemacht. Hellfeldbeleuchtung liefert jedoch keinen probeneigenen Kontrast, es sei denn, es werden chromogene Farbstoffe wie Hämatoxylin und Eosin verwendet.
- Epifluoreszenz: Dieses Verfahren schließt die spezifische Markierung mit Antikörpern und höhere Grade molekularer Zieladressierung ein. Es ermöglicht auch die Überlagerung einer größeren Anzahl von Färbungen, wodurch sich das Feld des Multiplexing eröffnet.
- Phasenkontrast und Polarisation: Phasenoptik und Polarisation können auf ganze Objektträger-Bilder angewendet werden, wodurch auf der Basis von Phasenringbeleuchtung oder polarisiertem Licht verschiedene Niveaus an probeneigenem Kontrast erzielt werden können.
- Dunkelfeld: Hier werden Brechungsindexunterschiede an membranösen Strukturen in Geweben genutzt. Obwohl bestimmte Färbungen die Dunkelfeldbeobachtung verbessern können, kann die Technik völlig markierungsfrei durchgeführt werden und ein Kontrastniveau liefern, das mit dem unter Fluoreszenzlicht erzielten vergleichbar ist. Dieser Beobachtungsmodus kann jedoch empfindlich gegenüber Staub sein.
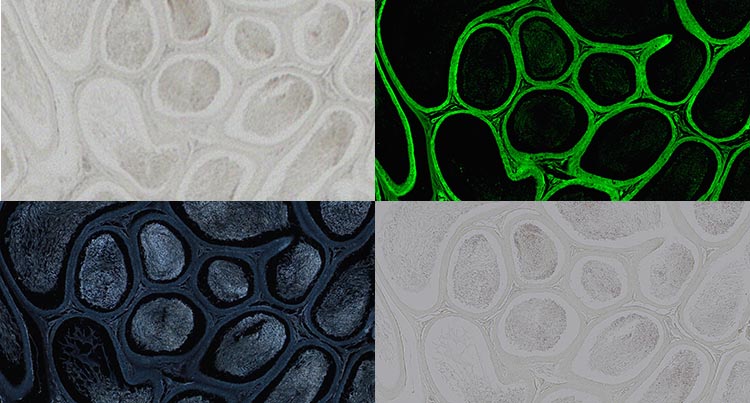
Hoden in Permount-Eindeckmedium, nicht gefärbt, aufgenommen mit einem 20x Objektiv. Hellfeld (oben links), Fluoreszenz (oben rechts), Dunkelfeld (unten links), Polarisation (unten rechts). Bild mit freundlicher Genehmigung von Robin Wacker, Günthersleben, Deutschland.
Doch das ist nicht alles – die neuesten virtuellen Objektträger-Scanner bieten auch Bildverarbeitungs-Tools, die dabei helfen, bessere Daten von Ihren Experimenten zu gewinnen. So kann zum Beispiel mit unserem VS200 Objektträger-Scanner durch mehrere Gewebeebenen hindurch fokussiert werden. Dies erlaubt:
- Erfassung mehrerer Ebenen mit der höchsten Auflösung
- Imaging von Proben mit einer Dicke von bis zu 100 µm
- Bilderfassung unter Verwendung aller verfügbarer Mikorskopieverfahren
- Einfache Gewinnung von Informationen aus allen Dimensionen der Probe
- Berechnen von Projektionen (Dekonvolution, Maximum Z oder EFI)
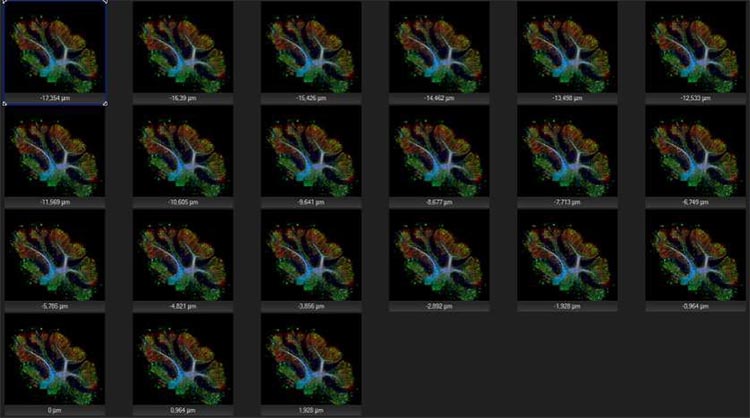
Mittels Z-Stapelung können bis zu 35 Ebenen mit höchster Auflösung erfasst werden, wodurch es einfach ist, Informationen aus allen Dimensionen der Probe zu erhalten.
Ein weiteres hilfreiches Werkzeug ist der automatische Ölabgabemechanismus, mit dem das System höchste Auflösung erreicht.
Die Vereinigung dieser verschiedenen Bildgebungsmodi und -funktionen ist noch leistungsfähiger, wenn sie mit der molekularen Spezifität kombiniert wird, die durch Antikörper-Markierungstechniken erreicht wird. Dennoch kann es immer noch schwierig sein, eine effiziente und quantitative Fluoreszenzmarkierung zu erhalten.
Vor diesem Hintergrund befassen wir uns im nächsten Abschnitt mit Bildgebungstechnologien, die bei Fluoreszenz-Multiplexing-Anwendungen hilfreich sein können.
Technologische Grundlagen für das Gewebe-Multiplexing
Fluoreszenz-Multiplexing zur Untersuchung der unglaublich komplexen Tumor-Mikroumgebung ist zu einem nützlichen Werkzeug in der immuno-onkologischen Forschung geworden. Allerdings erfordert es eine spezialisierte Software, Personal und Ausrüstung, um einen Assay zum Laufen zu bringen und auf einen bestimmten Tumor anzuwenden.
Die Hersteller haben neue Technologien entwickelt, die auf die verschiedenen Bedürfnisse und Probleme eingehen, die bisher eine breitere Anwendung dieser Art von Assays verhindert haben. Zu diesen technologischen Must-Haves gehören:
Multiplexing auf hohem Niveau, das diese Probleme angeht:
| ✓ Workflow-Kompatibilität mit folgenden Vorteilen:
|
Bildgebung ganzer Objektträger, die folgende Merkmale erfasst:
| Software, die komplexe Phänotypen identifiziert:
|
Überblick über den UltiMapper™ Multiplex-Marker-Assay
Ein weiteres hilfreiches Tool bei Multiplex-Imaging-Experimenten ist der UltiMapper I/O-Assay.
UltiMapper I/O-Assays nutzen die InSituPlex® Technologie für das hochauflösende Ganzpräparate-Multiplexing zur Phänotypisierung von Zellen und zur räumlichen Profilierung der Biomarker-Aktivität. Als voroptimierte, reagenzienbasierte Lösung lassen sich diese Kits problemlos in bestehende Ausrüstung und Software über den gesamten Arbeitsablauf der Immunhistochemie (IHC) hinweg integrieren und ermöglichen die Durchführung aller Schritte von der Färbung zur Bilderfassung und -auswertung an nur einem Tag.
Die folgende Abbildung illustriert den einfachen, 4-stufigen Prozess:
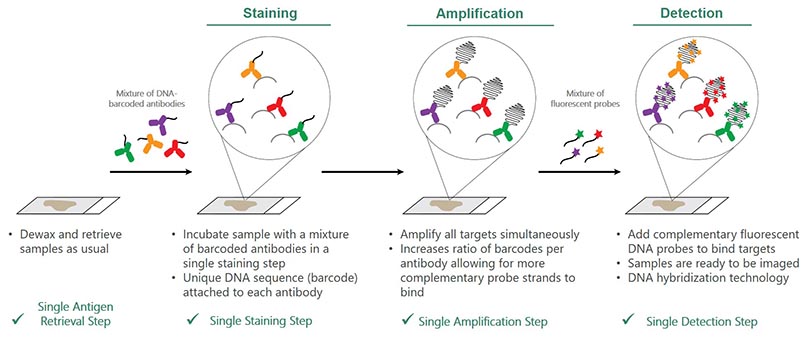
Schritt 1: Demaskierung:
- Die Proben werden wie üblich entparaffiniert und demaskiert
Schritt 2: Färbung
- Die Proben werden mit einem Gemisch barcodierter Antikörper in einem einzigen Färbeschritt markiert
- An jeden Antikörper ist eine eindeutige DNA-Sequenz (Barcode) angefügt
Schritt 3: Amplifikation
- Alle Zielsequenzen werden gleichzeitig amplifiziert
- Dies erhöht das Verhältnis Barcodes zu Antikörper, sodass mehr komplementäre Probenstränge binden können
Schritt 4: Nachweis
- Es werden komplementäre fluoreszenzmarkierte DNA-Sonden hinzugefügt, die an die Zielsequenzen binden
- Die Proben sind bereit für das Imaging
- DNA-Hybridisierungstechnologie
3 Faktoren, die die Bildqualität zum Zweck der Quantifizierung verbessern
Denken Sie bei der planung Ihres Experiments daran, dass die richtige Kombination von optischen und Färbetechnologien eine optimale nachgelagerte Analyse ermöglicht. So sehr Sie auch versuchen, mit einem minderwertigen Reagenziensatz oder einer schlechten Aufnahmetechnik und optischer Konfiguration erzeugte Bilder geringer Qualität zu analysieren – sie werden keine guten Ergebnisse erhalten.
Hier sind drei optische Faktoren, die die Bildqualität für die Quantifizierung beeinflussen:
- Exakte Beleuchtungsfarbe: Bei der HE-Färbung ist eine reproduzierbare und naturgetreue Farbwiedergabe wichtig. Die Durchlichtoptik sollte für die Wiedergabe violetter, cyanfarbender und pinkfarbener Töne spektrale Charakteristika aufweisen, die denen von Halogenlichtquellen entsprechen.
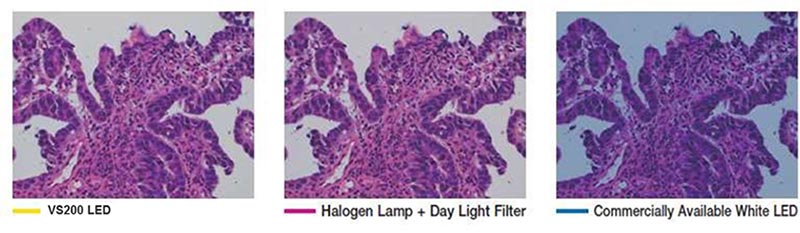
Die Echtfarben-LED-Beleuchtung der VS200-Scannereinheit für Durchlichtbeleuchtung hat die gleichen spektralen Eigenschaften und bietet die gleiche Leistung wie eine Halogenlampe, sodass violette, blaugrüne und pinke Färbungen richtig dargestellt, im Bild erfasst und wiedergegeben werden.
- Farbtreue und Farbpräzision: Die Mikroskopkamera sollte nicht nur die richtigen spektralen Beleuchtungseigenschaften aufweisen, sondern auch eine ausgezeichnete Farbtreue und -präzision. Stellen Sie sicher, dass Sie eine farbkorrigierte Kamera mit dem richtigen Abgleich verwenden, damit das Gewebe genau dargestellt wird. Der Blick auf Digitalbilder kann subjektiv sein, da unterschiedliche Aufnahmeeinstellungen zu unterschiedlichen Bildresultaten führen. Farbkorrigierte Kameras und ICC-Profile ermöglichen jedoch eine ausgezeichnete Wiedergabe von Farbe und Intensität auf dem Computermonitor.
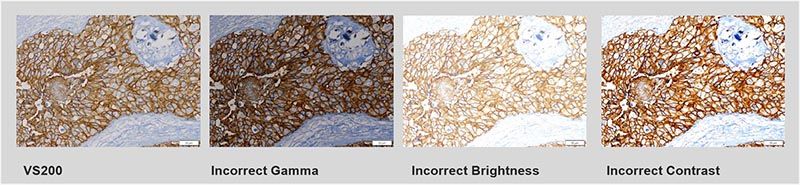
Das Betrachten von Digitalbildern kann subjektiv sein, da unterschiedliche Aufnahmeeinstellungen zu unterschiedlichen Bildergebnissen führen. Der VS200-Scanner ist mit farbkorrigierten Kameras ausgestattet und liefert ICC-Profile für eine ausgezeichnete Farb- und Intensitätswiedergabe auf dem Computermonitor.
- Ebenheit des Bildfeldes: Die Aufnahme einer Bildserie, bei der das Bildfeld nicht flach ist oder keine Korrektur durchgeführt wurde, kann einen Lichthof-Effekt in allen Sehfeldern verursachen, der ein Problem für die Quantifizierung darstellt. In diesem Fall müssen Sie einen nichtlinearen Ausgleich und eine Filterung in jedem Sehfeld vornehmen, was Zeit und Ressourcen kostet. Ziehen Sie die Verwendung einer optischen Konfiguration in Betracht, die dazu beiträgt, die Planität des Sehfeldes zu maximieren, um zu einem besseren quantitativen Ergebnis zu gelangen.
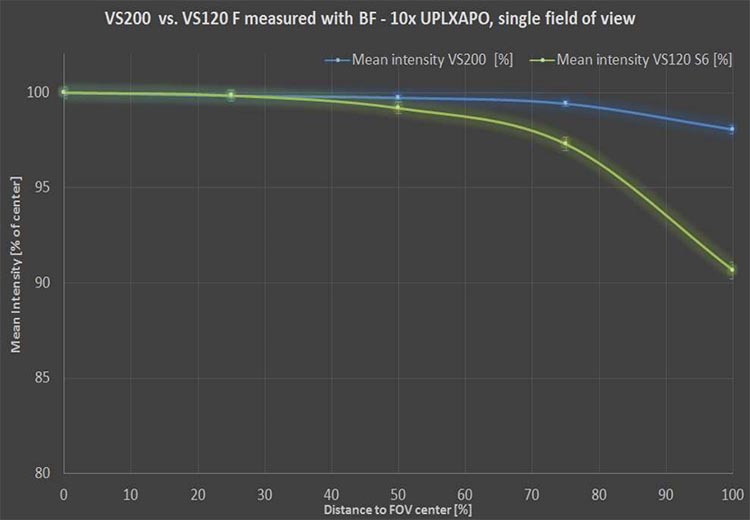
Die leistungsstarken X Line™ Objektive des Objektträger-Scanners VS200 tragen zur Verbesserung der Planität bei.
Abschlussbemerkungen
Da Bilder im Volumen als Z-Stapel mit mehreren Fokussierungen aufgenommen werden können, lässt sich der Kontrast der Bilder durch Methoden wie Dekonvolution, Projektionen mit maximaler Intensität oder Ansichten mit erweiterter Scharfeinstellung verbessern und verstärken, sodass die beste Scharfeinstellung für das Bild ausgewählt werden kann.
Letztendlich ist das beste Rezept für eine quantitative Analyse eine Kombination aus guter Markierung, guter Optik und einer Software, die robust genug für die Segmentierungsanalyse ist und statistische Informationen erfasst, die biologisch relevant sind.
Wenn Sie mehr über die Extraktion reichhaltiger Daten aus Ihren multimodalen Imaging- und Fluoreszenz-Multiplexing-Experimenten erfahren möchten, besuchen Sie mein On-Demand-Webinar hier.
Ähnliche Themen
5 Vorteile, die der VS200 Objektträger-Scanner Ihrer Forschung bieten kann
.jpg?rev=E220)
