Das digitale Bildgebungssystem APEXVIEW APX100 unterstützt viele verschiedene Mikroskopieverfahren. Die einfach anzuwendenden, komfortablen Funktionen und die intuitive Software ermöglichen eine effizientere Ausführung verschiedener Forschungsanwendungen, ohne Kompromisse bei der Bildqualität einzugehen.
Diese Galerie zeigt Anwendungsbeispiele, die mit dem digitalen Bildgebungssystem APX100 aufgenommen wurden. Bei anwendungsbezogenen Fragen stehen wir gerne zur Verfügung.
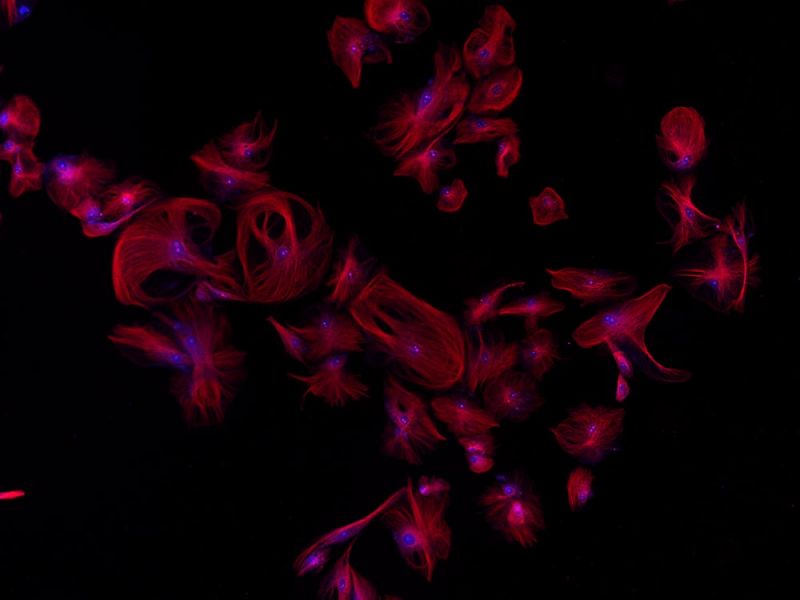
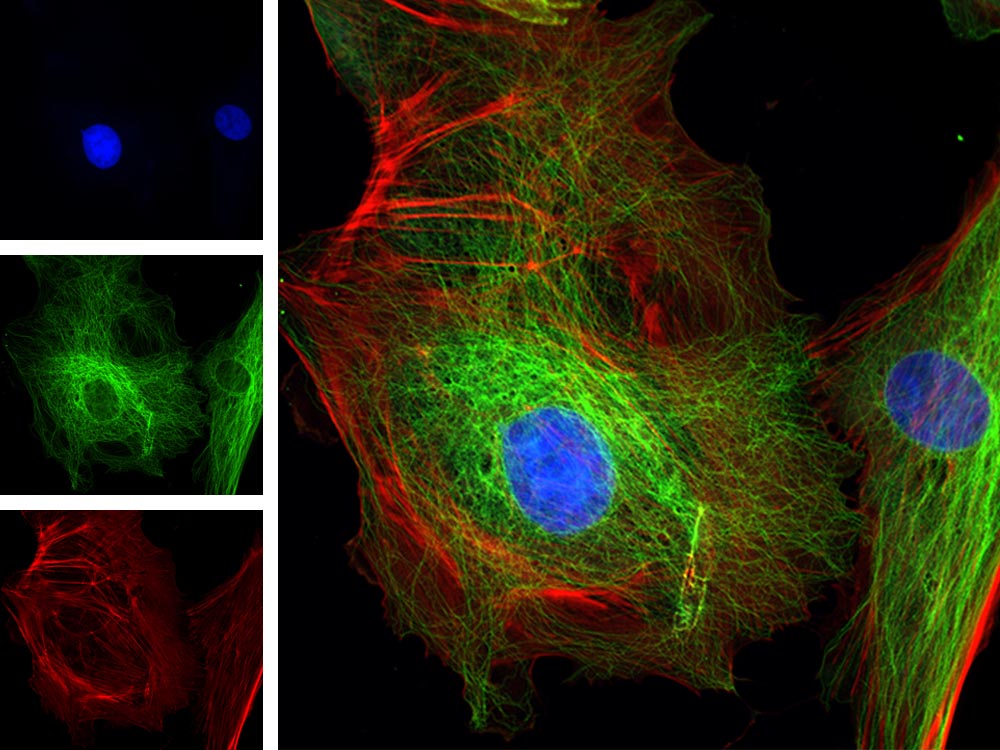 | Mehrkanal-Fluoreszenz
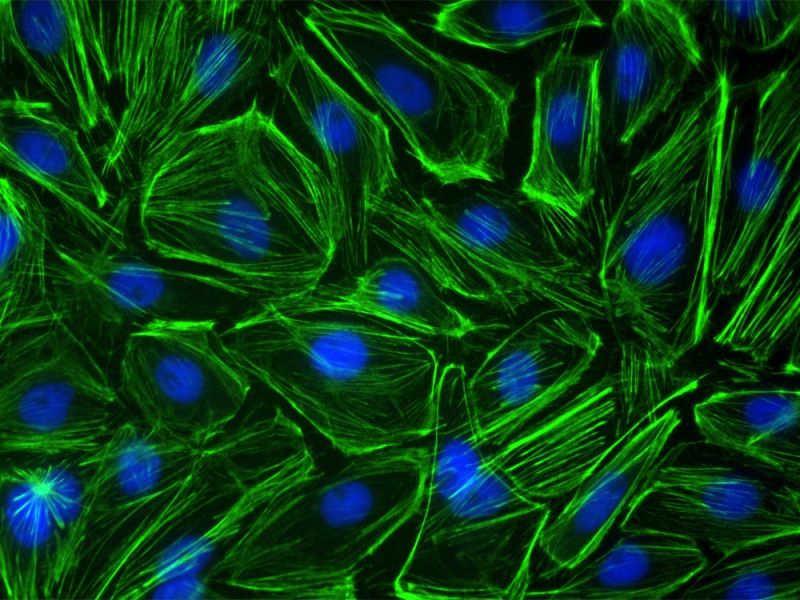
BPAE-Zellen. Färbung: Maus-Anti-α-Tubulin, BODIPY FL Ziege-Anti-Maus-IgG, Texasrot-X-Phalloidin, DAPI. |
|---|
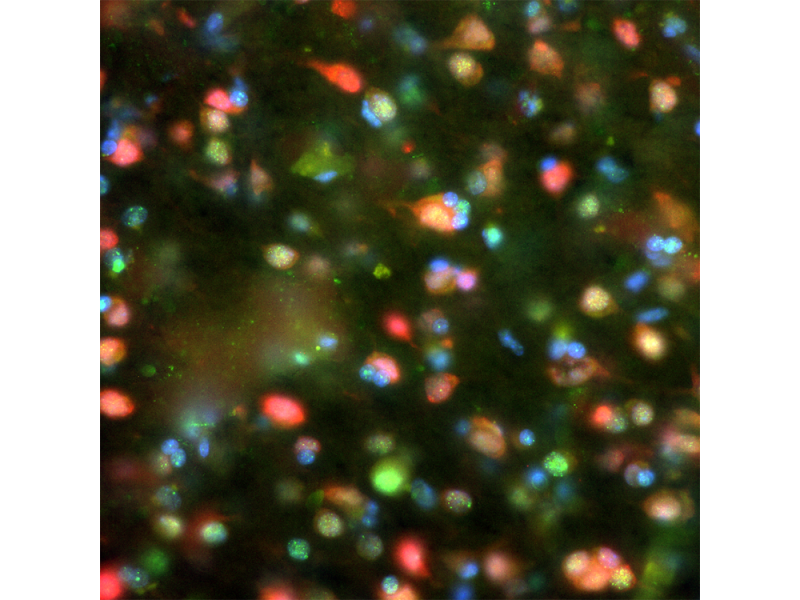
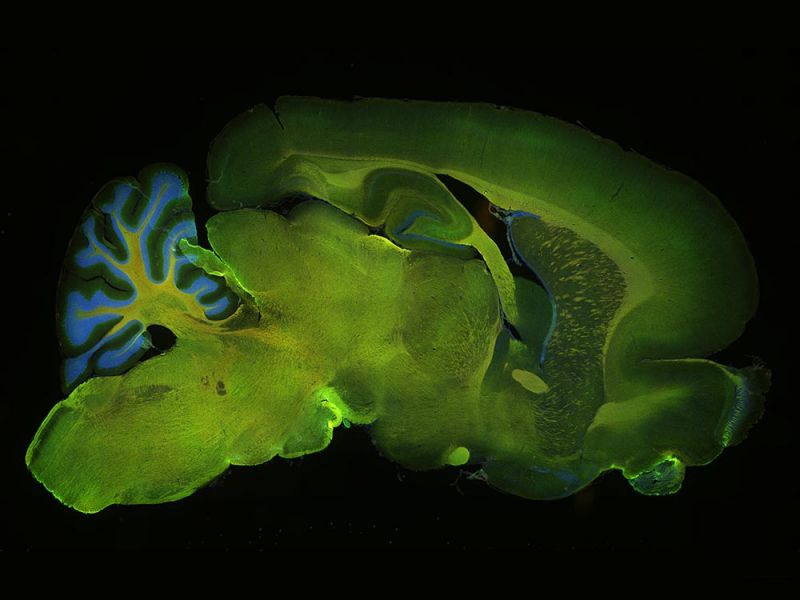
Mit 5 Fluorochromfarbstoffen markiertes Kleinhirn einer RatteEinfache Aufnahme von Mehrkanal-Fluoreszenzbildern mit Wellenlängen von UV bis NIR. Verwendete Färbungen: Hoechst (blau), GFAP (grün), MAP2 (orange), Calbindin (rot), MBP (magenta). Objektiv: UPLXAPO4X | 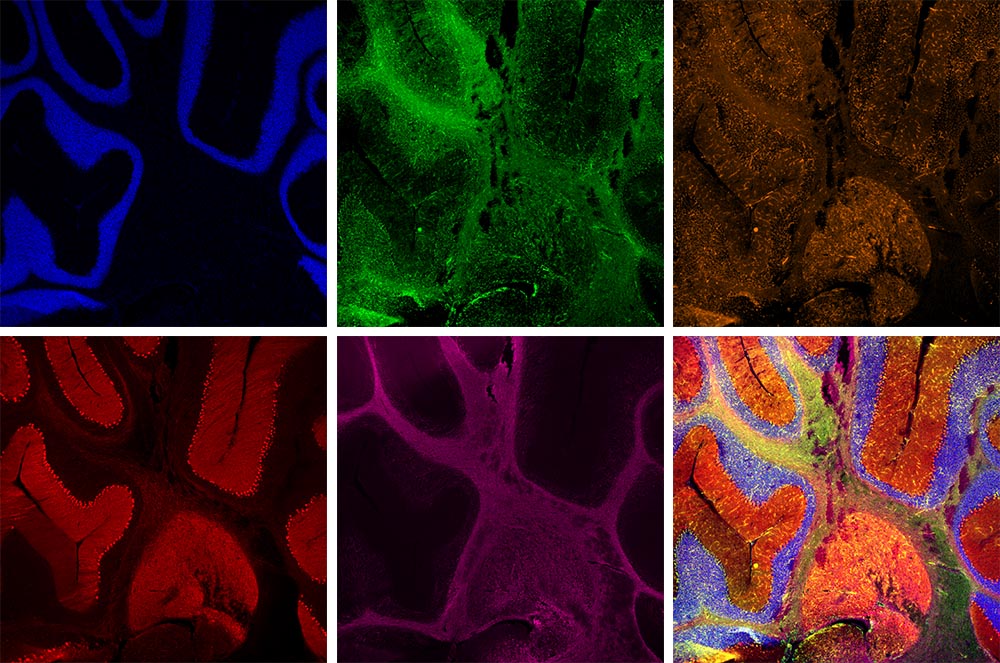 |
|---|
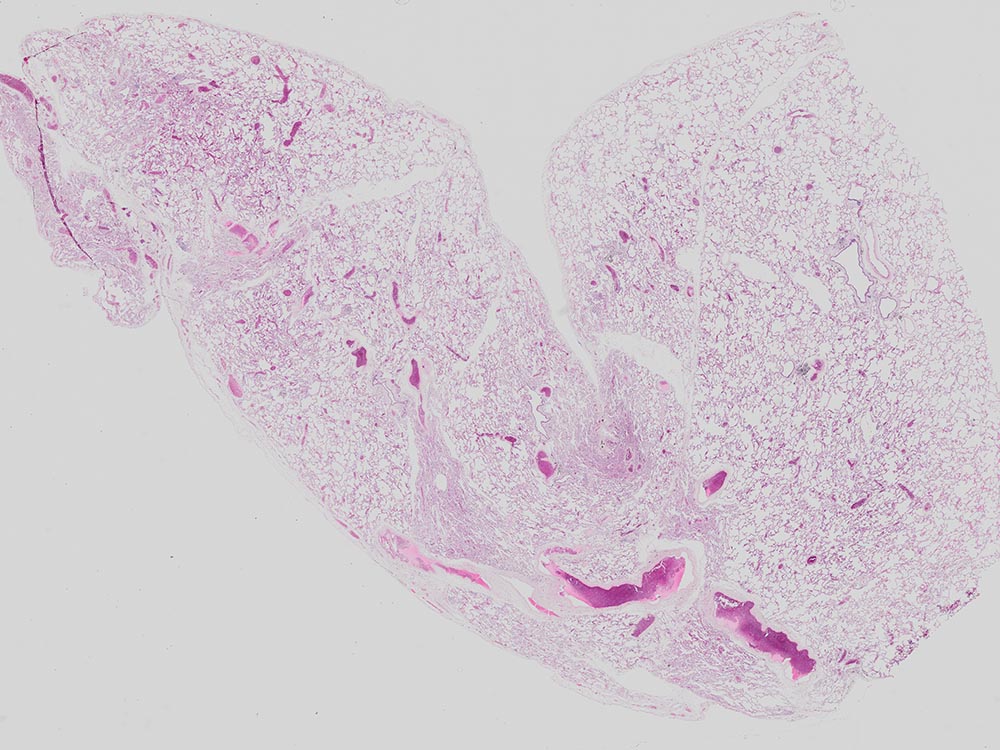 | Stitching
Mauslunge, aufgenommen mit dem UPLXAPO4X Objektiv. Färbung: HE. |
|---|
Z-Stapel
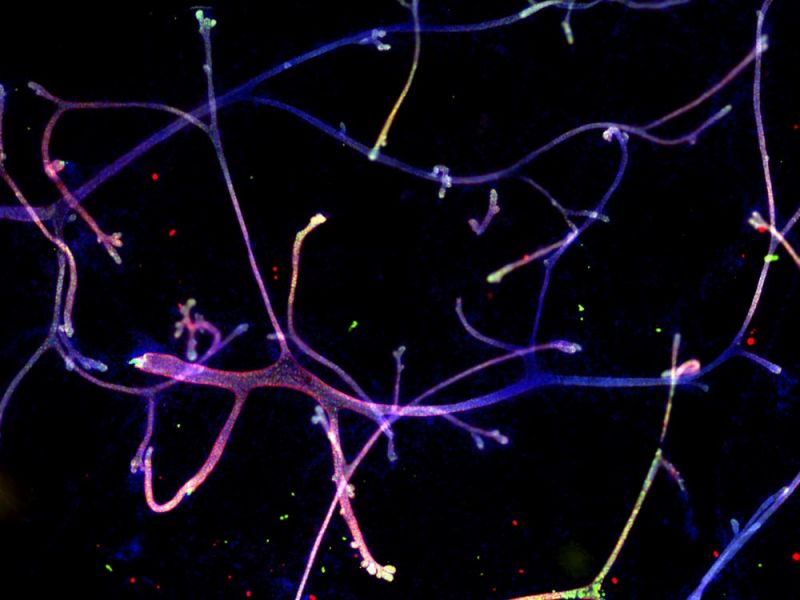
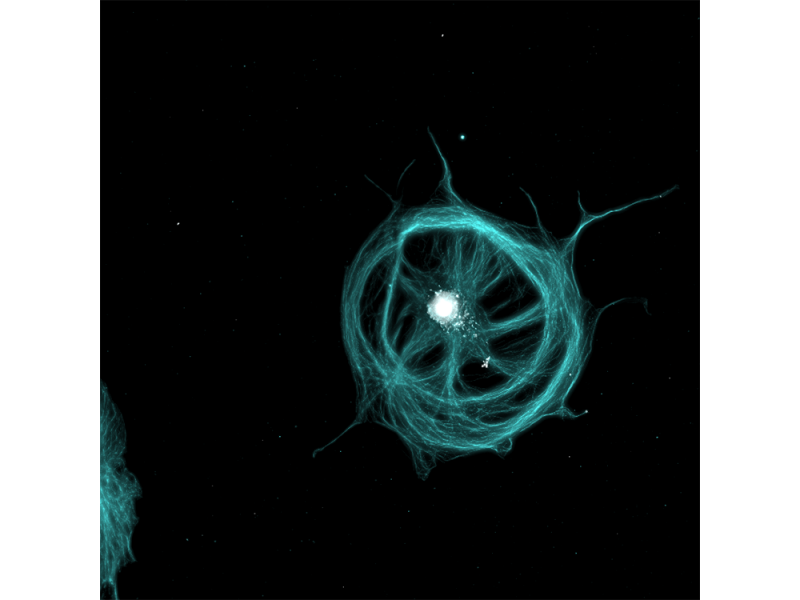
Subzelluläre Lokalisierung von Kendrin/Perizentrin, Zentrosomenprotein. Bildquelle: Kazuhiko Matsuo, Ph.D., Division of Developmental Biology and Anatomy, Department of Anatomy, Kyoto Prefectural University of Medicine. | 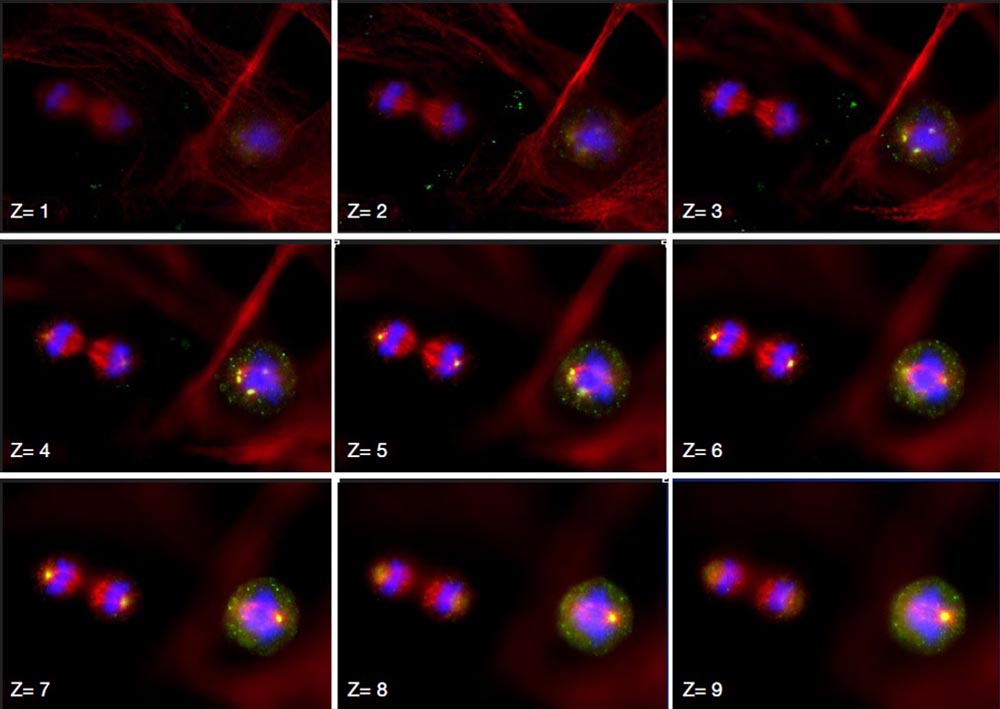 |
|---|
Zeitraffer-Bildgebung
- Die Veränderungen in einer lebenden Zelle oder einer ganzen Zellkultur können kontinuierlich über einen bestimmten Zeitraum aufgezeichnet werden.
- Ein eingebauter Antivibrationsmechanismus und ein optionaler Inkubator sorgen für Stabilität bei der Bildaufnahme.
- In Kombination mit der optionalen Vorrichtung zur Wirkstoffabgabe lässt sich die Reaktion der Zellen unmittelbar nach der Wirkstoffabgabe in Echtzeit beobachten.
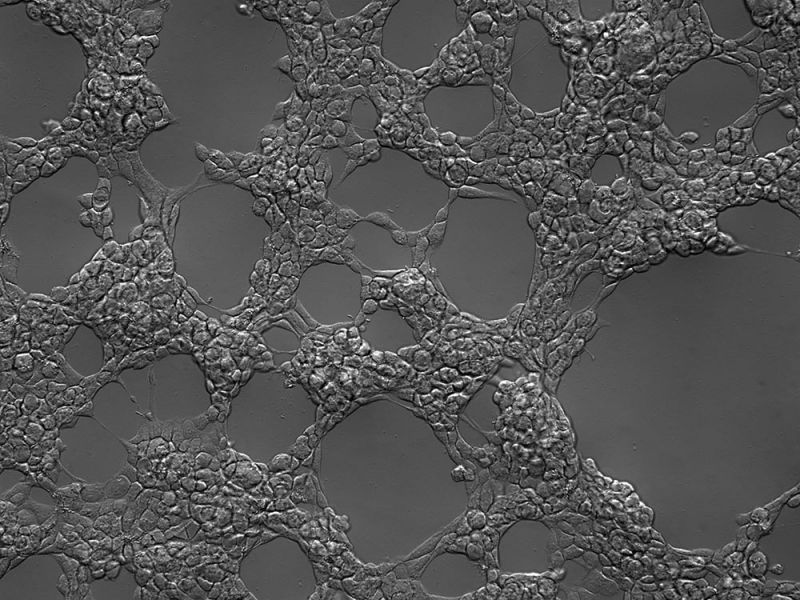
Scratch-Test
Zeitraffer-Bildgebung von Endothelzellen der menschlichen Aorta (HAEC) (2 Tage) eines Scratch-Tests.
| Befruchtete Eizelle einer Maus4-Stunden-Zeitraffer-Untersuchung der befruchteten Eizelle einer Maus. |
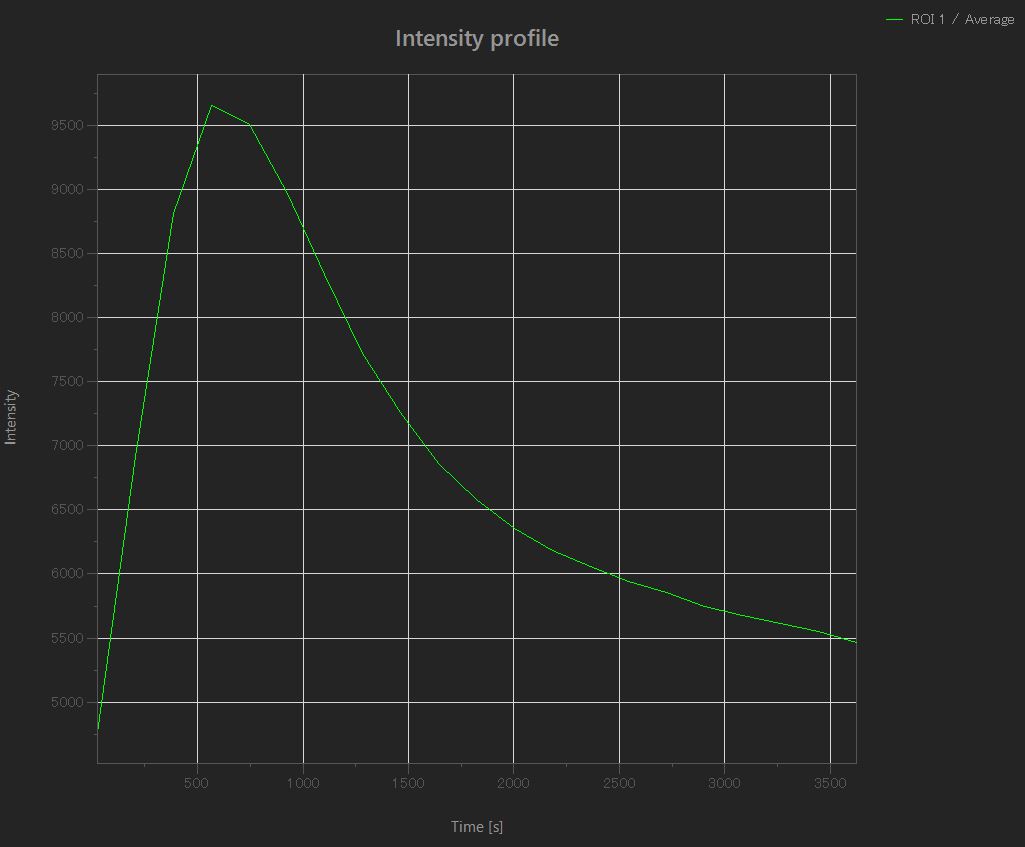
Antioxidative Wirkung in Mitochondrien
Mitochondrien, die durch Zugabe von H2O2 oxidiert wurden (erhöhte Intensität), wurden danach durch die antioxidative Wirkung reduziert (geringere Intensität).
|
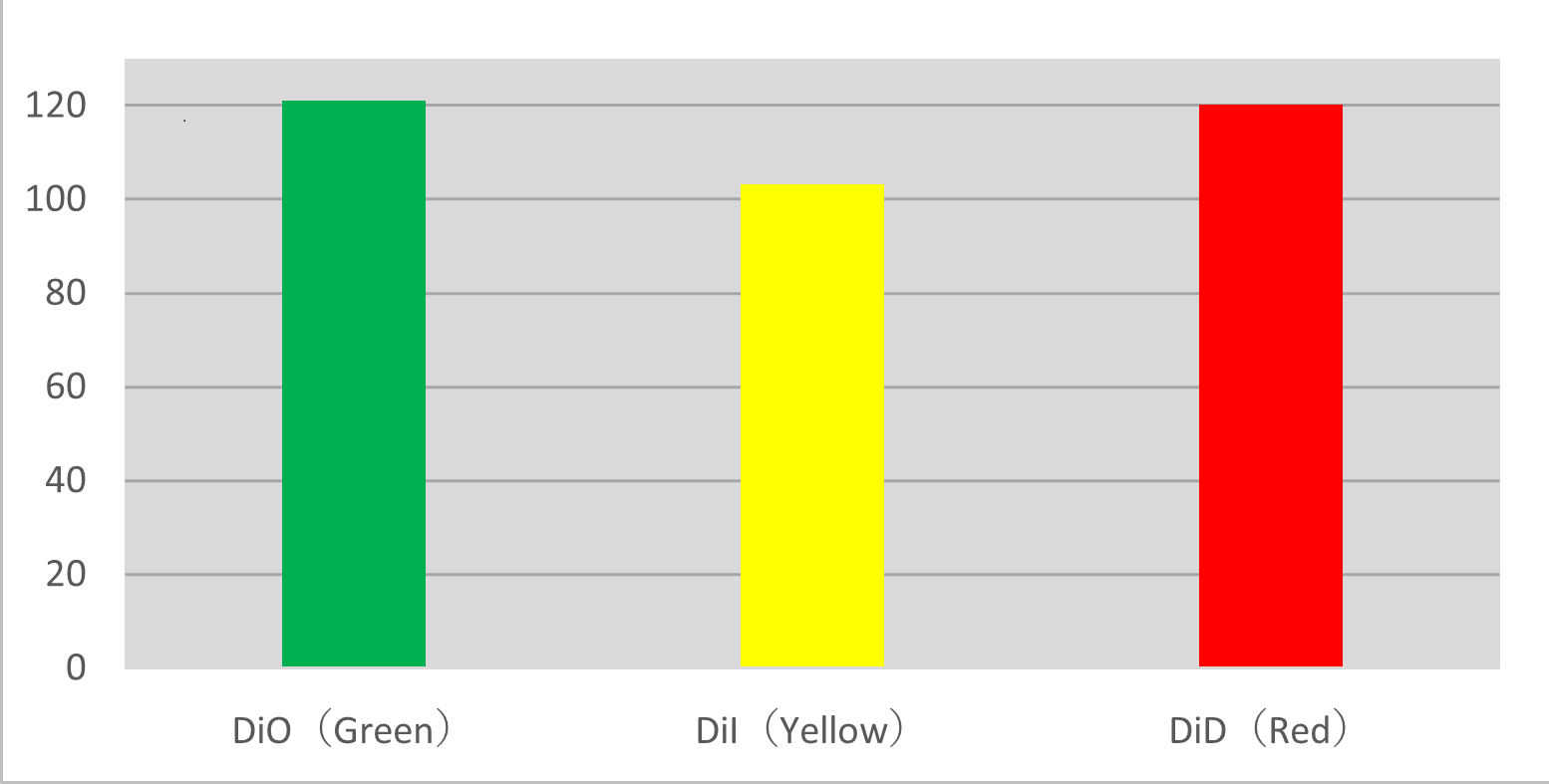
Mehrfarben-Bildgebung der RBL-2H3-Zellmigration
Drei behandelte RBL-2H3-Zellarten wurden gemischt, und ihr Migrationszustand wurde mittels mehrfarbiger Zeitrafferaufnahmen beobachtet. Bei jeder Behandlung wiesen die Zellen laut Tracking-Analyse eine ähnliche Migration auf.
|
Fluoreszenz-Bildgebung
Tubulin und Zellkern von BSC-1-ZellenFärbung: Immunzytochemie, blau: Zellkern, rot: Tubulin. | Kolokalisierung von NeuN und γ-H2AX im AffenhirnFärbung: Immunzytochemie. Bildquelle: Rui Han, Labor von Prof. Xiaojiang-Li, Guangdong-HongKong-Macau Institute of CNS Regeneration, JINAN University. | HaselpollenEigenfluoreszenz, aufgenommen mit einem UPLXAPO60X Öl-Objektiv. Verarbeitet mit TruSight Dekonvolution. |
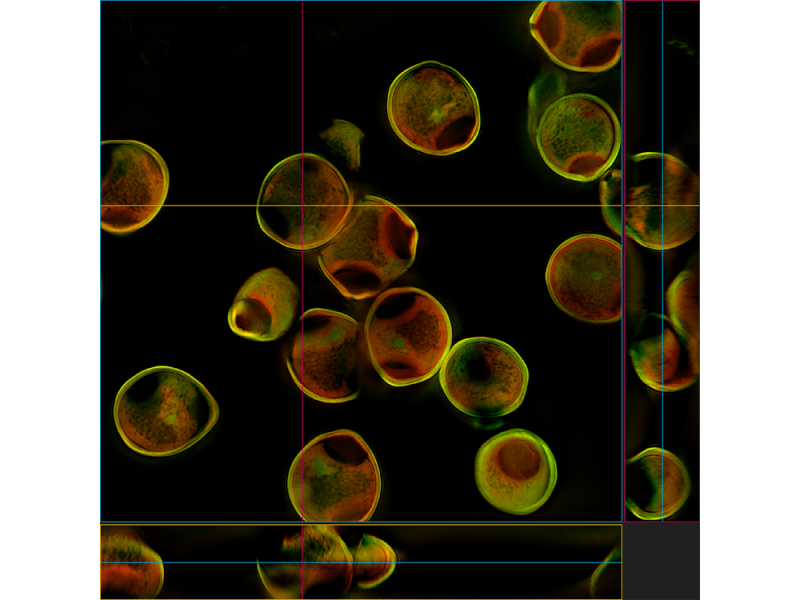
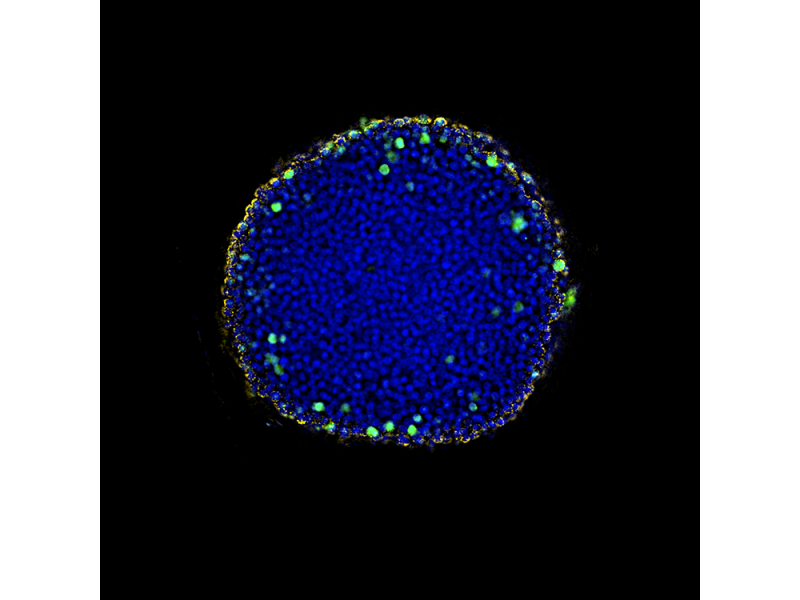
Brustdrüse einer ausgewachsenen Maus (Krt14/Krt8)Färbung: Immunzytochemie. Bildquelle: Chunye Liu, Labor von Prof. Yi Zeng, Center of Excellence in Molecular Cell Science, CAS. | Tubulin und Zellkern von BSC-1-ZellenFärbung: Immunzytochemie, weiß: Zellkern, cyan: Tubulin. | Gereinigtes HeLa-ZellsphäroidFärbung: Immunzytochemie, blau: DAPI-Zellkern, grün: AF488 Ki67, rot: AF555 Aktin. |
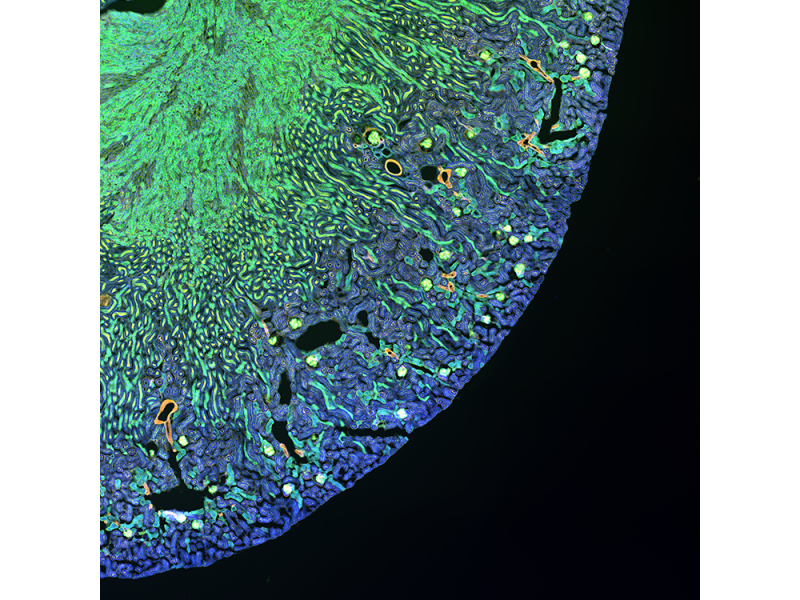
Ptk2-ZellenFärbung: DAPI, Mitotracker Red, Acti-Stain 488. | Rattenhirn im QuerschnittFärbung: Hoechst, RPCA-NF-L-ct und MCA-7D5. | MausniereAlexa Fluor 488 WGA, Alexa Fluor 568 Phalloidin, DAPI. |
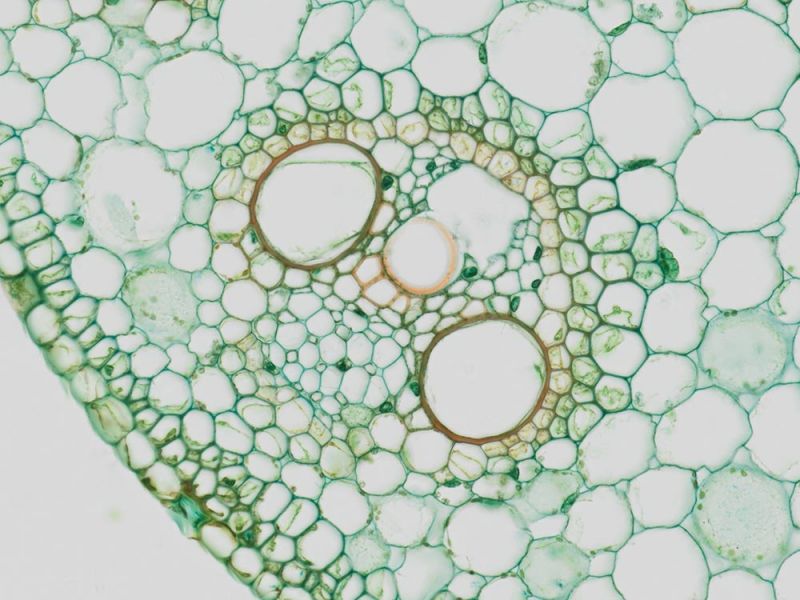
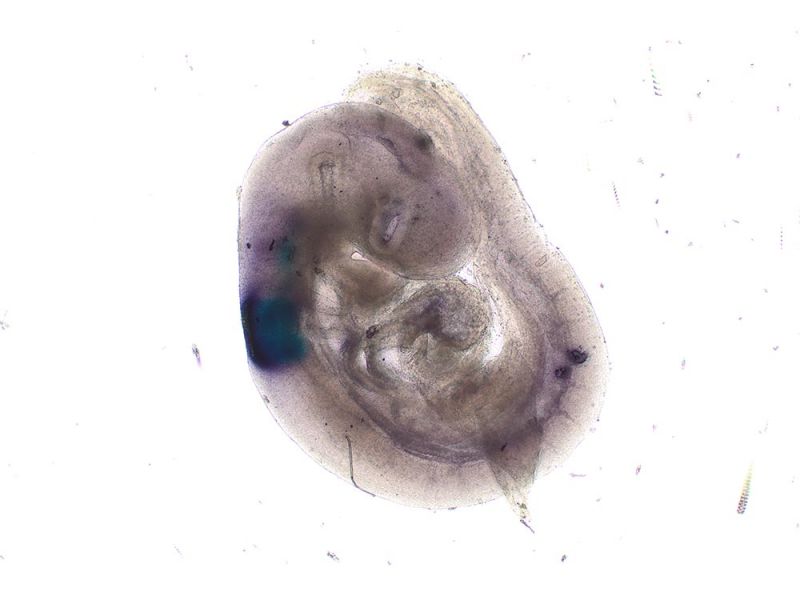
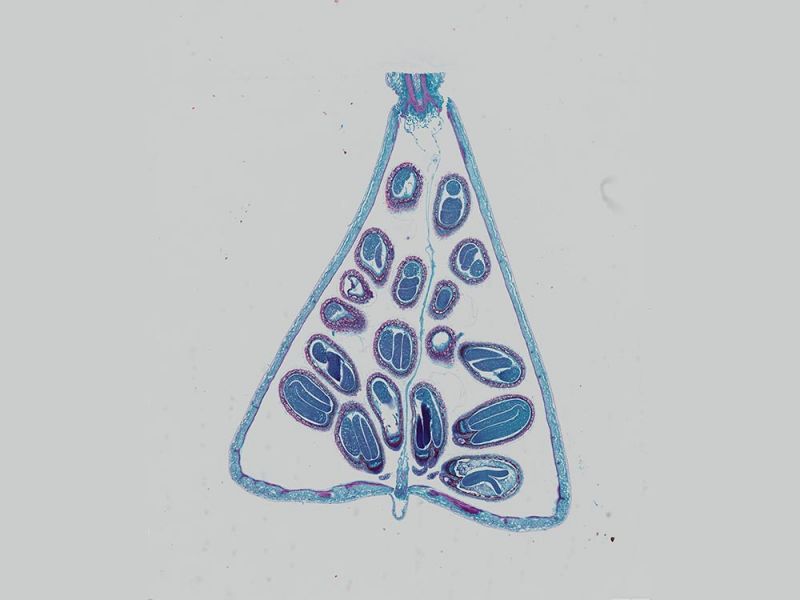
Hellfeld-Bildgebung
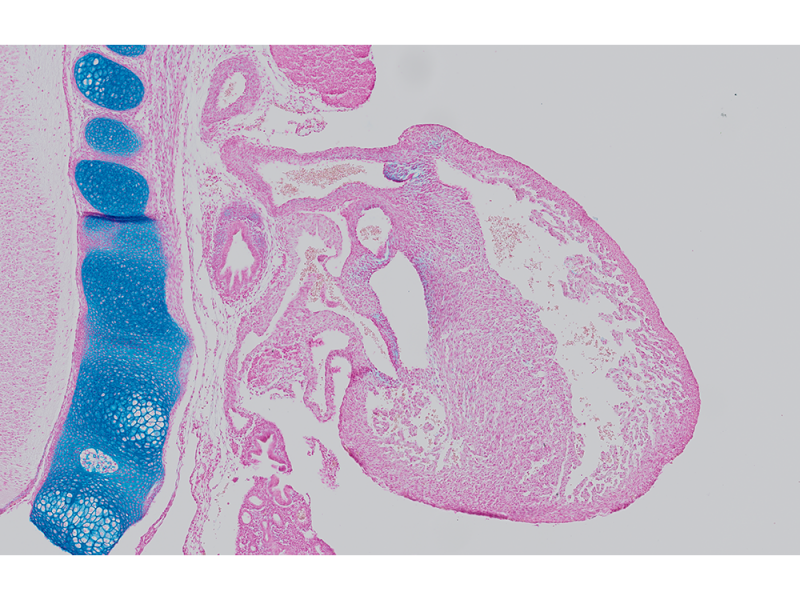
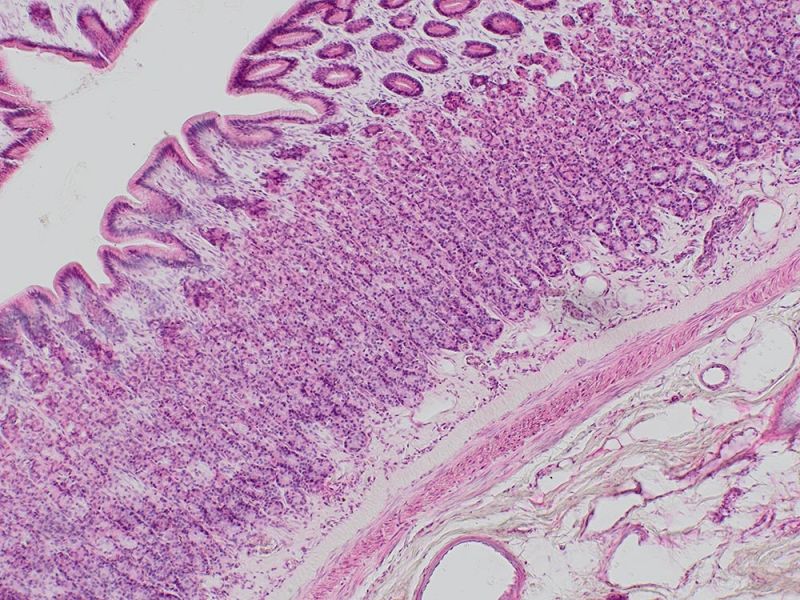
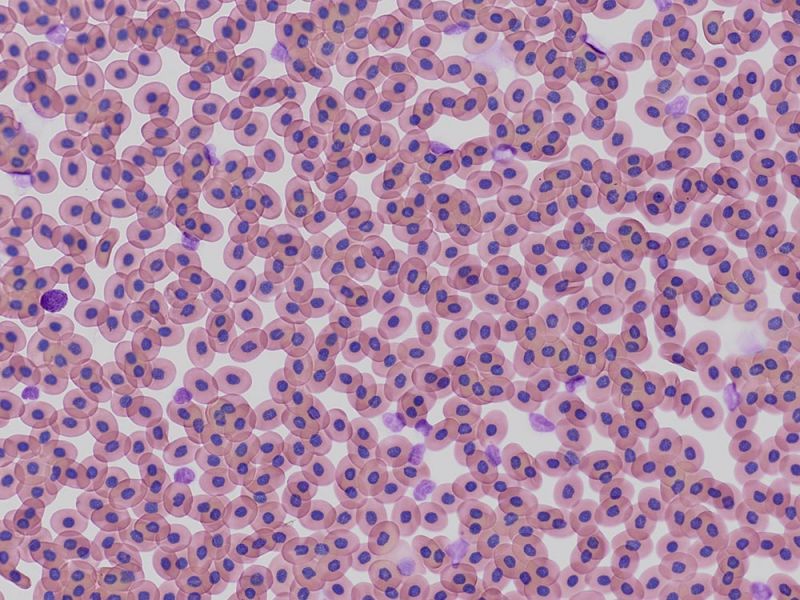
Mit Alcianblau und Nuclear Fast Red gefärbter E15.5-MausembryoBildquelle: 1.2.Naoki Takeshita, MD, 1.Kenta Yashiro Professor, MD, Ph.D., 1.Division of Developmental Biology and Anatomy, Department of Anatomy und 2.Department of Pediatrics, Graduate School of Medical Science, Kyoto Prefectural University of Medicine. | DickdarmschnittFärbung: HE. Bildquelle: Kazuhiko Matsuo, Ph.D., Kenta Yashiro Professor, MD, Ph.D., Division of Developmental Biology and Anatomy, Department of Anatomy, Kyoto Prefectural University of Medicine. | Xenopus-BlutzellenFärbung: HE. |
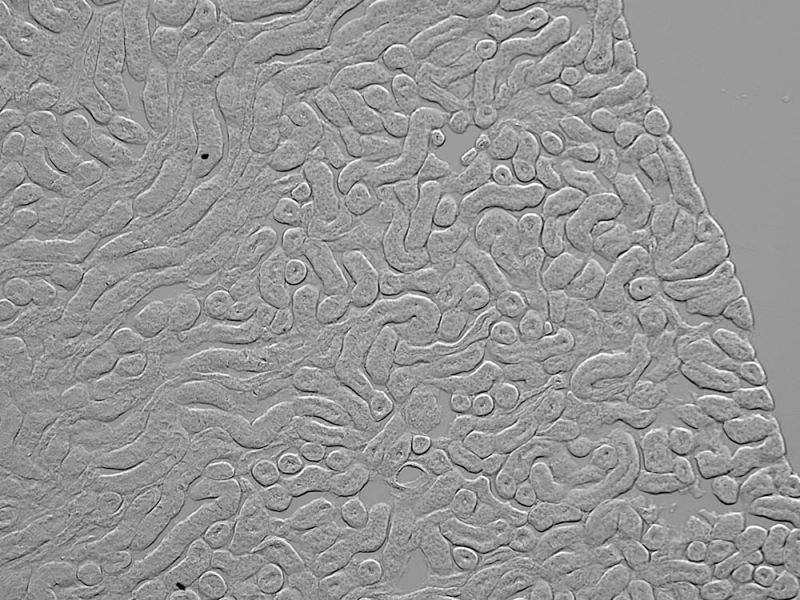
 | Gradientenkontrast: Sehen Sie Ihre Probe in neuem Licht
Expression von membrantransloziertem mCherry in HEK293T-Zellen. Bildquelle: Rie Saba, Ph.D., Division of Developmental Biology and Anatomy, Department of Anatomy, Kyoto Prefectural University of Medicine. |
|---|
Benötigen Sie weitere Informationen?
Sorry, this page is not
available in your country.
Sorry, this page is not
available in your country.