Uso de la microscopía multifotónica intravital para visualizar interacciones dinámicas entre neutrófilos y monocitos/macrófagos en las vías respiratorias de un ratón infectado con influenza
El sistema inmunológico innato del cuerpo es la primera línea de defensa contra la infección viral. Una de sus principales funciones es el reclutamiento de varios tipos de glóbulos blancos, o leucocitos, a los sitios de infección (p. ej., las vías respiratorias). Todos estos leucocitos, incluidos los neutrófilos y los monocitos/macrófagos, actúan en coordinación para fortalecer las defensas del cuerpo contra el virus. Fomentar una comprensión más profunda de los mecanismos de este proceso inmunológico innato ayudará a los investigadores a desarrollar y mejorar la eficacia de las vacunas y las terapias.
En esta nota de aplicación, el Dr. Minsoo Kim y sus colegas examinaron la dinámica de los neutrófilos y monocitos/macrófagos in vivo en la tráquea de un ratón infectado con influenza usando la microscopía multifotónica intravital. La observación 3D y el análisis de las imágenes revelaron patrones de motilidad que no habían sido reconocidos antes en las interacciones entre neutrófilos y monocitos/macrófagos.
La reconstrucción 3D de imágenes muestra la migración de neutrófilos en la tráquea del ratón infectado por la influenza. Rojo: neutrófilo. Blanco: vaso sanguíneo. Barra de escala: 50 μm. La fluorescencia de la proteína tdTomato se excitó a 975 nm y se detectó en el canal rojo (de 575 a 630 nm). La fluorescencia de Alexa Fluor 647 se excitó a 1200 nm y se detectó en el canal rojo lejano (de 645 a 685 nm). Datos adaptados de la Referencia bibliográfica [1].
Migración de neutrófilos en la tráquea del ratón infectado por influenza
Para observar los neutrófilos en la tráquea del ratón infectado con influenza, se infectaron ratones Ly6GCre/ROSAtdTomato con el virus de la influenza. Entre los tres y seis días posteriores a la infección, hubo una infiltración transitoria masiva de neutrófilos y monocitos en la tráquea. Para marcar los vasos sanguíneos, se inyectó por vía intravenosa el anticuerpo CD31 conjugado con la proteína Alexa Fluor 647 a los ratones antes del procesamiento de las imágenes. La microscopía multifotónica intravital se produjo en la tráquea canulada quirúrgicamente de los ratones anestesiados. Tal y como se muestra en el primer video (Video 1), se observó tanto los neutrófilos de tdTomato (rojo) como los vasos sanguíneos (blanco) y la migración de neutrófilos alrededor de los vasos sanguíneos vecinos en la tráquea del ratón infectado con influenza.
Patrones de motilidad entre las interacciones de neutrófilos y monocitos/macrófagos
Para observar tanto los neutrófilos como los monocitos/macrófagos en la tráquea del ratón infectado con influenza, se infectaron ratones de Ly6G-Cre, ROSA-tdTomato y Csf1r-EGFP con el virus de la influenza. Los neutrófilos expresaron tanto la proteína GFP como la tdTomato (observación de fluorescencia roja/naranja) mientras que los monocitos/macrófagos expresaron solo la proteína GFP (observación de fluorescencia verde). Como se muestra en el segundo video (Video 2), los neutrófilos de GFP/tdTomato (rojo/naranja), los monocitos/macrófagos de GFP (verde) y los vasos sanguíneos (blanco) fueron observados en la tráquea del ratón infectado con influenza. En el quinto día después de la infección, la mayoría de los monocitos/macrófagos se inmovilizaron, mientras que la mayoría de los neutrófilos permanecieron altamente activos y se movieron constantemente muy cerca de los monocitos/macrófagos circundantes.
Migración e interacciones de neutrófilos y monocitos/macrófagos en la tráquea del ratón infectado por influenza. Rojo/naranja: neutrófilos. Verde: monocitos/macrófagos. Blanco: vaso sanguíneo. Barra de escala: 50 μm. Tanto la fluorescencia de la proteína GFP como la de tdTomato se excitaron a 975 nm y fueron detectadas posteriormente en el canal verde (495–540 nm) y el canal rojo (575–630 nm), respectivamente. La fluorescencia de Alexa Fluor 647 se excitó a 1200 nm y se detectó en el canal rojo lejano (de 645 a 685 nm). Datos adaptados de la Referencia bibliográfica [1].
Al observar con más detalle,usando una magnificación superior, se revelaron más datos en el patrón de interacción entre neutrófilos y monocitos/macrófagos. El tercer video (Video 3) muestra la reconstrucción 3D de la migración de neutrófilos entre los monocitos/macrófagos en la tráquea del ratón durante el sexto día después de la infección. Este video muestra que los neutrófilos en amplio movimiento (rojo) se encontraron activos y fueron hacia los monocitos/macrófagos circundantes no migratorios (verde). Los encuentros frecuentes llevaron a la absorción de los neutrófilos por los monocitos/macrófagos, lo que indica el mecanismo de eliminación de los neutrófilos moribundos de la tráquea infectada.
La reconstrucción 3D de las imágenes muestra interacciones detalladas entre neutrófilos y monocitos/macrófagos en la tráquea del ratón infectado por influenza (sexto día después de la infección). Rojo: neutrófilo. Verde: monocitos/macrófagos. Tanto la fluorescencia de la proteína GFP como la de tdTomato se excitaron a 975 nm y fueron detectadas posteriormente en el canal verde (495–540 nm) y el canal rojo (575–630 nm), respectivamente. Datos adaptados de la Referencia bibliográfica [1].
¿Cómo el microscopio multifotón FVMPE-RS facilitó este experimento?
Sistema de láser doble FVMPE-RS para el procesamiento multifotónico de imágenes con múltiples longitudes de ondas simultáneas
Sistema de microscopio con estativo puente para el procesamiento de imágenes de ratones in vivo
Objetivo dedicado de excitación multifotónica XLPLN25XWMP2
| Los objetivos dedicados a la excitación multifotónica están optimizados para la obtención de imágenes multifotónicas en la profundidad del tejido. El revestimiento óptico ofrece una buena transmisión de 400 nm a 1600 nm para garantizar una excitación eficiente del infrarrojo cercano y una recogida visible de la fluorescencia. El objetivo de inmersión en agua XLPLN25XWMP2 de Olympus tiene una alta apertura numérica (A. N.: 1,05), una larga distancia de trabajo (2,0 mm) y un amplio campo de visión (A. N.: 18 mm); todos en conjunto brindan un excelente rendimiento en el procesamiento multifotónico de imágenes in vivo/intravitales. | 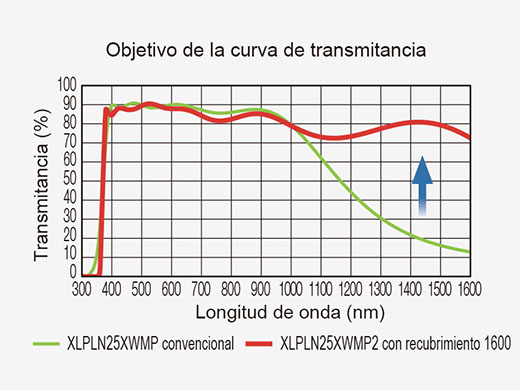 |
|---|
Biografía del Dr. Minsoo Kim
Agradecimientos
Esta nota de aplicación fue preparada con la colaboración de los Dres. Minsoo Kim y Kihong Lim del Departamento de Microbiología e Inmunología, Centro David H. Smith dedicado a la Biología e Inmunología de las Vacunas, Universidad de Rochester, NY, EE. UU.
Referencia
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.


