3.ra parte — Comparación de líneas celulares iPS humanas con el sistema de monitorización de incubación CM20: Reducir las variaciones de eficiencia en la diferenciación de orgánulos hepáticos entre la líneas celulares iPS
Introducción
Los orgánulos son tejidos tridimensionales que pueden formarse a partir de células madre pluripotentes inducidas (iPS) humanas in vitro. Si bien se prevé estudiar las diferencias funcionales e individuales de los orgánulos provenientes de diferentes pacientes, la variabilidad dependiente de la línea iPS limita sus aplicaciones. El objetivo de esta investigación es emplear el sistema de monitorización de incubación CM20 para descubrir las señales morfométricas a fin de definir la dependencia a donantes y clones para la formación eficiente de orgánulos.
Analizar los datos de proliferación de cada línea de células iPS humanas adquiridos por el sistema CM20
La investigación inicial se concentró en 12 líneas celulares iPS humanas provenientes de diferentes donantes que se mantuvieron en un estado indiferenciado y se monitorizaron por medio del sistema Olympus CM20. Gracias a la monitorización cuantitativa del estado celular a largo plazo, se halló que las líneas celulares iPS específicas muestran diferencias en el proceso de crecimiento e inestabilidad en la velocidad de crecimiento entre cada pase.
En la siguiente fase de la investigación, se diferenciaron las 12 líneas celulares iPS humanas en orgánulos hepáticos y se formuló la interrogante sobre si existía variabilidad en la formación de los orgánulos y eficiencia de diferenciación entre estas líneas celulares iPS. Se descubrió que la eficiencia de la diferenciación posterior en los orgánulos se ve muy afectada por las diferencias en la etapa temprana de la proliferación durante el cultivo de mantenimiento; a su vez, las diferencias en el tiempo de duplicación entre las líneas celulares iPS no permitieron concluir si la calidad de los orgánulos hepáticos formados era buena o mala.
Para potenciar este conocimiento y mejorar nuestros métodos de diferenciación de orgánulos hepáticos, se usaron datos de crecimiento celular durante los cultivos de mantenimiento cuya adquisición procedía del sistema CM20 en la primera fase de la investigación. El enfoque se dio en dos líneas celulares iPS específicas con baja eficiencia de diferenciación de orgánulos hepáticos a fin de analizar el comportamiento distinto frente a otras líneas celulares. La interrogante era si se podía mejorar la eficiencia de diferenciación de las células iPS, resistentes a la diferenciación, al modificar las condiciones de cultivo de mantenimiento.
Resultados
Entre las 12 líneas celulares iPS examinadas hasta el momento, se halló que las líneas celulares I y J son resistentes a la diferenciación en el linaje hepático. Para entender mejor las razones, se empleó una serie de imágenes adquiridas por el sistema CM20 durante la etapa inicial del cultivo de mantenimiento, y se intentó encontrar diferencias en el comportamiento de las líneas celulares I y J al compararlas con líneas celulares iPS que se diferenciaban de forma eficiente en el linaje de las células hepáticas.
Curiosamente, en las líneas celulares iPS capaces de diferenciarse (como la línea L), se formaron colonias a partir de la mayoría de las células individuales adheridas tras el pase en la etapa inicial de proliferación. Por otro lado, se observó una tasa superior de muerte celular después de la adhesión en las líneas celulares I y J, lo que resultó en una disminución significativa de eficiencia en la formación de colonias (Figura 1). Esta tendencia se observó de forma reproducible en múltiples pases. A partir de estas observaciones, se planteó la hipótesis de que la frecuencia superior de muerte celular, que se da en las primeras etapas del cultivo de mantenimiento, en líneas celulares iPS resistentes a la diferenciación, provoca un número menor de colonias de células iPS, lo que en última instancia disminuye la eficiencia de diferenciación en los orgánulos hepáticos.
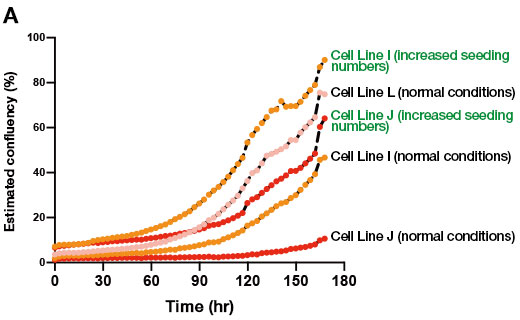
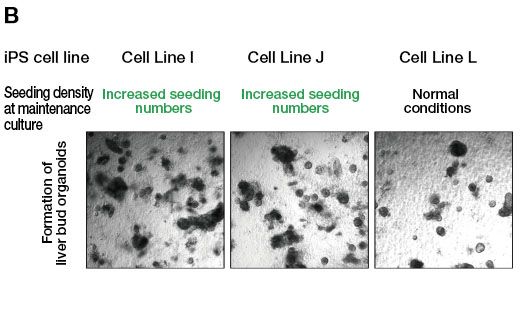
Para probar esto, se aumentó el número de células sembradas en el pase con la intención de que la cantidad final de colonias sea equivalente al de las líneas celulares iPS competentes en diferenciación. Después, se buscó inducir la diferenciación de orgánulos hepáticos a partir de este cultivo. Se confirmó que al aumentar la cantidad de células sembradas en cada pase, de aproximadamente 5 a 10 veces, hubo un aumento en el número de colonias formadas en el cultivo de mantenimiento de células iPS resistentes a la diferenciación en comparación con el protocolo estándar (Figura 2A). Además, al generarse orgánulos hepáticos a partir de las líneas celulares I y J bajo estas condiciones, se obtuvo una cantidad suficiente de orgánulos a diferencia de las condiciones anteriores en las que la formación de orgánulos no fue muy productiva (Figura 2B). Asimismo, se encontró que estos orgánulos hepáticos se expresaban en múltiples marcadores hepáticos. Ante estos resultados, destaca la utilidad de los datos provenientes del sistema de monitorización CM20 para cultivos celulares, el cual permite mejorar la etapa inicial del cultivo celular de mantenimiento, con las células iPS, resistente a la diferenciación y la posterior diferenciación en orgánulos hepáticos.
Línea celular I | Línea celular J | Línea celular L |
Figura 1. Comportamiento de líneas celulares iPS humanas en las primeras etapas del cultivo de mantenimiento.
|
Figura 2. Efecto de la densidad de sembrado sobre la formación de orgánulos durante el cultivo de mantenimiento de células iPS.
(A) Resultados de la monitorización con el sistema CM20 a partir del proceso de crecimiento de tres líneas celulares iPS humanas, bajo condiciones normales, y el cultivo de mantenimiento, bajo condiciones que llevan una cantidad superior de sembrado.
(B) Inducción de la diferenciación en la formación de orgánulos tras el cultivo de mantenimiento de las líneas celulares I y J con resistencia a la diferenciación bajo la condición de aumento en la cantidad de células sembradas. A modo de comparación, los orgánulos derivados de la línea L —línea celular iPS competente en la diferenciación— aparecen cuando la línea L es mantenida bajo condiciones estándar y, posteriormente, es inducida a la diferenciación.
Conclusión
Los investigadores que trabajan con orgánulos, a menudo, concentran la mayor parte de sus esfuerzos en optimizar los protocolos de diferenciación de orgánulos derivados de células iPS. Y, rara vez, prestan atención a sus cultivos de mantenimiento, cuando es el momento de comparar orgánulos derivados de múltiples líneas celulares iPS. A través de esta investigación se descubrió que el estado inicial de proliferación durante el cultivo de mantenimiento de las células iPS influye considerablemente en la eficiencia de la inducción de diferenciación posterior. Esto apunta a que, adicionalmente al desarrollo de un protocolo para la diferenciación de orgánulos, la optimización de los protocolos, dedicados al cultivo de mantenimiento de células iPS individuales, es fundamental para generar de manera reproducible múltiples muestras de orgánulos. Al utilizar el sistema de monitorización CM20, que es capaz de almacenar y procesar datos de cultivo de forma cuantitativa, recogidos en series de tiempo longitudinales, es posible obtener nuevos conocimientos y mejorar los protocolos experimentales.
Comentarios de los Dres. Takebe y Yoneyama
Dr. Takanori Takebe (izquierda). | Una de las funciones útiles del sistema de monitorización CM20 es que el resultado del orgánulo puede asociarse, de forma inmediata, a un apilamiento de imágenes anteriores para evaluar el estado de las células iPS. Ha sido una gran ventaja para nuestro laboratorio poder dar forma a las condiciones durante el mantenimiento de las células iPS e identificar la característica crucial que mejora la eficiencia de la diferenciación. |
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.