La importancia del lavado de tejido y la selección de objetivos en el análisis de esferoides 3D
Resumen
Los modelos tridimensionales (3D) como los esferoides o los orgánulos son gruesos y opacos debido a la dispersión lumínica, por lo que resulta complicado visualizar la imagen con gran profundidad manteniendo la morfología completa. Sin embargo, las técnicas de lavado de tejido permiten visualizar las muestras a gran profundidad mediante el control de los diversos índices de refracción (IR) entre los compartimentos celulares.
A través de esta nota de aplicación, se explicará un protocolo de aclarado de esferoides de un paso, en el que se aplica un reactivo de lavado de tejido SCALEVIEW-S4, y la importancia de la coincidencia del IR entre los esferoides aclarados y las lentes del objetivo.
Introducción
Los modelos 3D, como los esferoides y los orgánulos, son populares porque simulan el microentorno in vivo con mayor precisión que los modelos monocapa 2D clásicos. Sin embargo, resulta difícil visualizar las secciones profundas de los modelos en 3D gruesos por la dispersión de luz provocada por los compartimentos celulares, como los lípidos o las pigmentaciones.
Actualmente, muchas técnicas ópticas de lavado de tejido (1, 2) pueden hacer que los esferoides o los orgánulos sean transparentes. Estas técnicas de lavado suelen dividirse en tres tipos: técnicas a base de disolvente, base acuosa e incrustación de hidrogel. SCALEVIEW-S, que es un reactivo de aclaramiento acuoso, no suele provocar cambios morfológicos en las muestras aclaradas (3).
En esta nota de aplicación, seguimos el método de lavado de esferoides SCALEVIEW-S4. Dado que las muestras 3D transparentes suelen tener un índice de refracción alto, también describimos el efecto de la discrepancia de IR al comparar las imágenes adquiridas usando objetivos secos (RI: 1.0), acuosos (RI: 1.33) y de silicona (RI: 1.4).
Materiales y métodos
Preparación de la muestra
Se repartieron células de adenocarcinoma colorrectal (línea HT-29) en una microplaca de 384 pocillos con la base en U y se cultivaron hasta que el diámetro del esferoide fuera de unos 300 μm. Los esferoides se fijaron con una solución de paraformaldehído (PFA) al 4 % a 4 °C (39,2 °F) durante la noche y se tiñeron con solución DAPI en PBS(-).
Método de lavado
Se adquirieron o fabricaron SCALEVIEW-S0, S1, S2, S3, S4, y la solución desincrustante (FUJIFILM Wako Chemicals) (3). La Tabla 1 muestra el protocolo original usando estos reactivos.
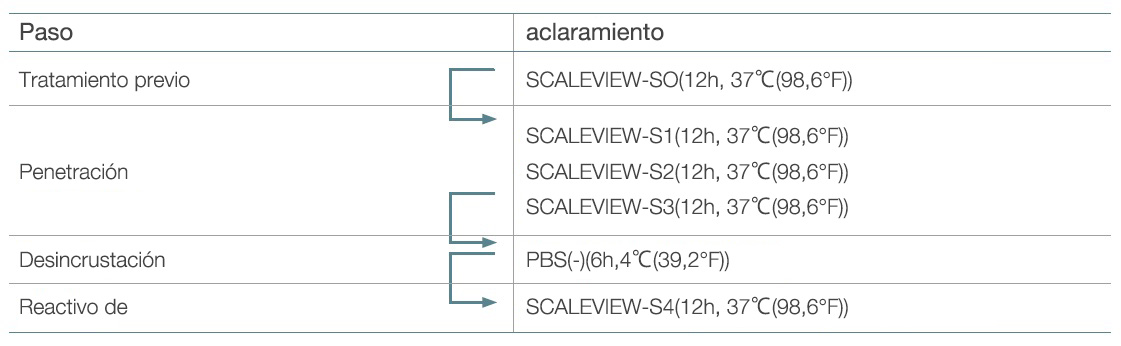
Tabla 1. Protocolo SCALEVIEW-S original
Método de procesamiento de imágenes
Visualizamos los esferoides HT-29 teñidos con DAPI con y sin lavado usando nuestro microscopio de barrido láser confocal FLUOVIEW FV3000 y los tres objetivos de inmersión diferentes descritos anteriormente.
Resultados y debate
Lavado de esferoides en un paso con SCALEVIEW-S4
El protocolo original SCALEVIEW-S implica el intercambio secuencial del líquido de seis reactivos diferentes (S0–S4, desincrustante). La muestra se expande y se contrae durante el tratamiento con reactivos S0-S3 y la solución desincrustante, lo que permite al S4 lavar el tejido y devolver el volumen a casi el 100% de su tamaño original.
El protocolo original se optimiza para lavar todo el cerebro del ratón, por lo que cada reactivo necesita 12 horas para lavar la muestra. Dado que los esferoides o los orgánulos de unos 200–300 μm de grosor son mucho más pequeños que un cerebro de ratón, pueden aclararse con incubación en reactivo S4 por una hora con una rotación delicada después de ser fijados y teñidos.
Tanto el esferoide aclarado con S4 como el esferoide aclarado con el protocolo original mantuvieron su morfología, como puede verse en la Fig. 1a a continuación. Es posible ver la intensidad fluorescente de cada esferoide aclarado por cada posición Z en la Fig. 1b. Los resultados muestran de forma cuantitativa que el esferoide puede aclararse usando el tratamiento del reactivo S4. Esto significa que los modelos en 3D pequeños como los esferoides o los orgánulos pueden ser aclarados fácilmente con un protocolo de un paso usando S4, después de ser fijados y teñidos, lo que ayuda a simplificar el procesamiento de imágenes de modelos en 3D.
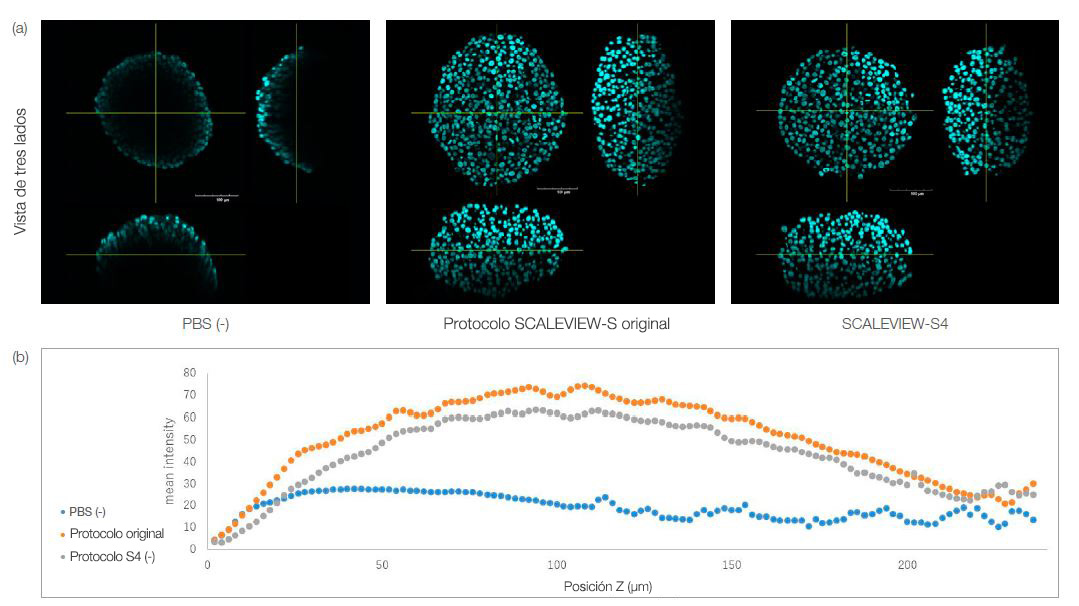
Fig. 1. Esferoides HT-29 aclarados con los protocolos SCALEVIEW-S y SCALEVIEW-S4. Los dos protocolos pueden usarse para aclarar el esferoide.
Importancia de la correspondencia IR entre objetivos y muestras 3D
Para obtener imágenes precisas de muestras 3D aclaradas usando la microscopía confocal o multifotón, se debe considerar la correspondencia del índice de refracción (IR) entre los objetivos y las muestras 3D. De lo contrario, la discrepancia del IR afecta la calidad de la imagen en la profundidad de la muestra 3D. En este caso, una gran diferencia en el IR entre los objetivos y las muestras 3D provocó una distorsión en el objeto, en la dirección Z, debido a la aberración.
La Figura 2 a continuación compara la resolución de imagen de los esferoides HT-29 aclarados con S4 (IR: 1.47), cuya captura se produjo con los tres objetivos: seco (RI: 1.00, UCPLFLN20X), acuoso (RI: 1.33, UAPON20XW340) e inmersión en silicona (RI:1.40, UPLSAPO30XSIR).
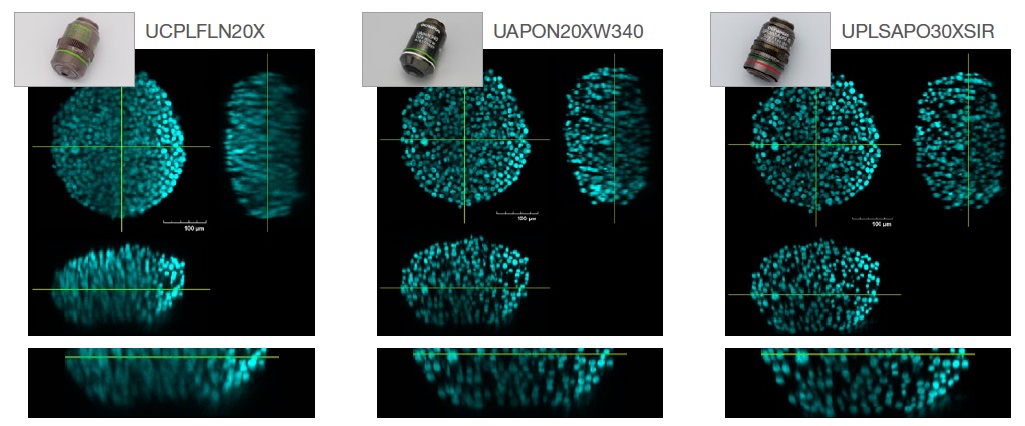
Fig. 2. Efecto de la selección del objetivo en la resolución de imagen. Izquierda: seco (RI: 1.00, UCPLFLN20X). Centro: agua (RI: 1.33, UAPON20XW340).
Derecha: inmersión en silicona (RI: 1.40, UPLSAPO30XSIR).
Como puede verse en la Fig. 2, la selección de una lente de objetivo óptima para la correspondencia del IR ayuda a adquirir imágenes más claras y a comprender con mayor precisión la morfología de las muestras 3D.
Efectos del aclaramiento de esferoides para el análisis cuantitativo 3D
Es posible analizar de forma cuantitativa las muestras 3D al aclararlas y adquirir varias imágenes de plano Z al usar un objetivo adecuado. Se usó el software de análisis celular 3D NoviSight™ para el recuento de células 3D en los esferoides de HT-29 teñidos con DAPI con y sin aclaramiento. También, se comparó la precisión del recuento de células entre las imágenes 3D adquiridas usando objetivos de inmersión diferentes (Fig. 2). Se comprobaron los números de célula de los esferoides mediante su tripnización y recuento manual del número de células.
El análisis por recuento celular del software NoviSight detectó menos del 20 % de células totales (vs. esferoides tripsinizados) en un esferoide no aclarado. Por el contrario, el software detectó más del 90 % del total de células en un esferoide aclarado (Fig. 3).
La imagen del objetivo seco tenía un número de células menor que los esferoides tripsinizados debido a la falta de reconocimiento de una relación insuficiente señal-ruido (ver el rectángulo rojo en la Fig. 3). Y aunque el software casi detectó completamente el núcleo en la imagen del objetivo de agua, perdió el núcleo dentro del esferoide (Fig. 3).
Sin embargo, el software reconoció completamente el núcleo en la imagen del objetivo de silicona (rectángulo verde en la Fig. 3).
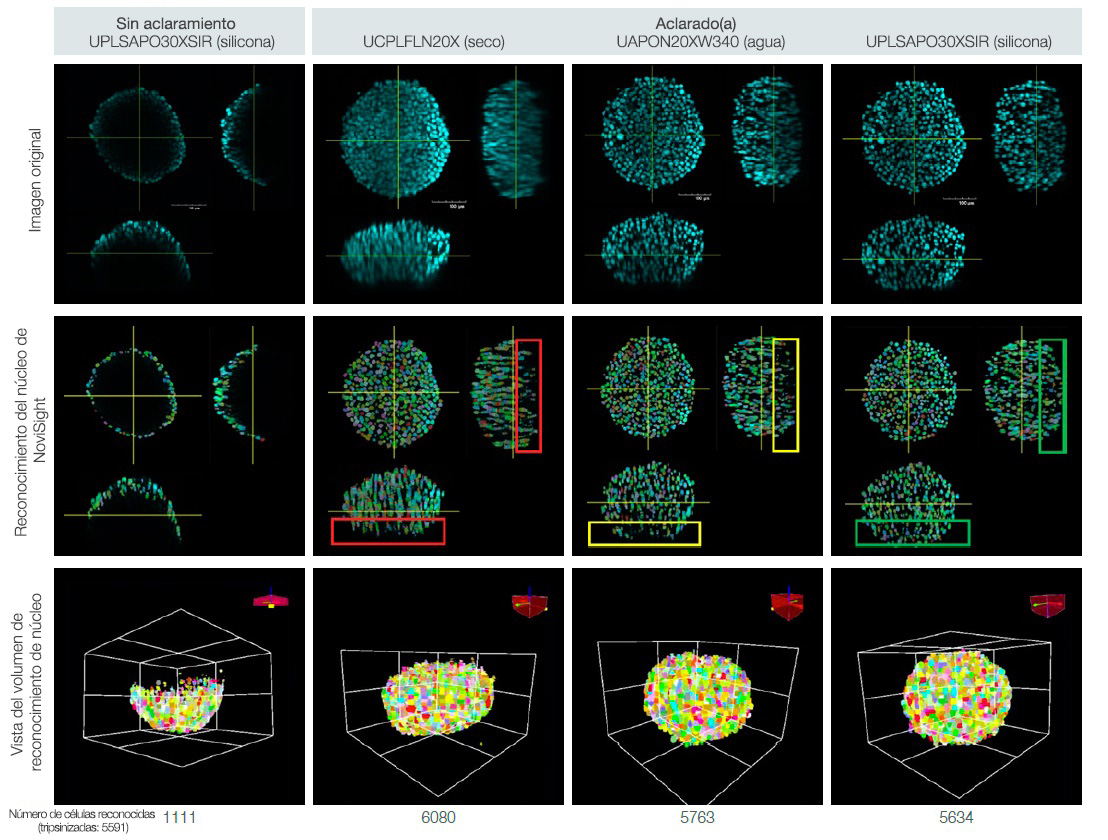
Fig. 3. Efectos del aclaramiento del esferoide y la selección del objetivo en el recuento celular 3D.
Conclusión
Las técnicas de aclaramiento permitieron contar las células dentro de la muestra para poder conseguir un análisis cuantitativo 3D.
Referencias
- Peng Wan et al., Evaluation of seven optical clearing methods in mouse brain, Neurophotonics (2018)
- Douglas S. Richardson et a., Clarifying Tissue Clearing, Cell (2015)
- Hama et al., ScaleS: an optical clearing palette for biological imaging, Nat Neurosci. (2015)
Author
Mayu Ogawa (Olympus)
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.