En el tiempo de llevo trabajando para Olympus, no ha dejado de sorprenderme la creatividad de nuestros clientes con respecto a sus configuraciones de microscopios confocales, ya sea mediante aparatos experimentales o portamuestras hechos por ellos mismos. Nuestro microscopio confocal FV3000 incluye configuraciones verticales e invertidas para poder adaptarse a cada experimento y poder orientar las muestras de muchas formas.
El microscopio FV3000 ha sido desarrollado para observaciones por fluorescencia.No obstante, con un poco de ingenio, también a veces puede ser usado para procesar imágenes confocales de reflectancia. La técnica de procesamiento de imágenes confocales de reflectancia suele ser omitida con frecuencia a pesar de su versatilidad y factibilidad. A continuación, se explicará una forma inteligente de usarla para sacar el máximo provecho de su sistema.
Se explicará cómo aplicar el procesamiento de imágenes confocales de reflectancia para extraer información endógena de los tejidos biológicos.
Procesamiento de imágenes confocales de reflectancia en complejos biomoleculares fibrilares
Uno de los usos para una trayectoria de luz de reflectancia es capturar señales endógenas con el fin de lograr un mayor contraste y percepción del entorno de la muestra.
¿Pero, cómo funciona? La interfaz entre las estructuras de proteínas fibrilares biológicas y el agua produce una fuerte señal de contraste reflectante. Si se extrajera del escaneo la luz de excitación de un detector TruSpectral, configurado con un ancho de banda superpuesto, es posible identificar las estructuras celulares específicas, el estado organizacional del entorno de la matriz extracelular y las características superficiales del material.
Convenientemente, el microscopio confocal FV3000 presenta una trayectoria de luz completamente espectral, para que todos los canales puedan usarse y detectar la reflectancia. Al combinarla con las observaciones de fluorescencia, esta función de reflectancia multiespectral añadida recoge la localización de las estructuras celulares sin marcado.
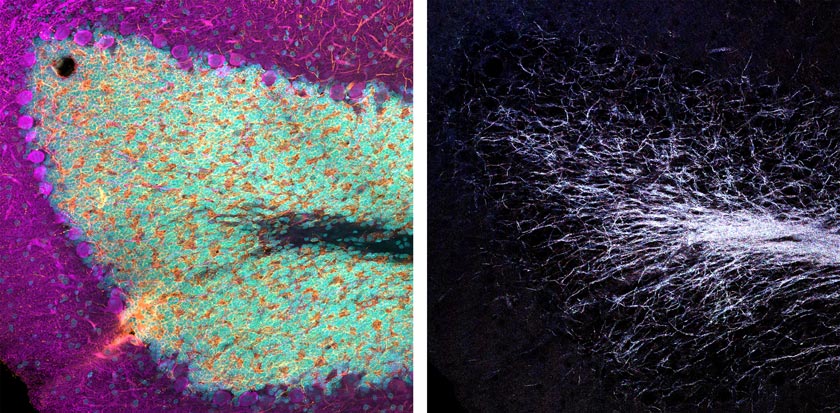
Por ejemplo, he usado el procesamiento de imagen en un portaobjetos que albergaba una sección de cerebro de rata fijada, marcada con inmunofluorescencia. La muestra proviene de la sociedad americana EnCor Biotechnology, Inc. Como puede observarse en las imágenes a continuación (Figura 1), una adquisición VBF estándar de tres canales revela un excelente marcado del determinante antigénico (epítopo) en dendritas neuronales (naranja), neuronas catecolaminérgicas (magenta) que contienen dopamina o noradrenalina, e intercalación de tinción que resulta en el colorante para núcleos (cián).
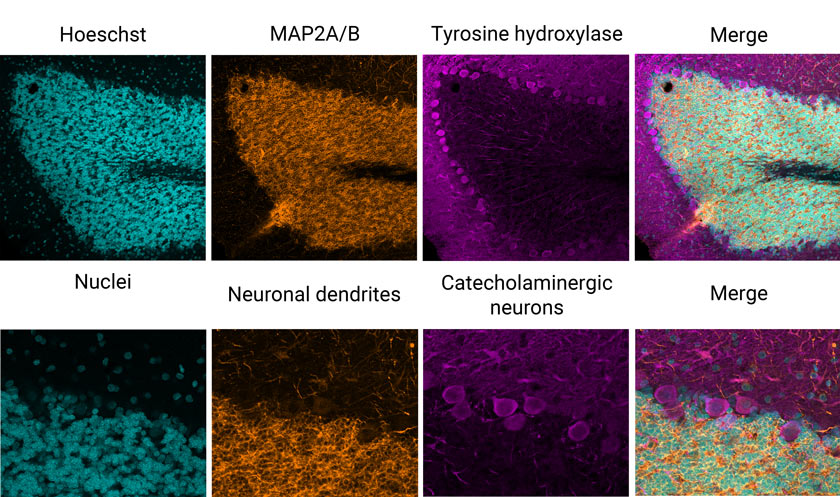
Figura 1: Sección de cerebro de rata marcada con inmunofluorescencia de tres colores teñida con anticuerpos de EnCor Biotechnology, Inc. Paneles superiores: Imagen de plano Z de campo completo adquirida con un objetivo X Line de 20x. Paneles inferiores: Resolución real de píxeles de un cuadrado de inserción resaltado.
A pesar del fondo de fluorescencia fuerte y de amplio espectro creado por la preparación de inmunofluorescencia, es posible usar nuestras habilidades de reflectancia para obtener más información endógena.
Al usar cuatro canales simultáneamente para visualizar la reflectancia de las líneas de láser de 405, 488, 561 y 640 nm, es posible crear un mapa multiespectral de las neuronas mielínicas dentro de este tejido. En las siguientes imágenes (Figura 2 y 3) podemos observar cómo sería el resultado.
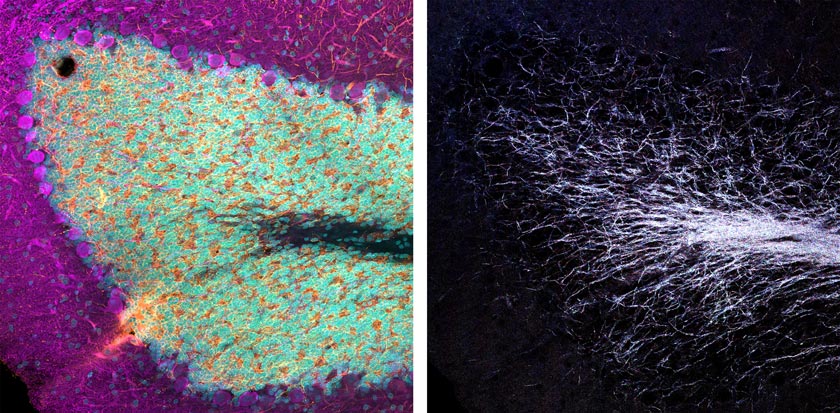 Figura 2 (izquierda): Combinación de tres canales de la señal derivada de inmunofluorescencia mostrada en la Figura 1. Derecha: Mismo campo de visión de imagen combinada en cuatro canales por imágenes confocales de reflectancia adquiridas simultáneamente usando las líneas láser de 405, 488, 561 y 640 nm. | 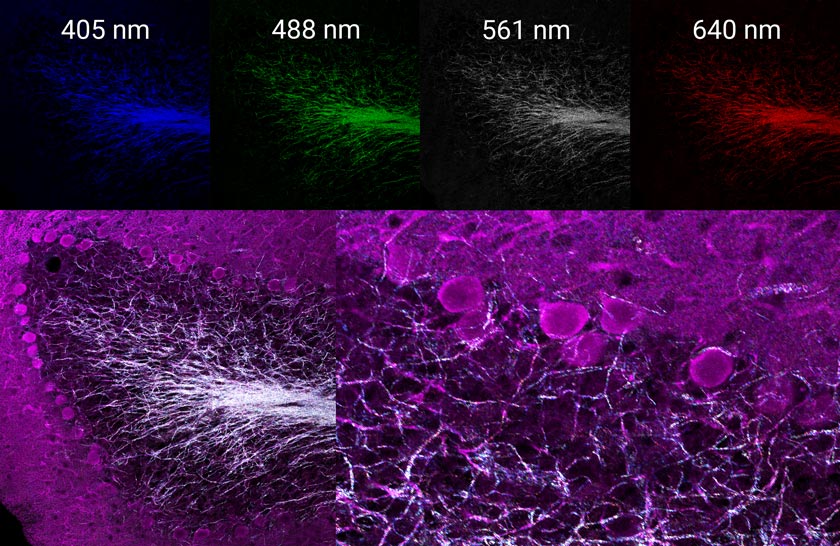 Figura 3 (arriba): Imágenes confocales de reflectancia individual que muestra cada línea adquirida simultáneamente. Abajo: Imágenes combinadas de neuronas que contienen dopamina con marcado de inmunofluorescencia, e imagen confocal de reflectancia multiespectral de mielinización endógena axonal. |
Esta información puede usarse sin marcado para valorar el grado de mielinización que se produce en las neuronas de interés con marcado selectivo de inmunofluorescencia o para facilitar aplicaciones que requieren trazado axonal.
El procesamiento de imágenes confocales de reflectancia también puede usarse para elucidar la matriz extracelular de modelos de tejido cultivado en 3D. Tal como se aprecia en las imágenes a continuación (Figura 4), los neovasos que han crecido durante la angiogénesis interactúan estrechamente con las fibrillas colágenas circundantes del entorno estromal.
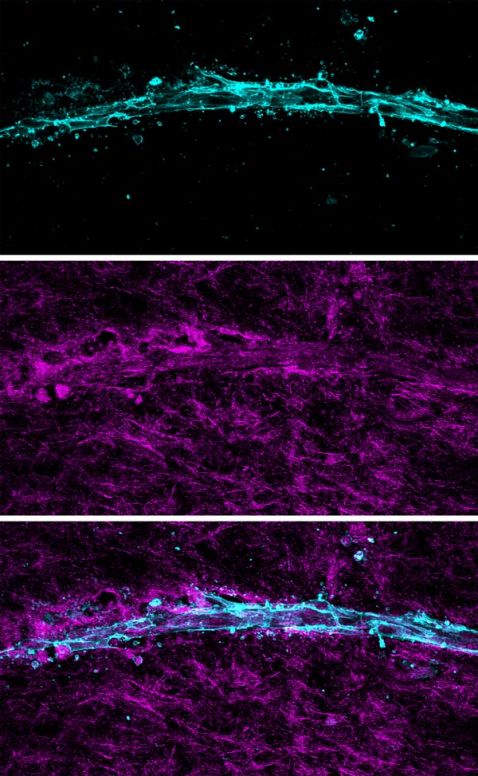
Figura 4: Proyección Z de un vaso sanguíneo en impresión 3D dentro de una matriz de colágeno. Arriba: Imagen confocal de fluorescencia de células endoteliales con marcado de rodamina. Centro: Imagen confocal de reflectancia de 405 nm que muestra la red de colágeno fibrilar y áreas del remodelado proximal al vaso. Abajo: Imagen combinada. La escala de medición equivale a µm.
Si se utilizan los microvasos aislados Angiomics™ de Advanced Solutions para recapitular la angiogénesis nativa in vitro con el microscopio confocal FV3000, queda claro que los neovasos agiogénicos (observados mediante fluorescencia confocal) reorganizan las fibrillas de colágeno inmediatamente adyacentes (visualizadas mediante procesamiento de imágenes de reflectancia) a medida que crecen en el entorno estromal 3D.