Imagerie de la localisation intracellulaire des interactions protéine-protéine à l’aide de la technologie NanoBiT®
Une interaction protéine-protéine (PPI) est un contact physique direct entre deux protéines. Étant donné que les protéines accomplissent la plupart des processus cellulaires et agissent rarement seules, l’étude des interactions entre protéines par paires ou par groupes plus importants est importante dans tous les domaines de recherche, notamment le développement de médicaments et la recherche sur les maladies. Il existe différentes méthodes pour suivre les interactions protéine-protéine sans utiliser des cellules, mais ces modèles ne reflètent pas précisément le milieu intracellulaire. En outre, certaines méthodes de suivi des PPI utilisant des cellules nécessitent la lyse des cellules et des appareils spéciaux pour la détection quantitative.
Pour surmonter ces difficultés, Promega a développé la technologie NanoBiT® (NanoLuc® Binary Technology). NanoBiT® est un système rapporteur de complémentation structurale qui peut être utilisé pour la détection intracellulaire des IPP. Il a été utilisé avec succès dans un éventail de domaines de recherche, comme la sélection de médicaments, l’analyse de la transduction des signaux et l’analyse des mécanismes d’infection virale.
Le système est composé d’une grande sous-unité Large BiT (LgBiT ; 17,6 kDa) et d’une petite sous-unité Small BiT (SmBiT ; 11 acides aminés), qui sont fusionnées aux protéines d’intérêt. Ces sous-unités fusionnées sont ensuite exprimées dans la cellule, de sorte que seules les PPI ciblées permettent aux sous-unités de former une enzyme fonctionnelle qui génère un signal de luminescence intense (figure 1).
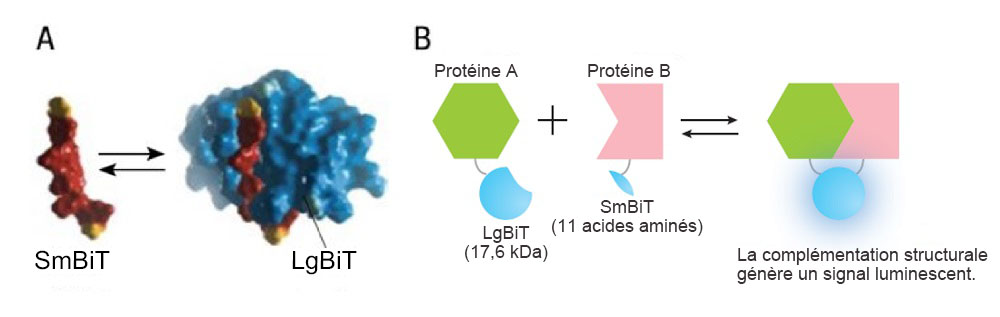
Figure 1. Vue d’ensemble du système d’interaction protéine-protéine NanoBiT®
Image reproduite avec l’aimable autorisation de Promega.
Imagerie de la localisation intracellulaire de NanoBiT
Pour effectuer l’expression cytosolique et nucléique, nous avons transfecté deux types de paires de vecteurs dans des cellules HeLa. La première paire était un vecteur de contrôle FKBP-SmBiT non ciblé et un vecteur de contrôle FRB-LgBiT. La deuxième paire était un vecteur de contrôle NLS1-FKBP-SmBiT ciblé vers le noyau et un vecteur de contrôle FRB-LgBiT (figure 2). Les protéines FKBP et FRB sont connues pour se lier lors d’un traitement à la rapamycine.
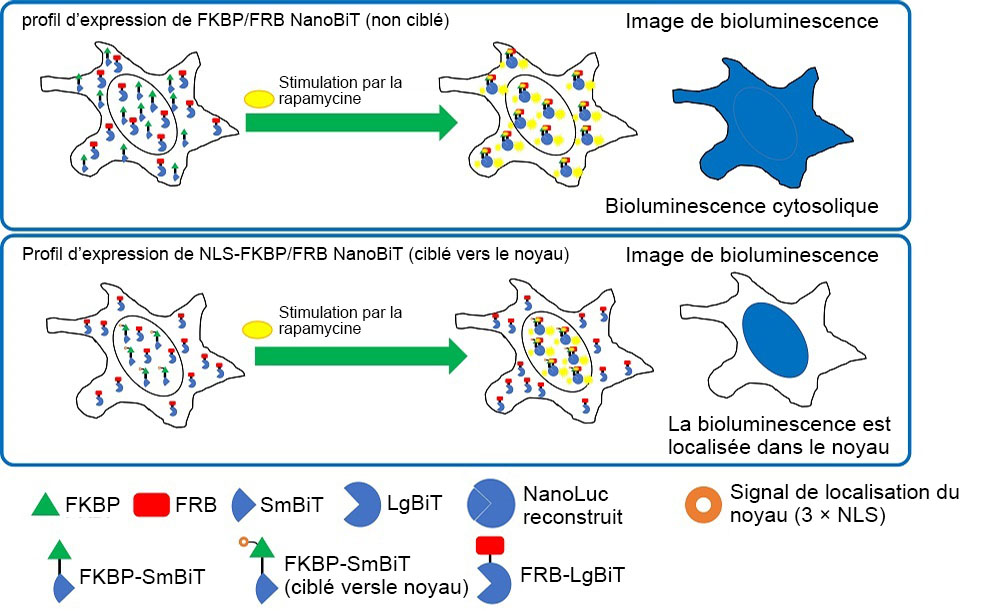
Figure 2. Localisation intracellulaire des paires FKBP/FRB NanoBiT et NLS-FKBP/FRB NanoBiT.
La bioluminescence des cellules HeLa exprimant le vecteur NanoBiT a ensuite été suivie par imagerie à l’aide du système de microscope IXplore™ Live for Luminescence2. Pour confirmer la localisation du noyau, les cellules HeLa ont été contre-colorées au Hoechst33342 et observées sur le même microscope en mode fluorescence (figure 3).
Nous avons observé que le signal de bioluminescence dans les cellules HeLa qui avaient reçu les vecteurs FKBP-SmBiT non ciblé et FRB NanoBiT était dispersé dans tout le cytosol. Avec les vecteurs NLS-FKBP/FRB NanoBiT en revanche, la superposition des signaux de bioluminescence et de la fluorescence de l’Hoechst33342 indiquait que les protéines étaient localisées dans le noyau.
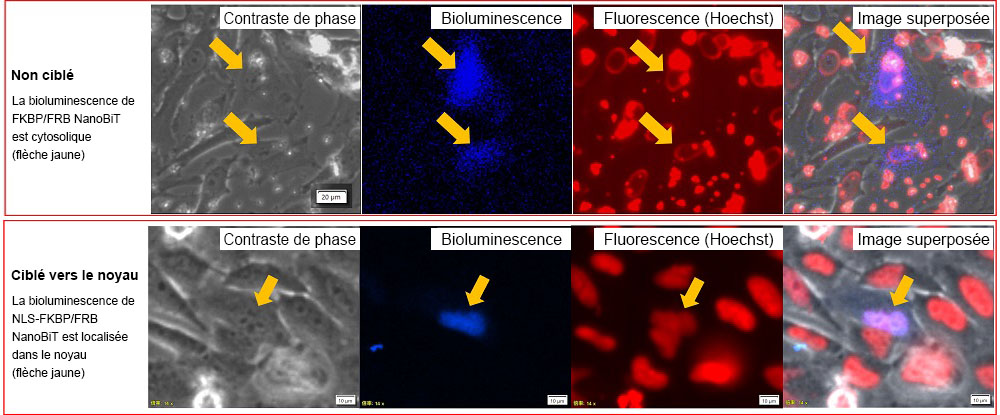
Figure 3. Localisation intracellulaire des paires FKBP/FRB NanoBiT et NLS-FKBP/FRB NanoBiT.
Conditions expérimentales :
- Microscope : système de microscope IXplore Live for Luminescence2
- Caméra : caméra imagEM EM-CCD (Hamamatsu Photonics)
- Objectif : LUCPFLN60XPH
- Objectif d’imagerie : 0,35X
- Gain EM : 1200
- Concentration de furimazine : dilution de 1/200
- Concentration finale de rapamycine : 30 nM
- Temps d’exposition : contraste de phase : 50 ms / bioluminescence : 3 min / fluorescence : 100 ms
La figure 4 montre l’évolution de la bioluminescence de la paire NLS-FKBP/FRB NanoBiT avant et après la stimulation de la rapamycine. L’intensité de la bioluminescence dans le noyau a augmenté après la stimulation par la rapamycine. Ces résultats montrent que les protéines FKBP et FRB se lient l’une à l’autre dans le noyau en présence de rapamycine et que leur interaction induit la bioluminescence de la NanoLuc. L’imagerie microscopique nous a permis d’observer l’interaction des protéines FKBP et FRB induite par une stimulation par la rapamycine sous la forme changements de l’intensité de la bioluminescence cytosolique et nucléique dans la cellule vivante.
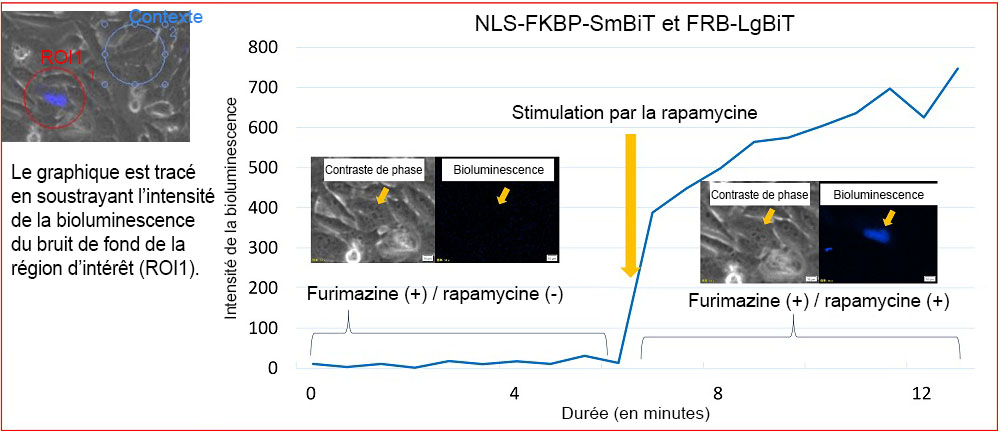
Figure 4. Changement de l’intensité de la bioluminescence de la paire NLS-FKBP/FRB après stimulation par la rapamycine
Conditions expérimentales :
- Vecteurs : vecteurs NLS-FKBP-SmBiT/FRB-LgBit (50 ng chacun)
- Microscope : système de microscope IXplore Live for Luminescence2
- Caméra : caméra imagEM EM-CCD (Hamamatsu Photonics)
- Gain EM : 1200
- Objectif : UPLFLN40XPH
- Objectif d’imagerie : 0,35X
- Temps d’exposition : contraste de phase : 50 ms / bioluminescence : 30 s / fluorescence : 100 ms
- Intervalle time-lapse : 40 secondes
Détection des PPI à l’aide d’un luminomètre et de la microscopie à luminescence
Les technologies NanoBiT et HiBiT3 nous permettent de détecter les PPI à haut débit à l’aide d’un luminomètre, tandis que l’imagerie microscopique de ces technologies nous permet de visualiser la localisation intracellulaire de ces PPI.
La combinaison d’un luminomètre et d’un microscope à luminescence dédié pour la détection des PPI offre plusieurs avantages. Lors de l’observation de PPI se produisant localement ou de changements dans leur localisation intracellulaire, nous pouvons confirmer l’exactitude de la localisation à l’aide de l’imagerie microscopique avant de prendre une mesure à haut débit à l’aide d’un luminomètre. Ce système élimine le besoin d’une imagerie de fluorescence supplémentaire pour confirmer la localisation intracellulaire. Nous pouvons utiliser la même lignée cellulaire construite qui exprime les vecteurs NanoBiT ou HiBiT pour vérifier la localisation intracellulaire et la détection par luminomètre à haut débit.
Auteur
Taro Hayashi
Chercheur, génie biologique, génie biologique et optique de pointe, recherche et développement, Evident
1. Signal de localisation du noyau (nous avons utilisé 3 fois le signal de localisation du noyau répété).
2. Système d’imagerie de bioluminescence basé sur le microscope IXplore Live. Ce système a été conçu à partir des résultats développés conjointement par le professeur Nagai de l’Université d’Osaka, au Japon, Tokai Hit., Co, Ltd. et Evident. Cet effort a été réalisé dans le cadre du programme de la Japan Science and Technology Agency visant à développer des systèmes avancés de mesure et d’analyse.
3. Technologie de détection d’une protéine cible HiBiT par bioluminescence à l’aide d’une étiquette peptidique de 11 acides aminés (HiBiT) et d’un fragment de luciférase NanoLuc d’environ 18 kDa (LgBiT).
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.