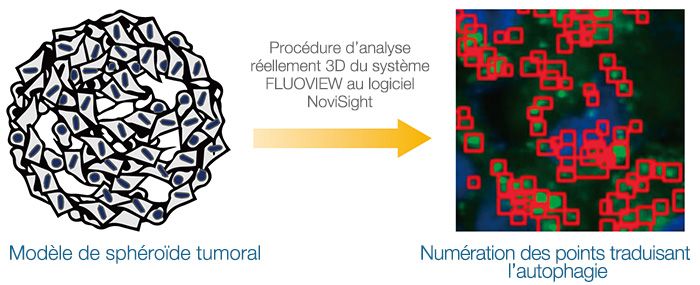
Véritable analyse 3D du processus d’autophagie intracellulaire au sein d’un modèle de sphéroïde 3D
Résumé
Les modèles de culture 3D sont couramment utilisés pour prédire l’efficacité ou la toxicité des médicaments. Dans cette note d’application, nous allons nous concentrer sur le processus d’autophagie intracellulaire. Dans un premier temps, nous avons confirmé l’utilité de la sonde EGFP-LC3 pour le suivi de l’état autophagique dans les modèles. Ensuite, nous avons utilisé la procédure d’analyse réellement 3D d’Olympus avec le microscope confocal FLUOVIEW™ FV3000 et le logiciel NoviSight™ pour quantifier les effets de la chloroquine, un médicament candidat. Nous avons montré que cette procédure d’analyse constitue une bonne alternative aux méthodes de détermination du profil d’efficacité des médicaments candidats in vivo.
Introduction
Les événements moléculaires intracellulaires sont étroitement liés à un large panel de pathologies humaines. L’autophagie est un processus intracellulaire de dégradation et de recyclage des organites et des protéines cellulaires, dont la dysrégulation est impliquée dans certaines maladies humaines. Pour mieux comprendre ces processus pathologiques et tester l’efficacité des médicaments sur ces processus, il est important de
suivre l’état autophagique des cellules humaines dans des conditions pathologiques et thérapeutiques données.
Les modèles de culture 3D tels que les sphéroïdes et les organoïdes permettent de reconstituer le complexe microenvironnement tel qu’il existe in vivo. Pour évaluer correctement l’efficacité d’un médicament sur les cellules constituant les sphéroïdes, il est essentiel de pouvoir analyser de manière quantitative les images microscopiques intracellulaires. Dans cette note d’application, nous décrivons notre étude
du processus d’autophagie intramoléculaire dynamique et notre évaluation quantitative des effets d’un médicament candidat à l’aide du microscope confocal FV3000 d’Olympus et de la procédure d’analyse réellement 3D du logiciel d’analyse NoviSight.
Avantages
- Analyse quantitative des événements intramoléculaires dans des modèles de culture 3D
Résultats et discussion
La protéine LC3 constitue un marqueur très utile pour l’étude du processus d’autophagie. L’utilisation d’une fusion de LC3 avec une protéine fluorescente, l’EGFP, a par exemple permis de mettre en évidence une augmentation du nombre de points fluorescents lors de l’accumulation des autophagosomes. La formation des autophagosomes est régulée par plusieurs composés capables de moduler l’activité autophagique ou le renouvellement des autophagosomes. Certains de ces composés sont maintenant étudiés dans des essais cliniques. L’un d’entre eux, la chloroquine (CQ), un médicament utilisé à l’origine dans le traitement de la malaria, fait actuellement l’objet d’un essai visant à évaluer si sa capacité à inhiber la fusion des autophagosomes et des lysosomes pourrait être exploitée dans le traitement du cancer.
Validation d’un marqueur de l’autophagie à l’aide d’un système de culture 2D
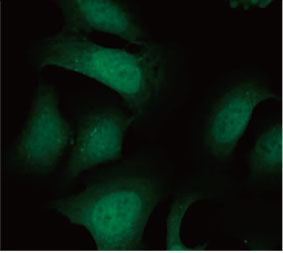
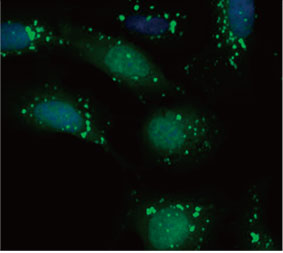
Nous avons validé l’utilité de la sonde EGFP-LC3 pour mesurer l’effet inhibiteur de la CQ sur le processus d’autophagie dans un système de culture 2D. Nous avons préparé une lignée de cellules d’ostéosarcome U2OS exprimant de manière stable la protéine de fusion EGFP-LC3. Les cellules ont été cultivées en monocouche dans les puits d’une microplaque. Après incubation avec la CQ, les cellules ont
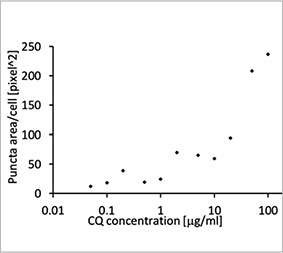
été fixées et marquées au Hoechst 33342. Des images en fluorescence ont montré que le traitement à la CQ induisait la formation de points d’EGFP-LC3 fluorescents (figure 1 A et B). La surface des points par cellule a été mesurée en fonction de la position du noyau de chaque cellule. Celle-ci était plus importante à mesure que la concentration en CQ augmentait. Cela confirme l’utilité de la sonde EGFP-LC3 pour
l’évaluation du processus d’autophagie.
(A)
| (B)
| (C)
|
Figures 1 A et B : (A) Cellules U2OS exprimant la protéine EGFP-LC3 dans des conditions de culture normales. (B) Cellules U2OS exprimant la protéine EGFP-LC3 traitées avec de la CQ pendant une heure. Figure 1 C : représentation graphique de l’augmentation de la surface des points en fonction de la concentration en CQ. | ||
Quantification des points de LC3 dans le modèle de sphéroïde tumoral
Pour suivre l’état autophagique dans les modèles de culture 3D, nous avons choisi une lignée de cellulules HeLa établie à partir d’un carcinome du col utérin. Les cellules HeLa sont parfaitement adaptées à la culture cellulaire en 3D sans support et forment des sphéroïdes tumoraux de taille uniforme. Nous avons préparé une lignée de cellules HeLa exprimant de manière stable la protéine EGFP-LC3.
Du milieu de culture a été ensemencé avec les cellules dans des microplaques à faible adhérence et à fond rond. Après cinq jours de culture, les sphéroïdes ont été traités à la CQ pendant sept heures. Ensuite, les sphéroïdes ont été fixés, leur membrane a été perméabilisée, leur noyau marqué et, pour finir, les sphéroïdes ont été clarifiés avec du
SCALEVIEW-S4 (FUJIFILM WAKO).
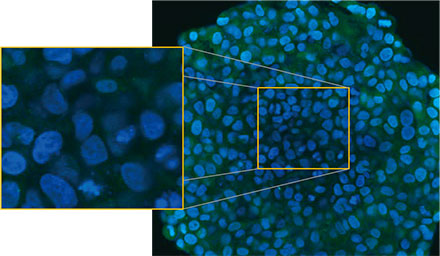
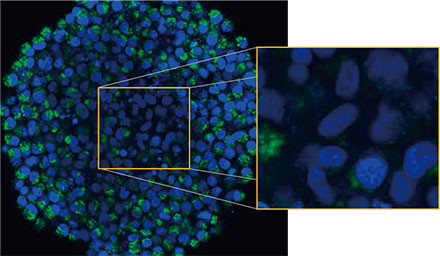
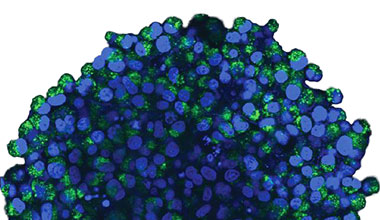
Nous avons observé les sphéroïdes à l’aide du système confocal FLUOVIEW™ FV3000 d’Olympus. Nous avons utilisé un objectif à immersion dans l’huile de silicone (UPLSAPO30XSIR) en raison de sa grande ouverture numérique (ON) et de sa faible aberration sphérique. La figure 2 (A)* représente l’image d’un plan Z acquise au niveau de l’équateur d’un sphéroïde non traité. Le
signal de la protéine EGFP apparaît de manière uniforme dans les cellules. En comparaison, le traitement à la CQ a induit la formation de signaux d’EGFP ponctués dans les cellules (figure 2 [B]*). Ces points ont été observés aussi bien au centre qu’à la périphérie du sphéroïde. Le traitement à la CQ n’a pas entraîné de modification apparente de la taille du sphéroïde, ce qui
indique que le processus d’autophagie intracellulaire peut constituer un meilleur marqueur d’évaluation de l’efficacité de la CQ dans es sphéroïdes tumoraux 3D que la réduction de la taille des sphéroïdes.
Pour analyser de manière quantitative les événements intracellulaires dans les modèles de culture 3D, nous avons utilisé la procédure d’analyse réellement 3D d’Olympus qui associe des images acquises à l’aide du microscope confocal FV3000 et l’analyse faite avec le logiciel NoviSight™, ce qui offre de nombreux avantages par rapport aux techniques analytiques conventionnelles. Dans le cadre d’une analyse traditionnelle,
nous aurions utilisé la valeur caractéristique intégrée des objets identifiés à partir de plusieurs images de plans Z ou analyser l’image des projections des nombreuses images de plans Z. Ces méthodes ne sont pas fiables, car elles comportent le risque de compter plusieurs fois les objets étudiés ou que certains objets ne soient pas comptabilisés du fait qu’ils étaient masqués ou obscurcis par d’autres objets. La
procédure d’analyse réellement 3D d’Olympus quant à elle inclut l’acquisition d’images de plans Z séquentiels à des intervalles optimisés par le logiciel FLUOVIEW™. Le logiciel reconstruit le volume 3D et identifie les objets étudiés comme des grappes de voxels. Le logiciel NoviSight est ensuite utilisé pour l’analyse statistique. La procédure du système FLUOVIEW au logiciel NoviSight est simple à
suivre et offre une plate-forme idéale pour l’analyse des modèles de culture 3D.
(A)
| (B)
|
Figures 2 A et 2 B : sphéroïdes de cellules HeLa exprimant la protéine EGFP-LC3 (A) dans des conditions de culture normales et (B) traités à la CQ. Les médaillons sont des agrandissements des zones comprises dans les rectangles jaunes représentés sur les images originales des sphéroïdes.* | |
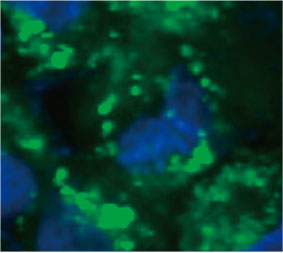
Pour calculer le nombre de cellules en autophagie dans le sphéroïde, le logiciel a identifié le noyau de chaque cellule. Ensuite, les zones entourant chaque noyau ont été définies comme des zones masquées. Enfin, les points des signaux d’EGFP situés dans les régions masquées ont été identifiés comme des objets point (figure 2 [C]*). Les cellules renfermant plus de trois points ont alors été
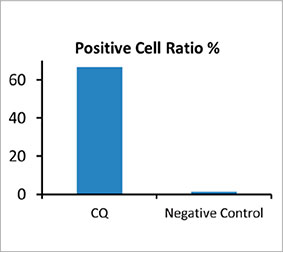
considérées comme étant des cellules en autophagie. Le sphéroïde en 3D non traité comprenait environ 1,4 % de cellules en autophagie tandis que le sphéroïde traité à la CQ en comprenait 66,6 % (figure 2 [D]*). L’analyse quantitative montre également que la CQ a induit la formation des points dans les sphéroïdes tumoraux.
(C)
|
| (D)
|
Figure 2 C - gauche : image originale des cellules dans le sphéroïde traité à la CQ. Droite : la même image avec identification des points (rectangles rouges).* | ||
Conclusion
Le microscope confocal FLUOVIEW FV3000 d’Olympus et le logiciel NoviSight, qui font partie intégrante de la procédure d’analyse réellement 3D, ont été utilisés pour quantifier l’effet de la CQ sur le processus d’autophagie intracellulaire dans des modèles de culture 3D. Cette étude montre que les chercheurs peuvent utiliser cette procédure pour établir le profil d’efficacité d’un médicament en fonction de la dose administrée ou pour cribler de manière objective des médicaments candidats. Il existe d’autres marqueurs moléculaires intracellulaires utiles pour évaluer l’efficacité ou la toxicité d’un médicament, comme les sondes de FISH pour détecter les anomalies chromosomiques ou des molécules de signalisation marquées par fluorescence pour détecter une perturbation de leur translocation. Cette procédure peut permettre de quantifier une grande variété d’événements intracellulaires dans des modèles de culture 3D et constitue une alternative aux méthodes de détermination du profil d’efficacité ou de toxicité des médicaments candidats in vivo.
Références
- Maria C et al., (2019) Targeting autophagy to overcome human disease. International Journal of Molecular Sciences. 20(3): E725. doi: 10.3390/ijms20030725
- Yan C et al., (2013) Therapeutic targeting of autophagy in disease: Biology and Pharmacology. Pharmacological Reviews. 65: 1162–1197. doi: 10.1124/pr.112.007120
- Daniel JK et al., (2008) Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4(2): 151–175. doi: 10.4161/auto.5338
Auteur
Kazuhito Goda
*Bien que la lignée cellulaire HeLa soit devenue l’une des plus importantes dans la recherche médicale, nous devons absolument reconnaître que la contribution de Henrietta Lacks à la science s’est produite sans son consentement. Cette injustice, bien qu’elle ait mené à des découvertes clés en immunologie, en maladies infectieuses et en cancer, a également suscité d’importantes conversations sur la confidentialité,
l’éthique et le consentement en médecine.
Pour en savoir plus sur la vie de Henrietta Lacks et sur sa contribution à la médecine moderne, cliquez ici.
http://henriettalacksfoundation.org/
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.