Analyse 3D de sphéroïdes tumoraux mixtes à l’aide du logiciel NoviSight™
Des images confocales de de sphéroïdes mixtes ont été analysées de manière quantitative à l’aide du logiciel NoviSight en vue d’évaluer leur population cellulaire et de déterminer la sensibilité aux médicaments de chaque cellule.
Introduction
L’évaluation de l’efficacité d’un médicament sur des sphéroïdes tumoraux tridimensionnels est d’une grande importance, car ceux-ci ont la capacité de restituer in vitro le microenvironnement complexe des tumeurs cancéreuses in vivo. Les sphéroïdes permettent donc aux chercheurs d’évaluer l’efficacité d’un médicament dans des conditions les plus proches possible de celles de l’environnement naturel d’une tumeur.
Pour tester l’utilité du logiciel d’analyse 3D NoviSight pour ce type d’application, nous avons générés des sphéroïdes tumoraux par co-culture de cellules A549 et de cellules HeLa. Nous avons ensuite utilisé le logiciel NoviSight pour réaliser une analyse tridimensionnelle des effets d’un traitement médicamenteux sur ces cellules. Cette étude a montré que le logiciel NoviSight peut être utilisé avec succès pour classer des objets en fonction de leurs caractéristiques et pour analyser les paramètres de chacun d’entre eux en vue de l’évaluation de l’efficacité d’un médicament.
![]()
Schéma récapitulatif
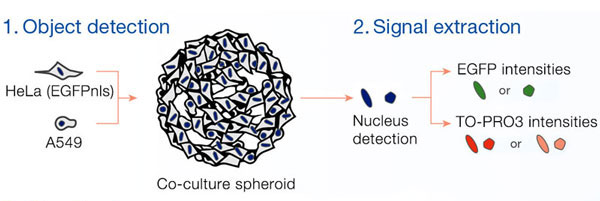 | |
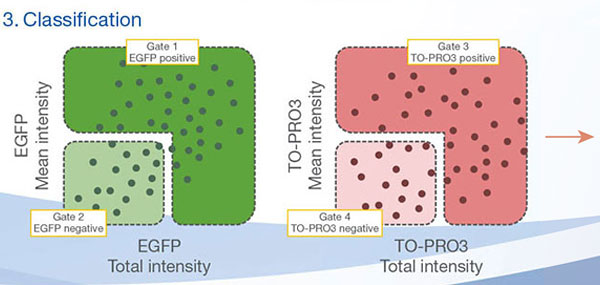 | 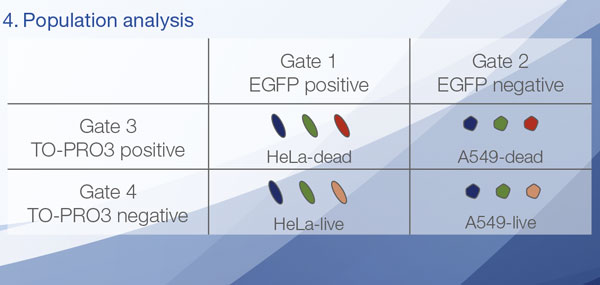 |
Avantages
- Il est possible de classer les cellules en deux types en fonction des signaux qui y sont associés, puis d’analyser ces populations de cellules.
- L’efficacité d’un médicament peut être évaluée de manière spatiale en séparant la zone centrale de la zone périphérique du sphéroïde.
Méthodes
Préparation des cellules
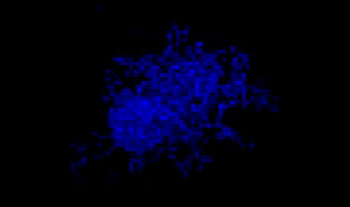
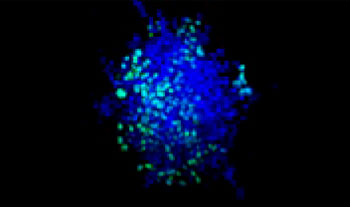
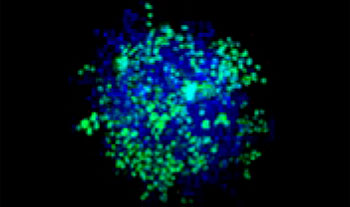
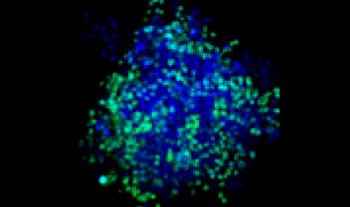
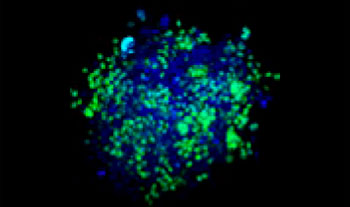
Des cellules pulmonaires humaines A549 et des cellules de cancer du col de l’utérus HeLa (exprimant l’EGFP dans leur noyau) ont été mélangées selon différentes proportions. Le taux de cellules HeLa a été ajusté en fonction de l’intensité des signaux de l’EGFP (fig. 1*1). Du milieu DMEM renfermant 10 % de SVF a été ensemencé avec les cellules dans une microplaque à 384 puits à fond rond Corning® (200 cellules par puits), puis les cellules ont été cultivées pendant trois jours. La microplaque a été délicatement centrifugée pour enlever toutes les bulles d’air dans les puits.
A549 : HeLa-EGFPnls
100:0
| 75:25
| 50:50
| 25:75
| 0:100
|
Figure 1. Préparations des sphéroïdes tumoraux mixtes*1
Préparation des échantillons
Les échantillons ont été traités à la staurosporine (STS) pendant 5 heures à des concentrations comprises entre 3,7 nM et 3,75 μM pour atteindre un ratio cellules A549/cellules HeLa de 1:1 dans les sphéroïdes. En exploitant la différence de perméabilité de la membrane cytoplasmique des cellules vivantes et des cellules mortes, nous avons déterminé la viabilité des cellules en marquant les noyaux de toutes les cellules avec 10 µM de Hoechst 33342 (DOJINDO) et les noyaux des cellules mortes avec 1 µM de TO-PRO3 (Thermo Fisher Scientific®). Nous avons ensuite rincé les échantillons trois fois dans du PBS 1x et les avons fixés à 4 °C (39,2 °F) au paraformaldéhyde à 4 % pendant une nuit. Avant de procéder à l’imagerie, les sphéroïdes ont été traités avec le réactif de clarification des tissus SCALEVIEW-S4 (FUJIFILM Wako) pendant une nuit à température ambiante.
Image et analyse
Des images en fluorescence des sphéroïdes ont été acquises à l’aide du microscope confocal à balayage laser FLUOVIEW® FV3000 équipé d’un objectif super-apochromatique A Line (UPLSAPO30XS). La bague de correction de l’objectif a été réglée en fonction de l’indice de réfraction du liquide d’immersionde sorte à produire des images et une morphologie 3D d’excellente qualité. Plusieurs images ont été importées dans le logiciel d’analyse cellulaire 3D NoviSight™ qui les a assemblées pour créer des représentations tridimensionnelles. Le logiciel NoviSight est capable d’identifier des objets tels que les noyaux et de réaliser plusieurs analyses des signaux contenus dans les objets.
Résultats
Représentation de la sensibilité à un médicament dans des sphéroïdes mixtes
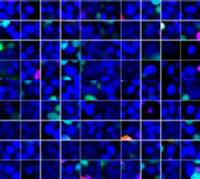
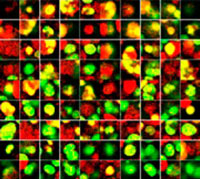
La clarification des sphéroïdes et l’utilisation du microscope confocal à balayage laser FV3000 nous ont permis de capturer des images des sphéroïdes mixtes en profondeur. Le traitement par la staurosporine a induit une augmentation du nombre de cellules mortes proportionnellement à la dose (fig. 2*1). Une analyse tridimensionnelle est requise pour identifier les cellules mortes et déterminer leur nombre dans une masse tridimensionnelle.
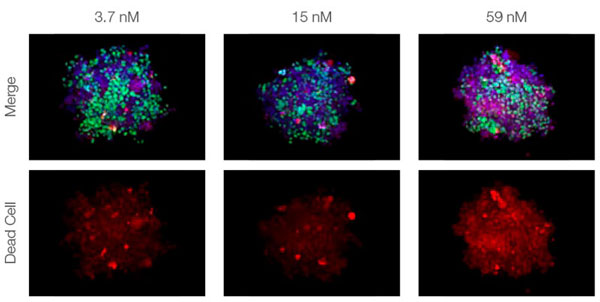
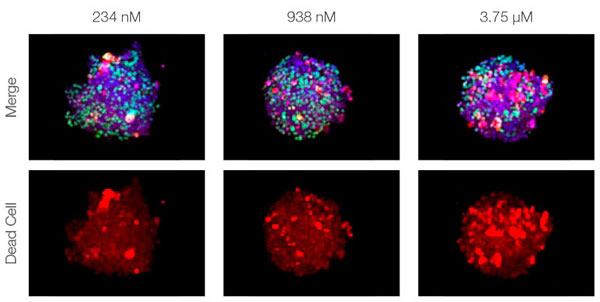
Figure 2. Réponse au traitement dans des sphéroïdes mixtes*1
Analyse de la sensibilité à un médicament dans des sphéroïdes mixtes
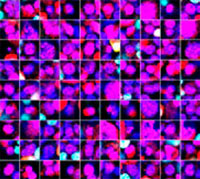
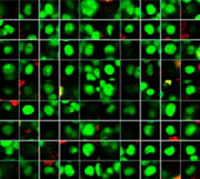
Les signaux du Hoechst 33342 nous ont permis d’identifier les noyaux. Toutes les cellules ont été classées en deux groupes en fonction de la présence ou de l’absence d’un signal de l’EGFP : positif à l’EGFP (cellules HeLa) et négatif à l’EGFP (cellules A549). Les cellules placées dans ces deux groupes ont été divisées en fonction de la présence ou de l’absence des signaux caractéristiques des cellules mortes (TO-PRO3, rouge). Ainsi, quatre groupes ont été créés au total (fig. 3*1). Les pourcentages de cellules A549 et HeLa vivantes par rapport au nombre total de cellules ont été calculés et représentés graphiquement (fig. 4). Les résultats ont montré que les cellules HeLa étaient plus sensibles à la staurosporine que les cellules A549.
En utilisant le logiciel NoviSight™, il a été possible de classer les types de cellules contenues dans chaque sphéroïde tumoral mixte et d’analyser la réponse au médicament de chaque type de cellules.
| Galerie photo |
|
|
|
|
| Hoechst | + | + | +*2 | +*2 |
| EGFP | - | - | + | + |
| TO PRO 3 | - | + | - | + |
Figure 3. Le logiciel NoviSight permet de classer les cellules en quatre groupes en fonction des signaux observés*1
*2 Les deux galeries de photos de droite n’affichent pas les signaux Hoechst
Concentration en staurosporine
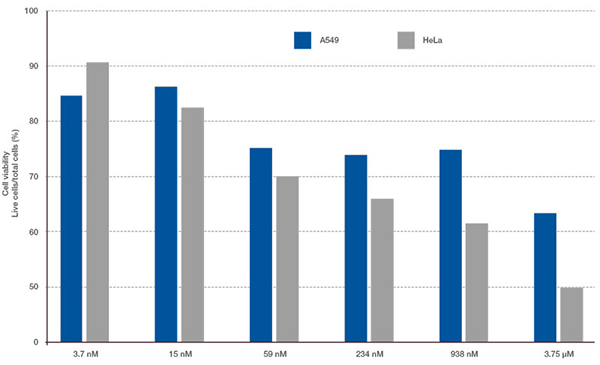
Figure 4. Différences entre la réponse à la staurosporine des cellules A549 et celle des cellules HeLa
Stratégie de l’analyse spatiale
Les images sont acquises en trois dimensions de sorte qu’une analyse spatiale plus complexe puisse être réalisée. Cela permet d’analyser le comportement des cellules dans des tissus hétérologues tels que des tissus cancéreux. Le logiciel NoviSight™ est capable de définir la zone à analyser. Nous avons paramétré le logiciel afin qu’il analyse la zone centrale et la zone périphérique de chaque sphéroïde et avons créé huit groupes (fig. 5). Nous avons ensuite réalisé une analyse des populations de cellules au sein de ces zones (fig. 6). Cette méthode permet une analyse spatiale de l’efficacité d’un médicament dans des sphéroïdes tumoraux mixtes.
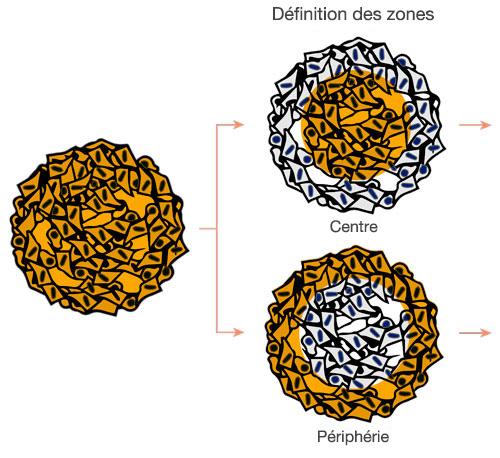 | 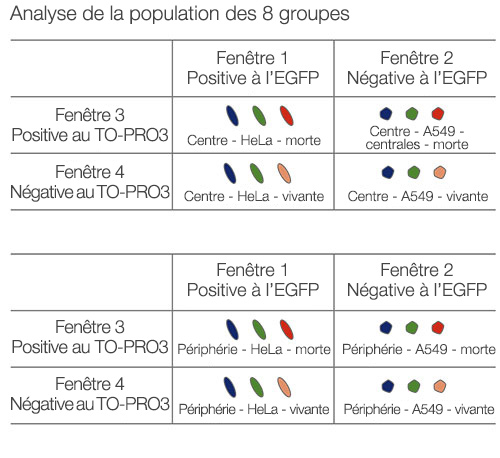 |
Figure 5. Schéma de principe de l’analyse spatiale
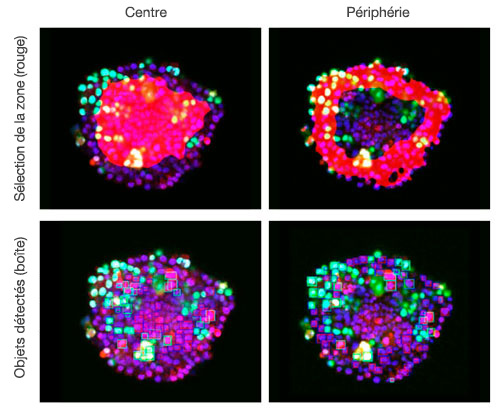
Figure 6. Le logiciel NoviSight permet de classer les cellules es zones centrales et périphériques
Analyse spatiale de l’efficacité d’un médicament
Le logiciel NoviSight™ permet non seulement de compter le nombre de cellules mortes, mais il permet également d’analyser l’efficacité spatiale du médicament. Pour montrer l’efficacité de cette fonctionnalité, nous avons réalisé une analyse spatiale de chaque type de cellule morte dans les sphéroïdes mixtes. Le rapport entre chaque type de cellule morte et le nombre total de cellules au centre et en périphérie des sphéroïdes a été calculé (fig. 7). Dans ce cas, aucune différence d’efficacité du médicament entre ces deux zones n’a été constatée. Le nombre de cellules mortes au centre et en périphérie des sphéroïdes était en fonction de la dose administrée.
Concentration en staurosporine
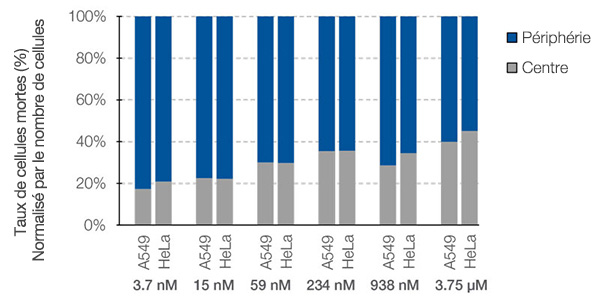
Figure 7. Différences de réponse à la staurosporine entre le centre et la périphérie des sphéroïdes
Conclusion
L’utilisation du logiciel NoviSight et du microscope confocal à balayage laser FLUOVIEW® FV3000 a permis de classer les types de cellules présents dans des sphéroïdes tumoraux mixtes et d’analyser la réponse à la staurosporine de chaque type de cellule. En modifiant la combinaison des cellules des co-cultures, il est possible de reproduire le microenvironnement de divers cancers et d’évaluer l’efficacité de médicaments anticancéreux.
Auteurs
Hiroya Ishihara, Biological Evaluation Technology 2, Research and Development
*1 Bien que la lignée cellulaire HeLa soit devenue l’une des plus importantes dans la recherche médicale, nous devons absolument reconnaître que la contribution de Henrietta Lacks à la science s’est produite sans son consentement. Cette injustice, bien qu’elle ait mené à des découvertes clés en immunologie, en maladies infectieuses et en cancer, a également suscité d’importantes conversations sur la confidentialité,
l’éthique et le consentement en médecine.
Pour en savoir plus sur la vie de Henrietta Lacks et sur sa contribution à la médecine moderne, cliquez ici.
http://henriettalacksfoundation.org/
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.