Observation d’un sphéroïde tumoral vascularisé sur une puce à l’aide d’un microscope confocal
Des études ont montré que les tumeurs induisent la croissance d’un réseau de vaisseaux sanguins favorisant une activité tumorale vigoureuse. La vascularisation du microenvironnement tumoral joue un rôle vital dans le développement de la tumeur. Jusqu’à présent, les réponses tumorales aux stimuli biochimiques et biomécaniques ont été évaluées dans des conditions statiques, et il n’a pas été possible de tenir compte des effets de l’afflux sanguin dans les tumeurs. Dans cette étude, nous présentons une plate-forme de modélisation tumorale sur puce permettant l’évaluation du microenvironnement via la circulation de milieux dans un réseau vasculaire perfusable et la mesure des effets de l’administration d’agents thérapeutiques incorporés à l'afflux sanguin.
Observation 3D d’un sphéroïde tumoral sur une puce microfluidique
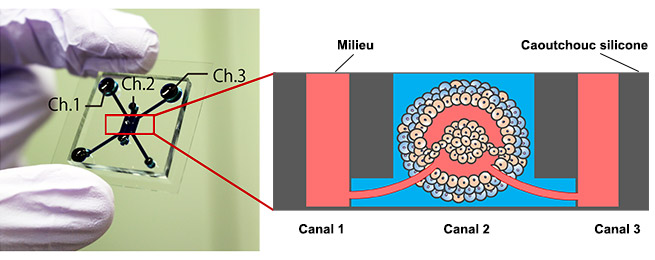
Figure 1. Puce microfluidique et modèle de tumeur
Image de la puce microfluidique (à gauche), modèle de tumeur avec réseau vasculaire perfusable (à droite)
Dans cette étude, nous avons reconstitué le microenvironnement tumoral avec son réseau vasculaire en cocultivant des cellules endothéliales de veine ombilicale humaine (HUVEC) et des sphéroïdes contenant des cellules d’adénocarcinome du sein humain (MCF-7) dans des puces microfluidiques. Afin de nous assurer de la perfusabilité du réseau vasculaire dans la puce microfluidique, nous avons observé à l’aide du microscope confocal FV3000RS si des billes fluorescentes (vertes) arrivaient à circuler de façon continue dans le réseau vasculaire et le sphéroïde. Les échantillons cultivés en 3D sont peu propices à l’imagerie en raison de leur épaisseur. Il faut généralement augmenter l’intensité de la lumière d’excitation afin de produire un signal fluorescent suffisamment fort pour être détecté, mais plus l’intensité de la lumière d’excitation est forte, plus la phototoxicité est élevée, ce qui endommage les cellules. Pour résoudre ce problème, nous avons utilisé le microscope confocal FV3000, qui intègre la technologie de détection TruSpectral et des détecteurs GaAsP à haute sensibilité d’Olympus, afin de pouvoir capter les signaux fluorescents faibles et minimiser la puissance du laser.
(a)
| (b)
|
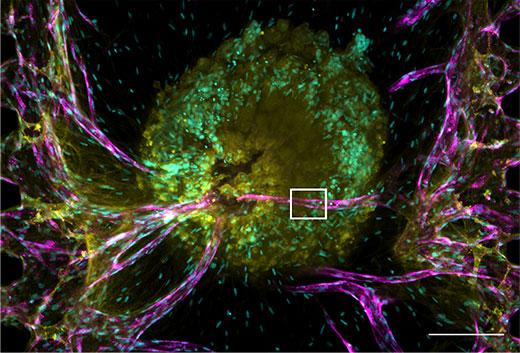
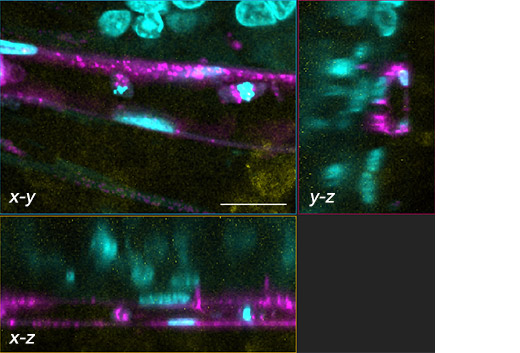
Figure 2. Sphéroïde tumoral et son réseau vasculaire.
Noyaux : cyan (405 nm, Hoechst 33342), RFP-HUVEC : magenta (561 nm, RFP), E-cadhérine : jaune (640 nm, Alexa Fluor 633).
(a) Image de projection du sphéroïde tumoral. Échelle : 200 μm; objectif : UPLSAPO10X2.
(b) Trois images planes (xy, xz, yz) provenant de la section encadrée en blanc dans la figure (a). Échelle : 20 μm; objectif : UPLSAPO40X2.
Imagerie à haute vitesse de l'afflux sanguin à l’aide d’un scanner résonnant
Nous avons également examiné la circulation dans le réseau vasculaire du sphéroïde tumoral à l’aide de microbilles fluorescentes vertes (diamètre : 3,1 μm). Pour l’observation de la circulation sanguine à haute vitesse, la vitesse de balayage d’un scanner galvanométrique ordinaire peut ne pas être suffisante. Dans cette expérience, les images ont été prises à l’aide du microscope confocal FV3000RS d’Olympus équipé d’un scanner résonnant à haute vitesse. Nous avons pu confirmer la perfusabilité du réseau vasculaire artificiel en constatant que les microbilles fluorescentes injectées dans le canal 3 de la puce microfluidique avaient traversé les structures luminales du sphéroïde pour atteindre le canal 1. Après la démonstration de la validité de ce modèle de sphéroïde tumoral artificiel pour l’étude des effets de la circulation sanguine sur le microenvironnement tumoral, nous avons été en mesure de déterminer au cours d’expériences ultérieures que l’efficacité des agents thérapeutiques dans le microenvironnement tumoral et son réseau de vaisseaux sanguins varie en fonction de la présence ou de l’absence de la circulation intravasculaire. Nous pensons que notre modèle tridimensionnel peut servir de modèle pour le développement et l’administration transvasculaire d’agents thérapeutiques.
Vidéo : Circulation de billes fluorescentes à l’intérieur des vaisseaux sanguins et des sphéroïdes tumoraux reconstitués sur une puce microfluidique.
Conditions d’imagerie : 65 ms/image Échelle : 100 μm
Commentaire du docteur Yokokawa
L’aspect novateur de cette étude résidait dans le réseau vasculaire perfusable reconstitué dans un sphéroïde tumoral. Il était important de visualiser comment le réseau vasculaire reliait le sphéroïde aux canaux de la puce microfluidique. De plus, il était essentiel d’observer simultanément la lumière vasculaire et la circulation à travers le système vasculaire pour démontrer la perfusabilité. Le scanner résonnant à haute vitesse intégré au microscope confocal FV3000 a permis l’imagerie du réseau vasculaire (marqué à la RFP) et de la circulation dynamique des microbilles (vert).
Docteur Ryuji Yokokawa1 |
Docteur Yuji Nashimoto2 |
Remerciements
Cette note d’application a été rédigée avec l’aide des chercheurs suivants :
Département de microingénierie, Université de Kyoto1
Frontier Research Institute for Interdisciplinary Sciences (FRIS), Université de Tohoku2
L’apport du microscope confocal FV3000 à notre expérience
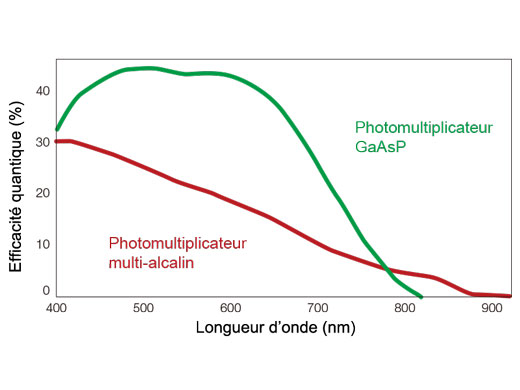
Le système entièrement spectral avec détecteurs GaAsP haute efficacité offre la grande sensibilité nécessaire à l’imagerie des cellules vivantes
Related Videos |
|
Le microscope confocal FV3000 repose sur la technologie de détection TruSpectral d’Olympus, qui diffracte la lumière en la transmettant à travers une unité holographique de phase volumique. Cette technologie permet d’obtenir une luminosité largement supérieure par rapport aux unités de détection spectrale conventionnelles équipées de réseaux de type à réflexion. Le détecteur haute sensibilité (HSD) à deux canaux du microscope FV3000 utilise la technologie TruSpectral avec des photomultiplicateurs GaAsP refroidis par effet Peltier pour une efficacité quantique élevée (45 %) et un rapport signal/bruit élevé. L’association de ces technologies de détection permet une détection haute sensibilité et minimise la puissance laser requise pour l’observation de tissus vivants.
Choix de deux systèmes de balayage
Related VideosVidéo : Plaquettes agrégées sur une thrombose dans un vaisseau sanguin de souris. Images prises à 30 ips en plein écran par un scanner résonnant avec 2 canaux à photomultiplicateur GaAsP. Données d’images reproduites avec l’aimable autorisation de Dr Takuya Hiratsuka, Dr Michiyuki Matsuda, Graduate School of Biostudies, Université de Kyoto. | Faites votre choix parmi deux systèmes de balayage : un scanner galvanométrique classique (FV3000) ou un scanner hybride galvanométrique/résonnant (FV3000RS). Le scanner résonnant permet de capturer 30 images par seconde avec un champ de vision complet à 512 × 512 pixels, ou jusqu’à 438 images par seconde en rétrécissant l’axe Y pour capturer en direct des phénomènes physiologiques cruciaux, comme le flux calcique |
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.