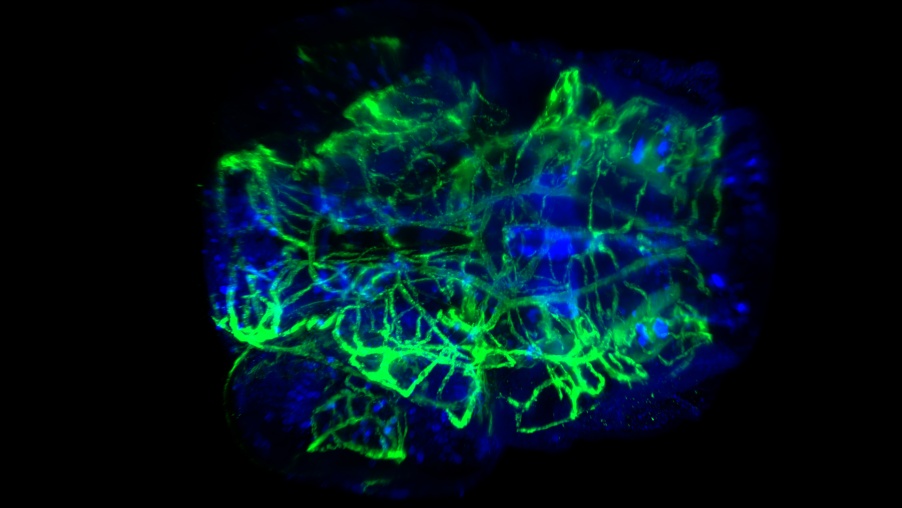
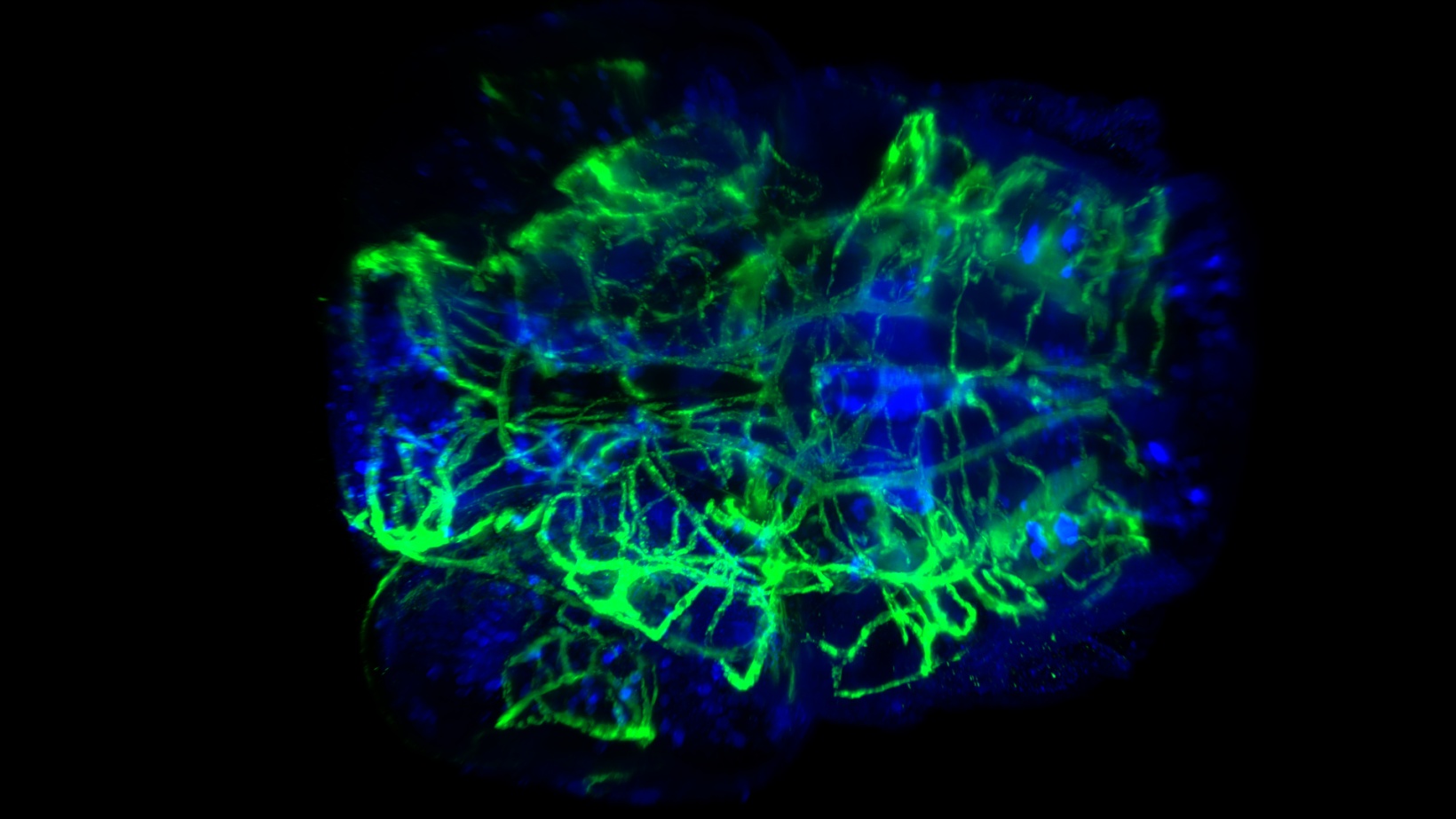
Coloration vasculaire et neurale d’une tête de larve de poisson-zèbre clarifiée. Prise à 20x avec une ON de 0,5 et CUBIC-2. Image reproduite avec l’aimable autorisation de P. Affaticati et A. Jenett de l’infrastructure Tefor, France.
Nous vivons dans un monde en trois dimensions et en évolution constante. Pourtant, en microscopie, notre capacité à produire des images 3D aux vitesses requises pour observer des processus vivants rapides reste confrontée à des obstacles. Comparée aux autres techniques de microscopie optique, la microscopie en fluorescence permet d’atteindre une spécificité et un contraste élevés, mais le rapport signal/bruit et la phototoxicité constituent encore des limitations importantes.
Les approches classiques, telles que la microscopie confocale, éliminent la lumière hors foyer, un processus connu sous le nom de sectionnement optique, à l’aide d’un sténopé dans le plan focal. Bien que cette méthode permette d’accroître le rapport signal/bruit, l’échantillon doit toujours être exposé de manière répétée à des quantités importantes de lumière hors foyer, ce qui augmente la probabilité d’un photoblanchiment.
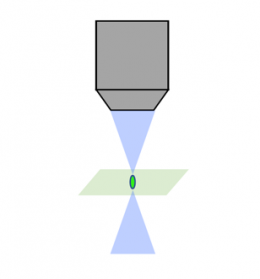 Balayage laser confocal | 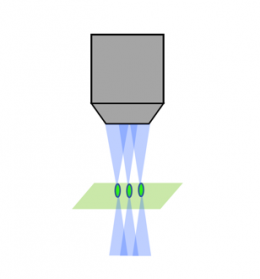 Disque rotatif confocal | 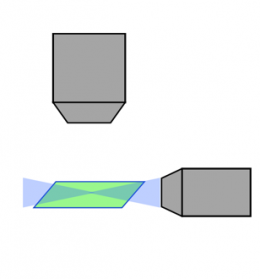 Feuillet de lumière |
Et la lumière fut : l’avènement de la microscopie à feuillet de lumière
Au début des années 1900, les scientifiques ont commencé à chercher un moyen d’améliorer l’imagerie biologique. Dans le cadre de ces travaux, Richard Zsigmondy et Henry Siedentopf ont mis au point en 1902 un dispositif optique appelé l’« ultramicroscope » (Heddleston & Chew, 2016 ; Adams et al., 2016). Ce premier microscope à feuillet de lumière se distinguait de l’architecture optique classique en séparant les trajets optiques d’éclairage et de détection, créant ainsi le premier microscope à feuillet de lumière orthogonal.
Près de 100 ans plus tard, Voie et al. ont publié les premières images obtenues avec un microscope à fluorescence à feuillet de lumière (LSFM) en recourant à une architecture de plan orthogonal pour opérer un sectionnement optique de la cochlée d’un cobaye (Heddleston & Chew, 2016 ; Adams et al., 2016). Plus récemment, des variantes de LSFM ont été mises au point pour prendre des images de bactéries, de drosophiles, de poissons-zèbres et de divers autres tissus.
Ouvrir la microscopie de fluorescence à feuillet de lumière à tous
Les systèmes de LSFM modernes, on parle également de microscopie par éclairage sélectif d’un plan (SPIM), utilisent des variantes d’architectures orthogonales comme leurs prédécesseurs, mais s’appuient sur des lentilles cylindriques pour produire un feuillet de lumière fin pour le sectionnement optique. Ce feuillet de lumière fin excite uniquement une sous-région de l’échantillon dans le plan focal de l’objectif d’imagerie. Associée à une caméra sCMOS à grande vitesse pour la collecte des émissions, la LSFM fournit des profondeurs d’échantillonnage accrues, un meilleur rapport signal/bruit et des vitesses d’imagerie accrues pour une phototoxicité réduite par rapport aux technologies confocales classiques.
L’imagerie par fluorescence à feuillet de lumière est désormais reconnue comme une technique de microscopie essentielle pour étudier des organes entiers ou des spécimens vivants. Son développement au sein de la communauté scientifique reste cependant freiné par son champ d’application relativement restreint et sa capacité limitée à s’adapter aux systèmes modèles actuels. Ces dernières années, les systèmes de LSFM sont devenus plus facilement disponibles dans le commerce pour répondre aux besoins des chercheurs dans les domaines liés à la biologie. Cependant, tous les systèmes ne sont pas conçus de la même manière, et il est important de tenir compte de la manière dont différentes caractéristiques peuvent répondre à vos besoins.
Quatre éléments importants à prendre en compte pour comparer des systèmes de LSFM
Il est nécessaire de tenir compte de plusieurs caractéristiques importantes pour décider du système de fluorescence à feuillet de lumière qui vous convient le mieux.
- Premièrement, la préparation des échantillons :
Contrairement à la microscopie classique où de grands échantillons fixés sont généralement sectionnés et montés sur des lames, l’imagerie par microscopie à feuillet de lumière se fait sur des échantillons intacts. Ceux-ci doivent donc être optiquement clarifiés, c’est-à-dire les rendre transparents. De nombreux protocoles permettent de clarifier différents tissus et de nombreuses solutions de clarification sont disponibles dans le commerce. Je recommande de lire « A beginner’s guide to tissue clearing » de Pablo Ariel (Int J Biochem Cell Biol. 2017 Mar. 84:35–39) pour une synthèse de quelques méthodes courantes. - Architecture optique :
L’architecture optique pour les trajets d’éclairage et de détection peut avoir un impact important sur la nature et sur la taille des échantillons qui peuvent être observés ainsi que sur la qualité de votre image. Les artefacts de bandes, par exemple, sont provoqués par la réfraction de la lumière émise sur une structure opaque dans l’échantillon. Pour résoudre ce problème, de nombreuses architectures optiques ont été conçues pour l’acquisition d’images sur des échantillons vivants ou clarifiés de toutes tailles. Un exemple d’architecture de ce type est la SPIM multidirectionnelle (mSPIM), dans laquelle plusieurs trajets d’éclairage sont alignés pour éclairer l’échantillon et éviter les artefacts de bandes. Si les systèmes de mSPIM peuvent offrir des performances optimales pour des applications spécifiques, ils partagent tous des limites quant à la flexibilité, la modularité et la praticité, qu’il convient de prendre en compte lors du choix du système qui convient le mieux à votre type de recherche.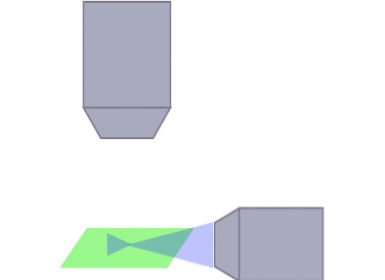
SPIM
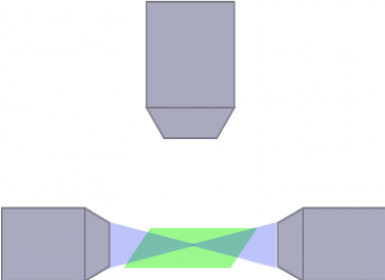
mSPIM
(Schwarz, et al. PLoS One, 2015)
- Flexibilité des échantillons :
Si la LSFM est un domaine qui connaît une expansion rapide avec la commercialisation de nouveaux systèmes chaque année, les types d’échantillons que ceux-ci peuvent prendre en charge varient fortement en raison de leurs différences de conceptions. Certains systèmes peuvent uniquement prendre des images d’échantillons de taille réduite tels que des sphéroïdes, tandis que d’autres peuvent uniquement traiter des tissus de plus grande taille. Ils peuvent aussi être limités à l’imagerie de spécimens fixés ou vivants. Bien que ce type de spécificité puisse être idéal pour un utilisateur unique qui se concentre sur un seul type d’échantillon, cela compromet la possibilité de partager votre équipement avec l’ensemble d’un service de recherche ou d’étendre votre recherche. Il est important de prendre en compte tous les types d’échantillons potentiels que votre système de LSFM devra être en mesure de traiter. Récemment, des systèmes de LSFM plus flexibles ont été conçus pour combler cette lacune en matière de prise en charge d’échantillons variés. Le microscope à fluorescence à feuillet de lumière Alpha3, par exemple, est capable de prendre en charge une grande variété de spécimens, des cellules uniques aux cerveaux de souris entiers, y compris des organismes vivants.* - Gestion des données :
Enfin, et c’est peut-être le plus important, il y a la gestion des données. Il arrive qu’une seule expérience atteigne des centaines de gigaoctets (Go) et même des téraoctets (To) de données. Il est fortement recommandé de collaborer avec votre groupe informatique local pour créer un plan pour gérer vos besoins en matière de données. Soyez conscient du fait que vous devrez peut-être acheter un progiciel d’analyse distinct pour procéder au rendu et à l’analyse d’ensembles de données aussi volumineux.
Contenu connexe
A Century of Creation—The Story of Our Life Science Imaging Systems
Galerie d’images numériques en fluorescence d’Olympus
*Le système Alpha3 n’est pas disponible dans toutes les régions. Pour en savoir plus, contactez votre représentant Olympus.