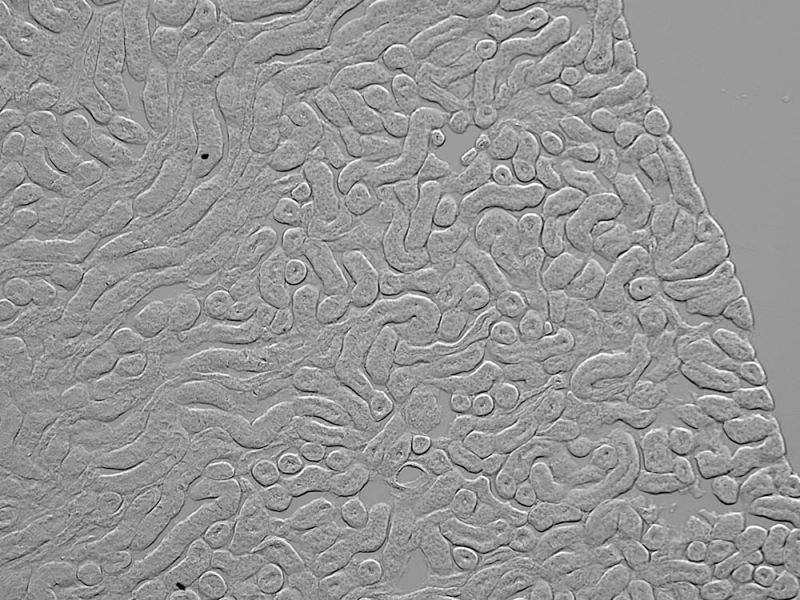
Le système d’imagerie numérique APEXVIEW APX100 prend en charge un grand nombre de
méthodes d’observation. Grâce à ses fonctions conviviales et pratiques et à son logiciel intuitif,
il améliore l’efficacité de diverses applications de recherche sans compromettre la qualité des images.
Cette galerie présente des exemples d’images prises dans diverses applications avec le système d’imagerie
numérique APX100. Si vous avez des questions sur la façon dont vous pouvez l’utiliser dans vos applications, contactez-nous !
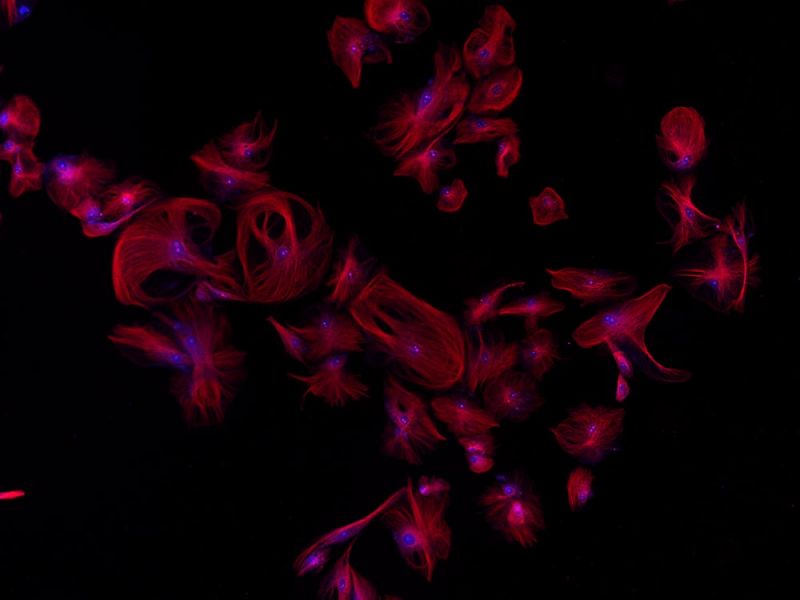
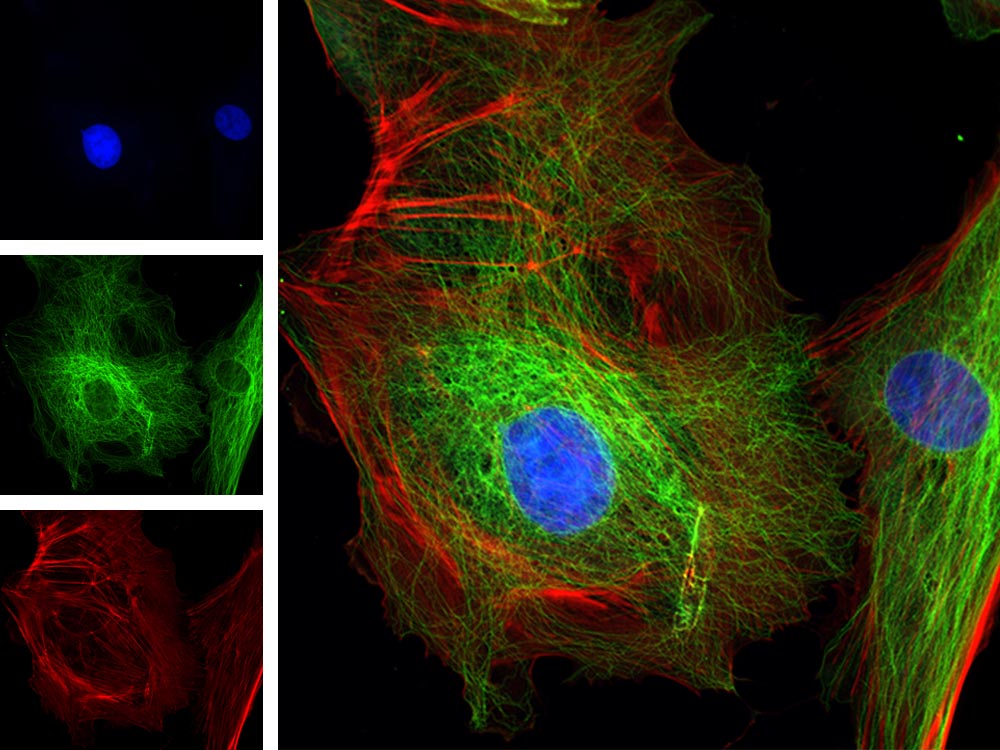 | Fluorescence multicanal
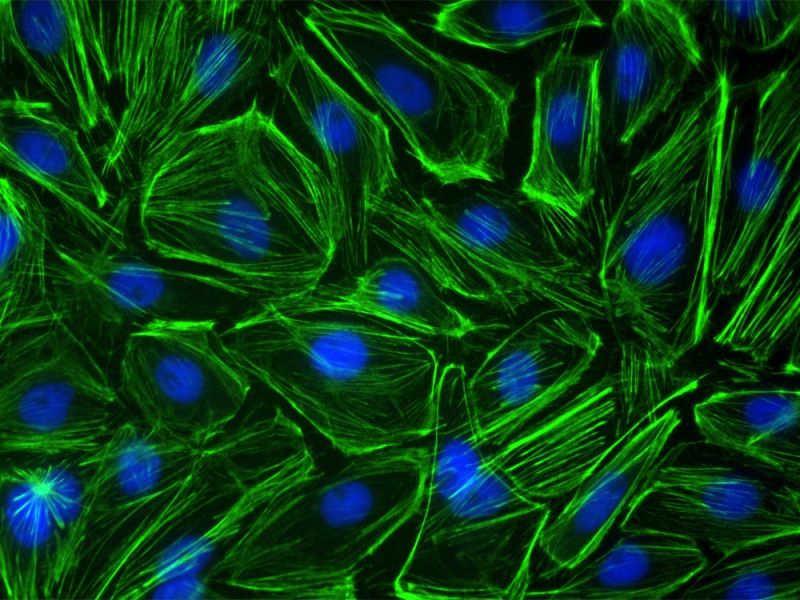
Cellules endothéliales d’artères pulmonaires bovines.Marquage : anti-α-tubuline de souris, IgG de chèvre antisouris BODIPY FL, phalloïdine Texas Red-X, DAPI |
|---|
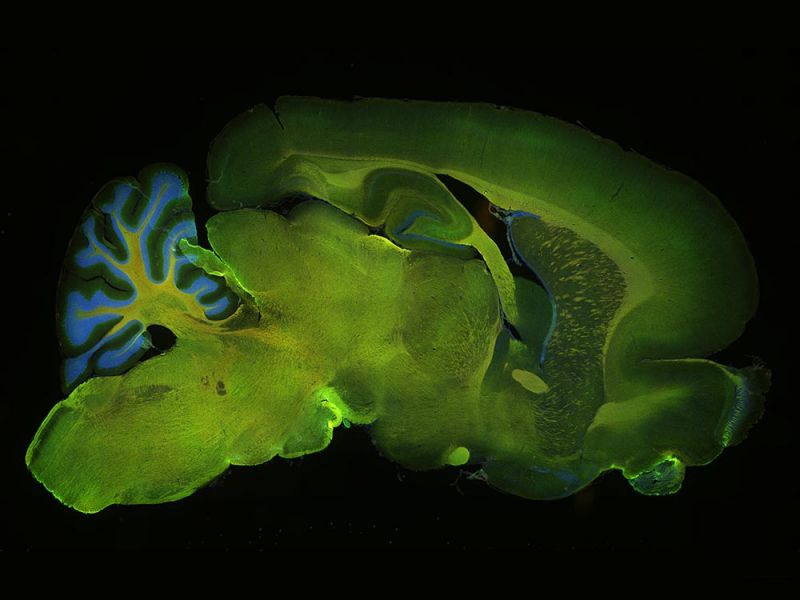
Cervelet de rat marqué avec cinq fluorophoresAcquerrez facilement des images de fluorescence multicanal à des longueurs d’onde allant des UV au proche infrarouge. Fluorophores utilisés : Hoechst (bleu), GFAP (vert), MAP2 (orange), calbindine (rouge), MBP (magenta) Objectif : UPLXAPO4X | 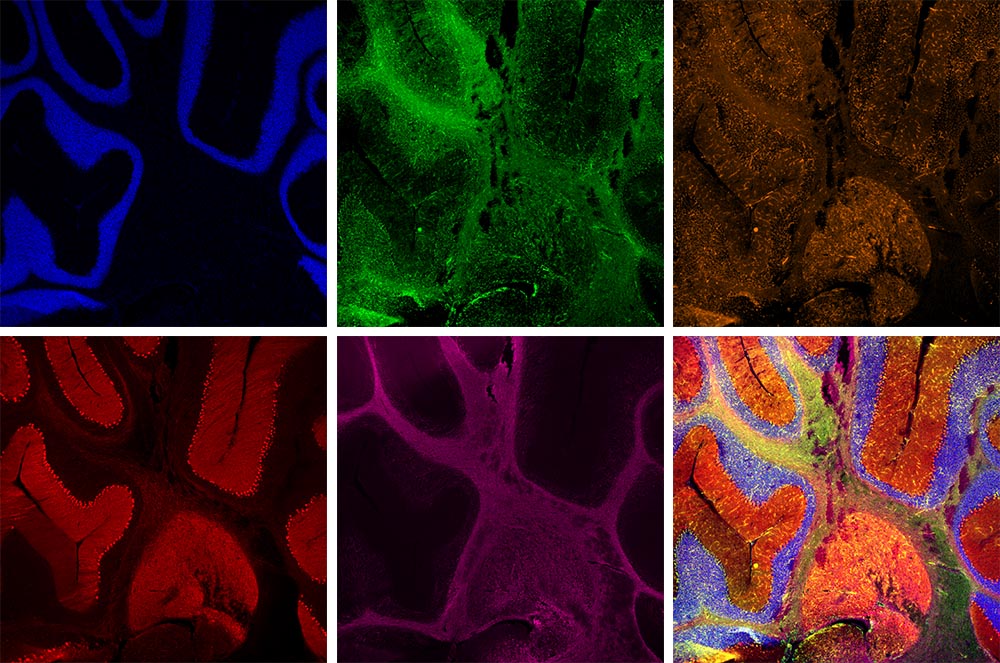 |
|---|
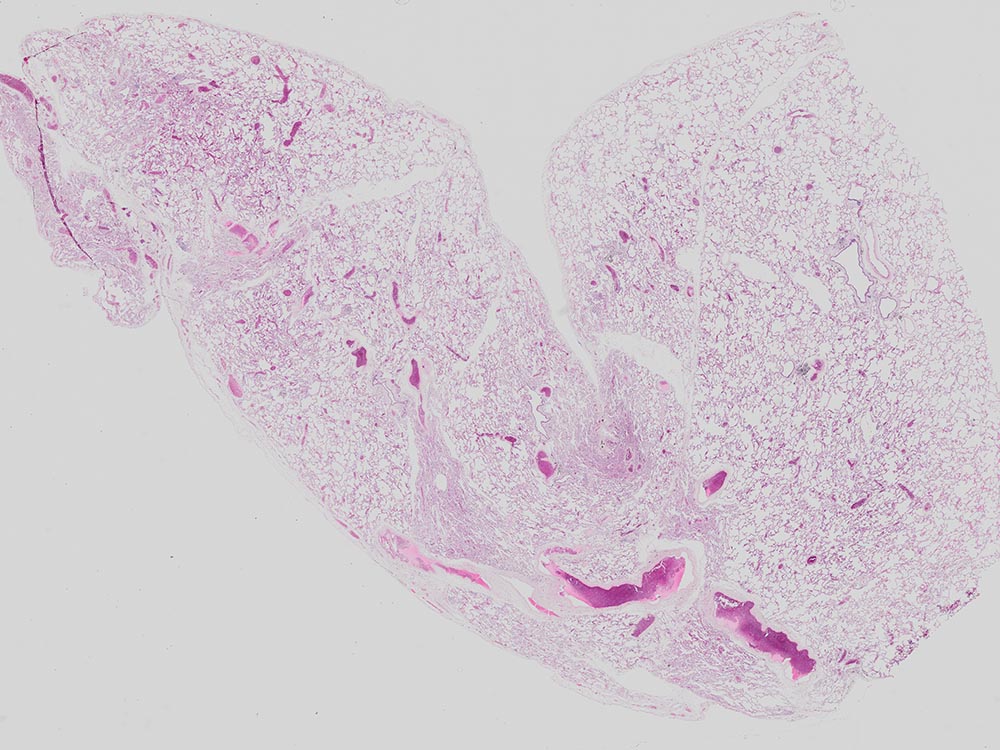 | Assemblage
Image de poumon de souris prise avec un objectif UPLXAPO4X. Coloration : HE. |
|---|
Empilement Z
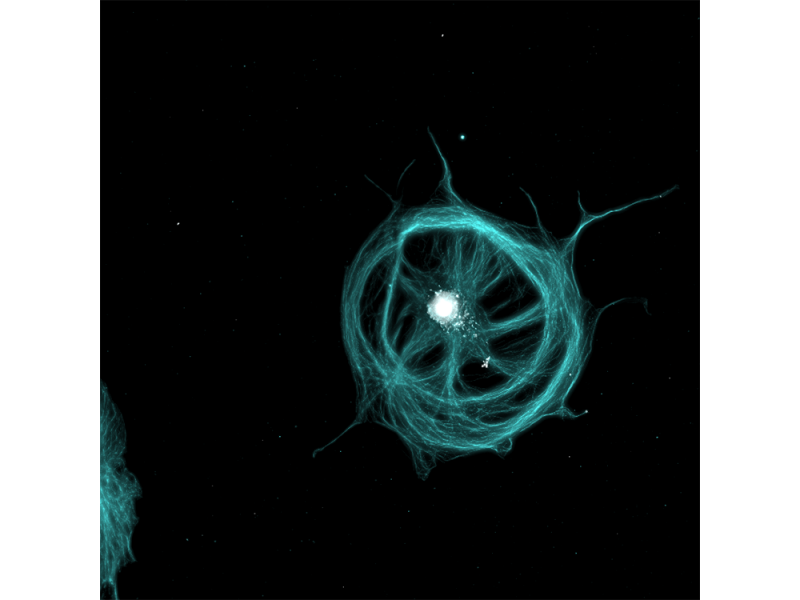
Localisation subcellulaire de la protéine centrosomale kendrine/péricentrine. Données d’images reproduites avec l’aimable autorisation du Dr Kazuhiko Matsuo, Division of Developmental Biology and Anatomy, Department of Anatomy, Kyoto Prefectural University of Medicine. | 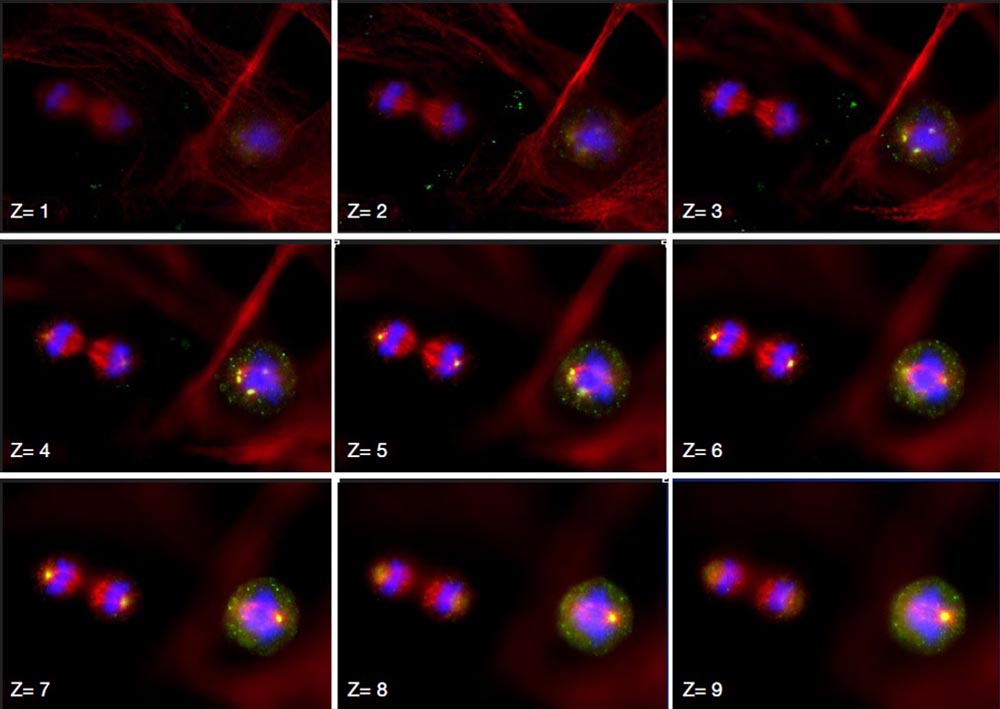 |
|---|
Imagerie à intervalles
- Enregistrez en continu l’évolution d’une cellule vivante ou de toute une culture de cellules au fil du temps.
- Un mécanisme intégré d’isolation contre les vibrations et un incubateur en option assurent une acquisition d’images stable.
- En associant le système à l’unité d’administration de médicament en option, vous pouvez observer la réponse des cellules en temps réel immédiatement après l’administration d’un médicament.
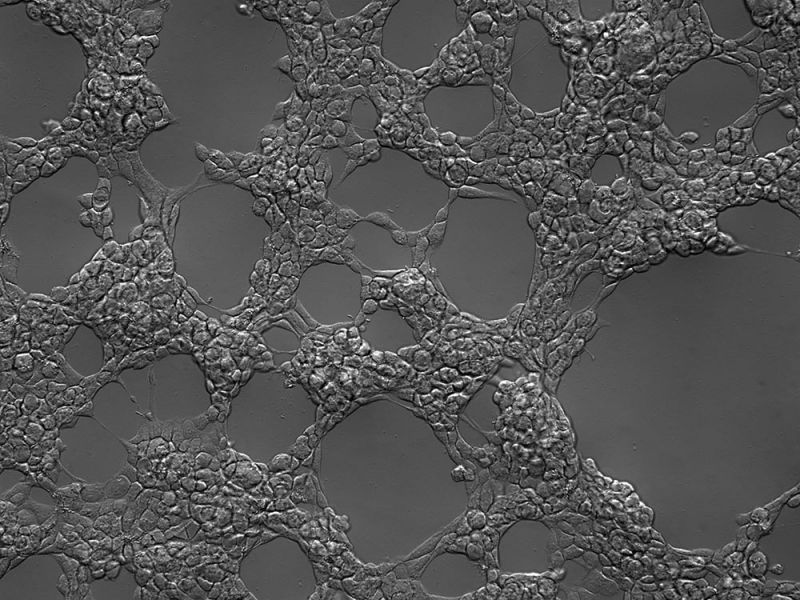
Test de cicatrisation
Imagerie à intervalles d’un test de cicatrisation de cellules endothéliales aortiques humaines (2 jours).
| Ovule de souris fécondéQuatre heures d’observation à intervalles d’un ovule de souris fécondé |
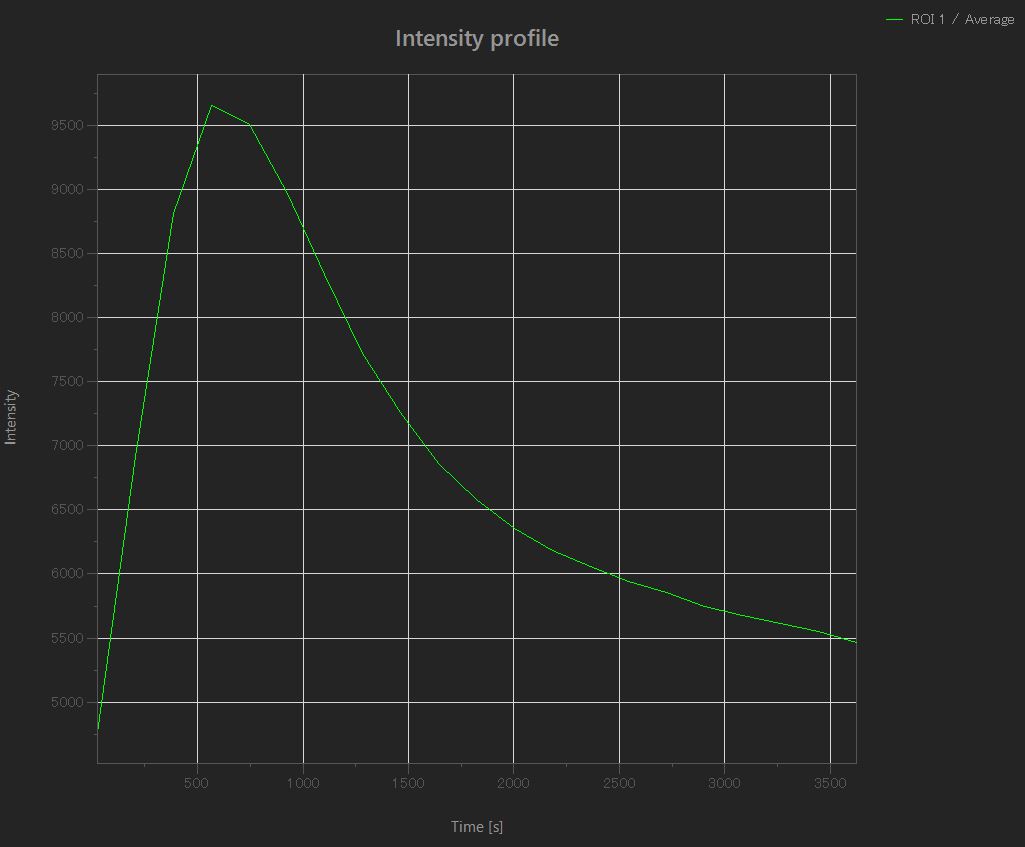
Effets d’un antioxydant sur les mitochondries
Les mitochondries qui sont oxydées (augmentation de l’intensité de la fluorescence) par l’addition de H2O2 sont ensuite réduites (diminution de l’intensité de la fluorescence) par l’effet de l’antioxydant.
|
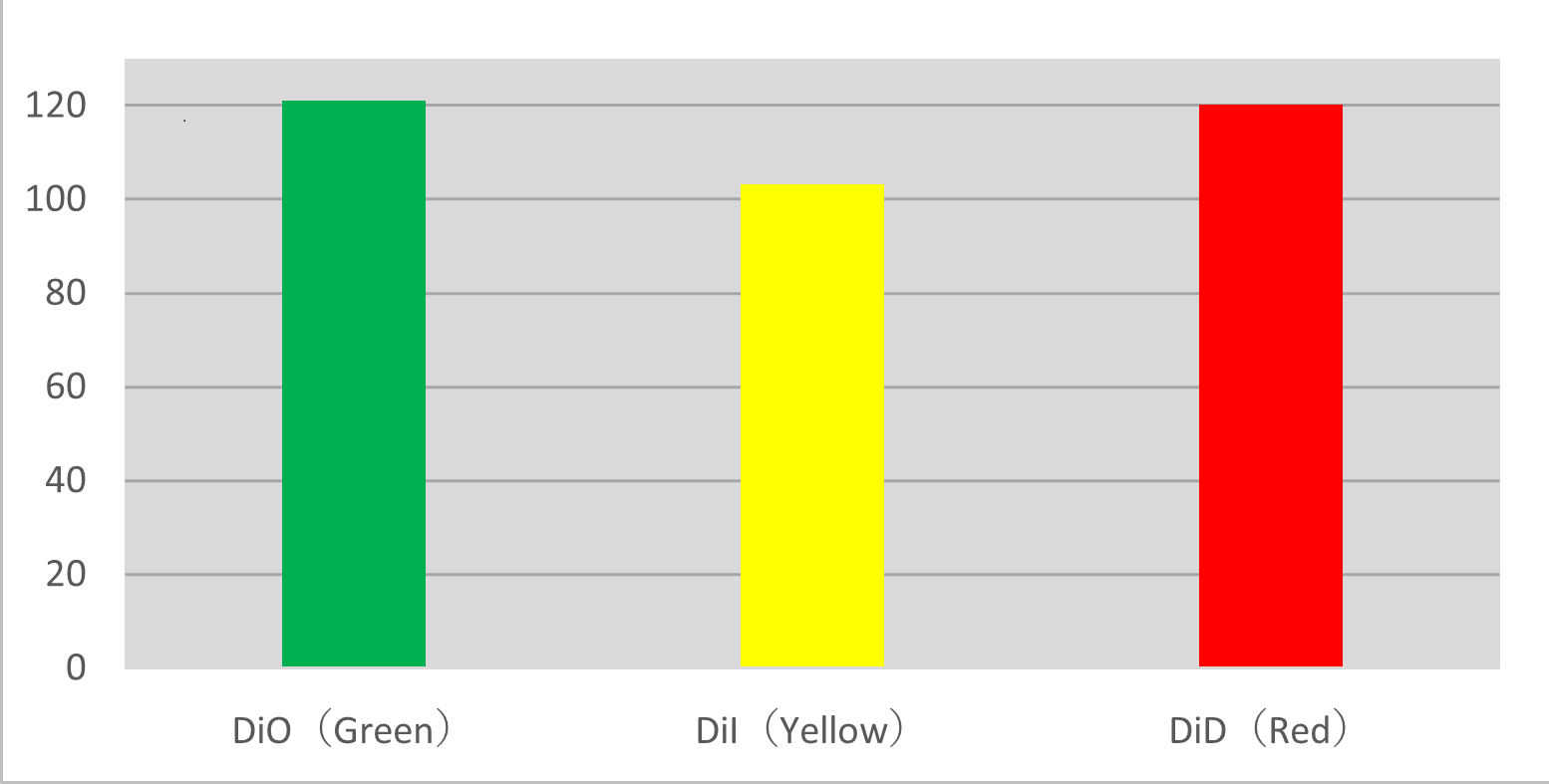
Imagerie multicolore de cellules RBL-2H3 en cours de migration
Trois types de cellules RBL-2H3 traitées ont été mélangés, et leur migration a été observée au moyen d’une imagerie à intervalles multicolore. L’analyse du suivi des cellules a montré que les cellules migraient de façon similaire avec tous les traitements.
|
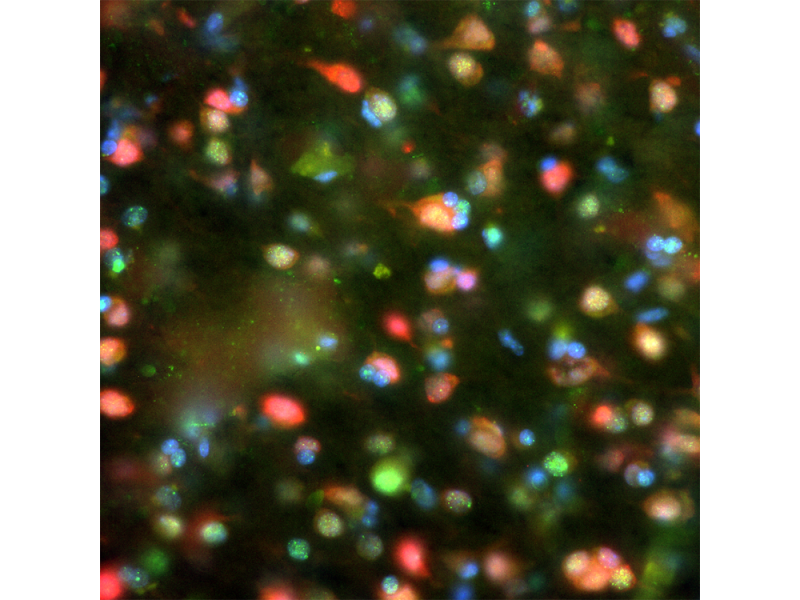
Imagerie de fluorescence
Tubuline et noyau de cellules BSC-1Marquage : immunocytochimie, bleu : noyau de cellule, rouge : tubuline | Colocalisation de NeuN et γ-H2AX dans un cerveau de singeMarquage : immunocytochimie Données d’image reproduites avec l’aimable autorisation de Rui Han, Laboratoire du professeur Xiaojiang-Li, Guangdong-HongKong-Macau Institute of CNS Regeneration, université JINAN. | Pollen de noisetierAutofluorescence, image prise avec un objectif UPLXAPO60X à huile. Traitée avec la déconvolution TruSight. |
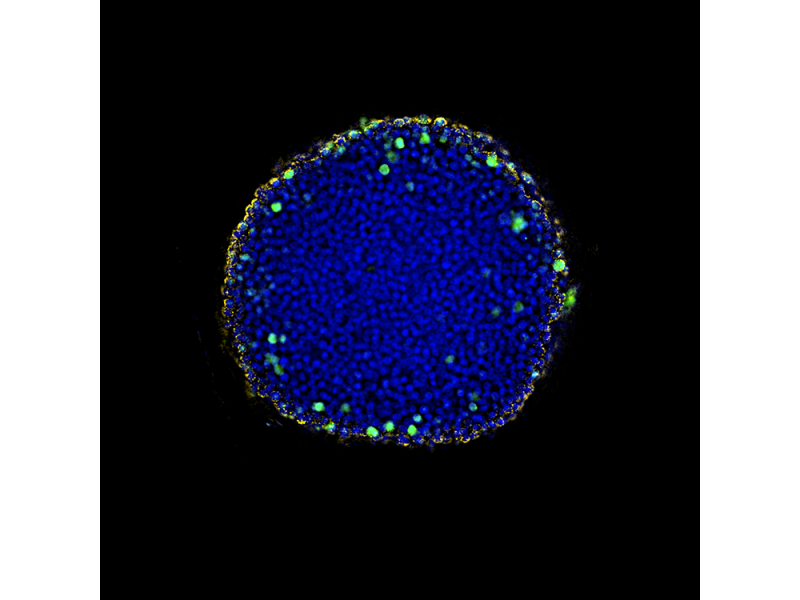
Glande mammaire de souris adulte (Krt14/Krt8)Marquage : immunocytochimie Données d’images reproduites avec l’aimable autorisation de Chunye Liu, Laboratoire du professeur Yi Zeng, Center of Excellence in Molecular Cell Science, CAS. | Tubuline et noyau de cellules BSC-1Marquage : immunocytochimie, blanc : noyau de cellule, cyan : tubuline | Sphéroïde de cellules HeLa clarifié
Marquage : immunocytochimie, bleu : noyau DAPI,
|
Cellules Ptk2Marquage : DAPI, rouge Mitotracker, Acti-Stain 488 |
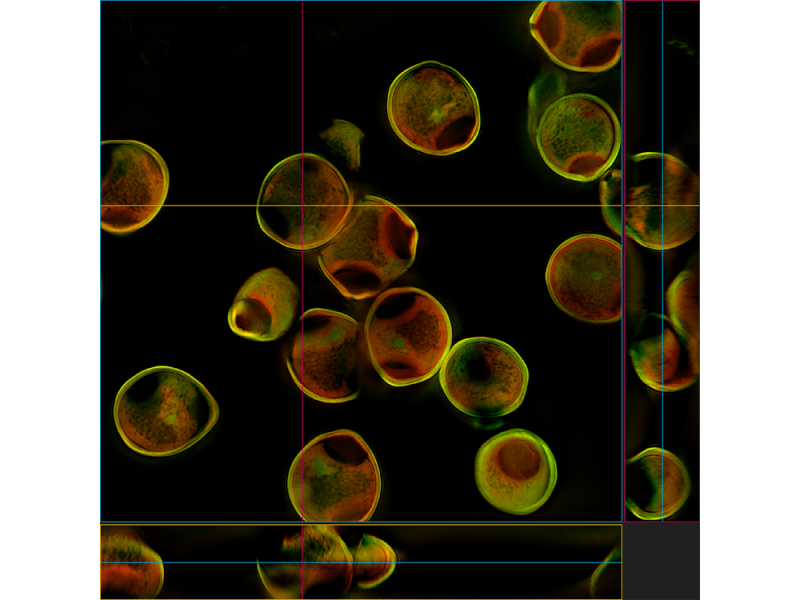
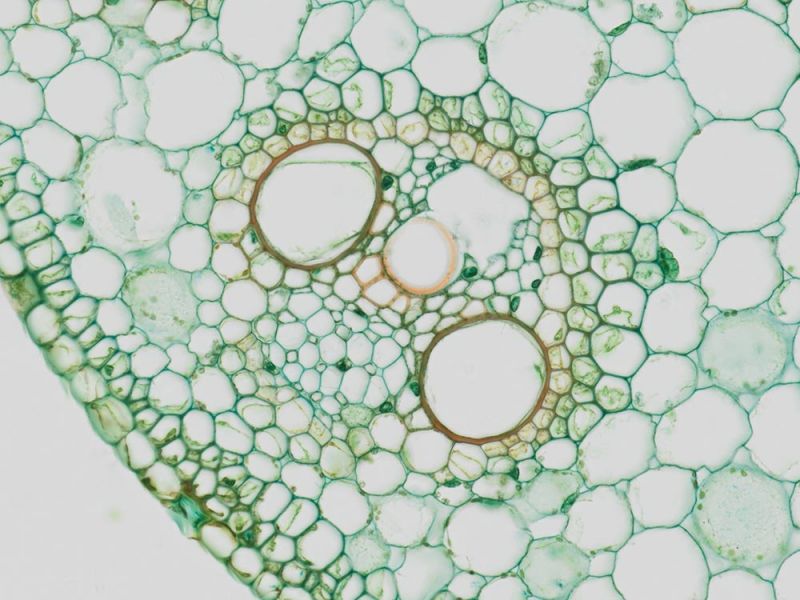
Coupe transversale
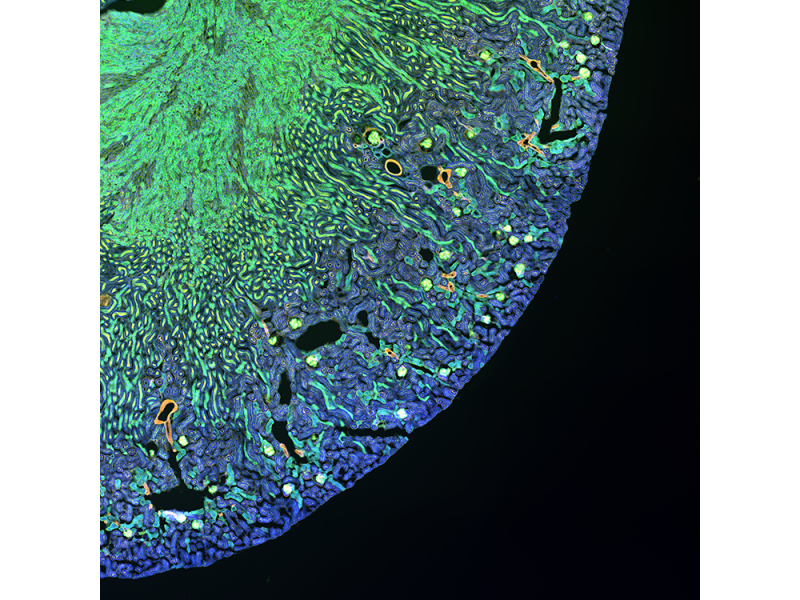
| Rein de sourisWGA Alexa Fluor 488, phalloïdine Alexa Fluor 568, DAPI |
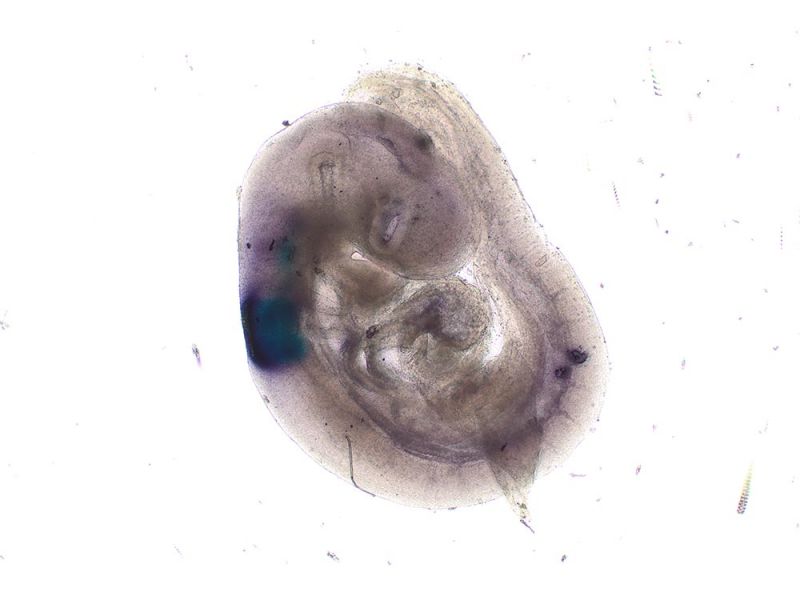
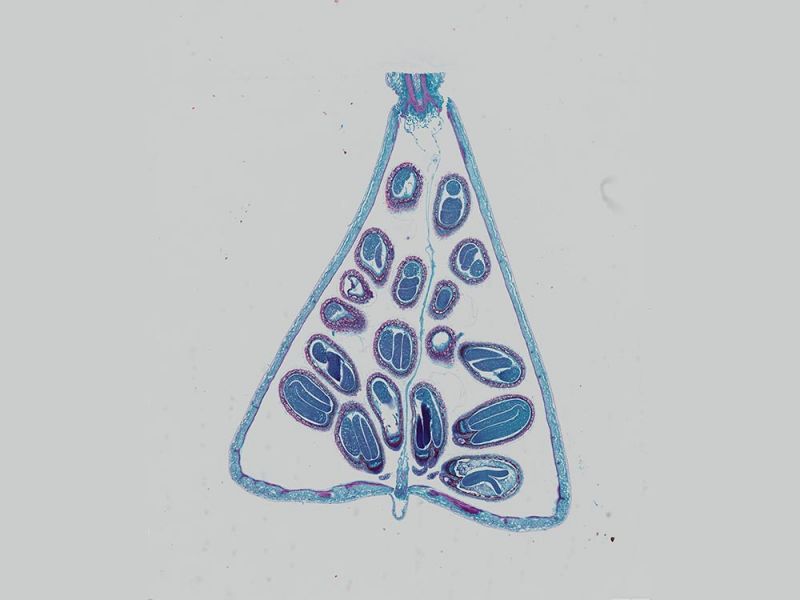
Imagerie en fond clair
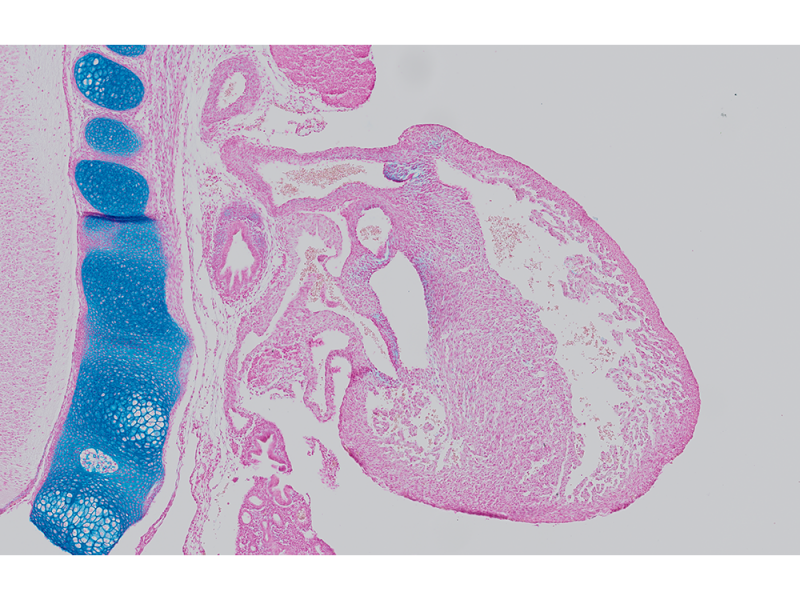
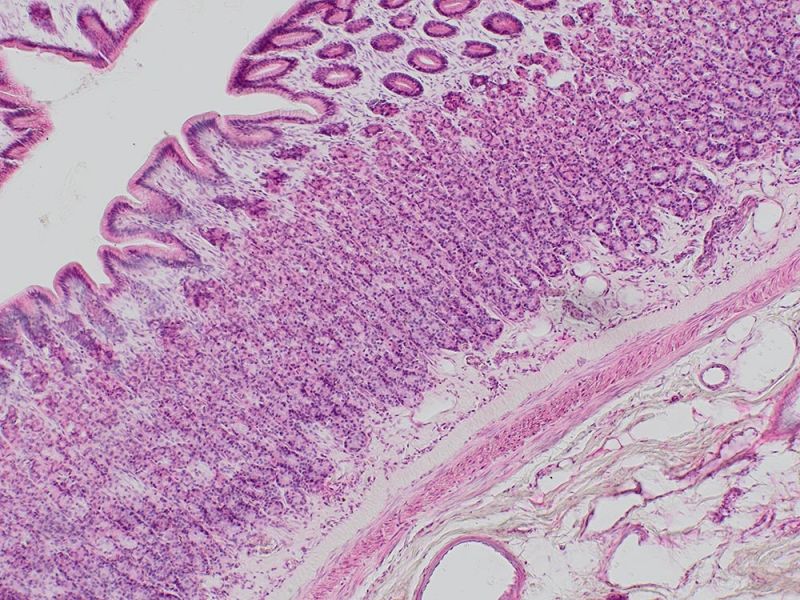
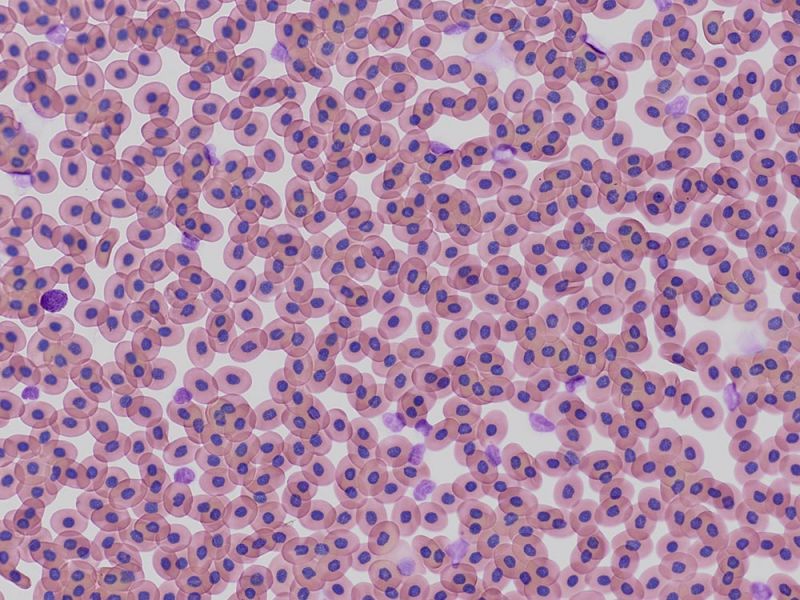
Embryon de souris E15.5 coloré au bleu alcian et au rouge rapide nucléaireDonnées d’image reproduites avec l’aimable autorisation de 1.2.Naoki Takeshita, MD, 1.Professeur Kenta Yashiro, MD, Ph.D., 1.Division of Developmental Biology and Anatomy, Department of Anatomy et 2.Department of Pediatrics, Graduate School of Medical Science, Kyoto Prefectural University of Medicine. | Coupe de côlonColoration : HE Données d’image reproduites avec l’aimable autorisation de Kazuhiko Matsuo, Ph.D, Professeur Kenta Yashiro, MD, Ph.D., Division of Developmental Biology and Anatomy, Department of Anatomy, Kyoto Prefectural University of Medicine. | Cellules sanguines de XenopusColoration : HE |
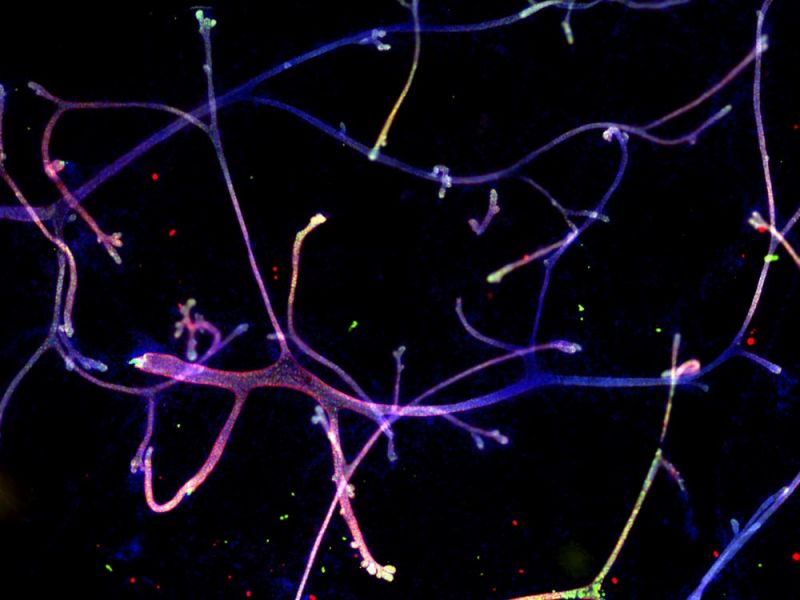
 | Contraste de gradient : voyez votre échantillon sous un nouveau jour
Expression de la protéine mCherry transloquée dans la membrane de cellules HEK293T. Données d’images reproduites avec l’aimable autorisation de Rie Saba, Ph.D., Division of Developmental Biology and Anatomy, Department of Anatomy, Kyoto Prefectural University of Medicine. |
|---|
Vous souhaitez obtenir plus d’informations ?
Sorry, this page is not
available in your country.
Sorry, this page is not
available in your country.