CM20を用いた培養細胞のアッセイ手法:細胞増殖/細胞毒性試験のより簡便かつ正確な測定法を目指して
はじめに
細胞増殖/細胞毒性アッセイは、培養細胞を用いた研究においてもっとも頻繁に行われる試験の一つです。薬剤の処理濃度を検討するための予備試験として欠かせないものであるとともに、がん領域や細胞死領域をはじめとするさまざまな研究分野において、薬剤の効果や安全性を明らかにするために、非常に重要な試験法です。
従来は細胞の増殖特性を定量評価する方法として、代謝活性を指標としたWST-8法やATP法、DNA合成量を指標とするBrdU法やチミジン法等が用いられてきました。これらは簡便性やスループットの点で利点がある一方で、いずれも間接的な評価方法であり、実際の細胞数と相関性がみられない場合があります。また多くの場合、エンドポイントでの評価となり、経時的な変化を捉えることができず、重要な知見を見逃す可能性もありました。
このような背景から、細胞増殖/細胞毒性を直接かつ経時的に評価する方法の開発は、培養細胞を用いた研究分野において非常に重要な課題であると考えます。
実験の概要
オリンパスのインキュベーションモニタリングシステムCM20を用いた細胞増殖・毒性評価の可能性を検証するために以下の二つのアッセイを行い、従来法(WST-8)とCM20の比較を実施しました。
- ヒト肺腺がん A549細胞における抗がん剤 (5-FU) による細胞死アッセイ
- ヒト神経芽細胞腫SH-SY5Y細胞における神経毒 (6-OHDA) による細胞死アッセイ
実験の方法・条件
抗がん剤 (5-FU) によるがん細胞死アッセイ
ヒト肺腺がんA549細胞をマルチウェルプレートに播種し、播種24時間後から5-FU (400 μM) を72時間処理したのち、CM20により1時間おきに撮影および細胞数カウントを実施しました。処理濃度は細胞増殖と細胞死が平衡状態となる濃度とし、コントロールとして5-FU非処理群を設定しました。従来法では処理開始から0, 24, 48, 72時間後にWST-8法により細胞生存率を測定します。
神経毒 (6-OHDA) による細胞死アッセイ
ヒト神経芽細胞種SH-SY5Yをマルチウェルプレートに播種し、播種24時間後から6-OHDA (60 μM) 処理を24時間処理したのち、CM20により1時間おきに撮影および細胞数カウントを実施しました。処理濃度は急速に細胞死を誘導する濃度とし、コントロールとして6-OHDA非処理群を設定しました。従来法では処理開始から0, 6, 12, 24時間後にWST-8法により細胞生存率を測定します。
結果
抗がん剤 (5-FU) によるがん細胞死アッセイ
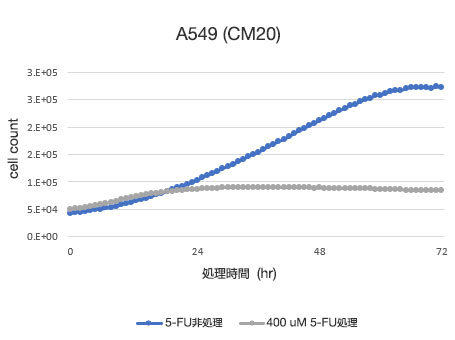
図1 5-FU処理後のA549細胞画像
上段:5-FU非処理、下段:400 μM 5-FU処理
5-FU非処理条件では培養時間に比例して細胞数が増加し、処理72時間目では100%コンフルエントとなる様子がみられました。5-FU処理条件では、処理24時間後から細胞密度が大きく変化せず、処理時間に比例して死細胞が増加する様子が観察されました。
|
|
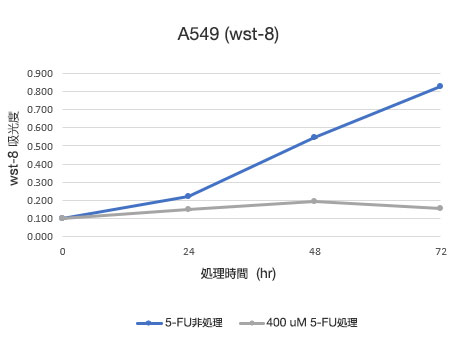
図2 A549細胞生存率定量結果
左図:CM20により定量した細胞数、右図:従来法 (WST-8) により定量した細胞数
CM20による解析によって、5-FU非処理条件ではシグモイド曲線状に細胞数が増加する一方、5-FU処理条件では、処理24時間後から細胞数が大きく変化せず、細胞増殖と細胞死が平衡状態にあることが示されました。これらの結果は細胞観察の結果と一致しています。また、従来法 (WST-8法) による解析結果とも一致しました。
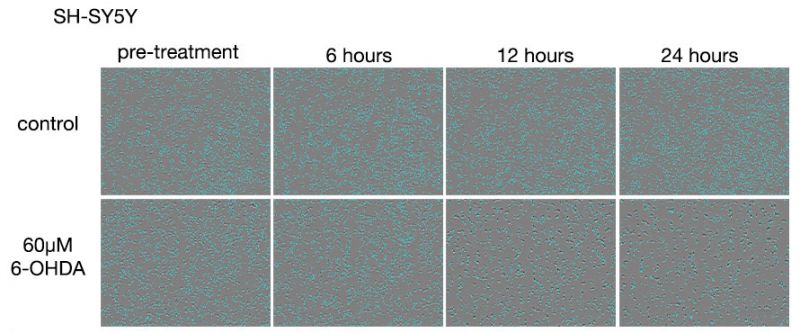
図3 6-OHDA処理後のSH-SY5Y細胞画像
上段:6-OHDA非処理、下段:60 μM 6-OHDA処理
6-OHDA非処理条件では24時間でわずかな細胞数増加がみられます。6-OHDA処理条件では、処理6時間の段階で細胞数の減少がみられ、処理12時間目で大半の細胞が細胞死を起こす様子が観察されました。
|
|
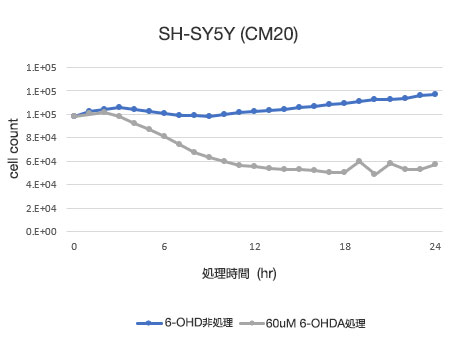
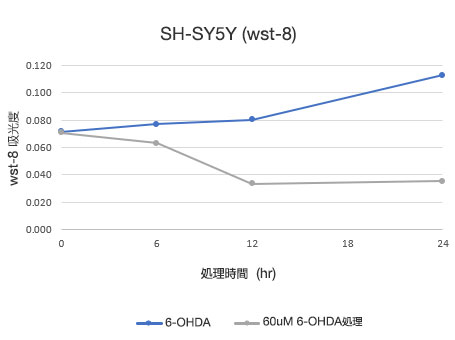
図4 SH-SY5Y細胞生存率定量結果
左図:CM20により定量した細胞数、右図:従来法 (WST-8) により定量した細胞数
CM20による解析によって、6-OHDA非処理条件では24時間でわずかに細胞数が増加する一方、6-OHDA処理条件では処理3時間目から細胞数が減少し、処理12時間目以降は大きな細胞数変化がみられず、処理12時間程度でほぼ全ての細胞が死滅したことが示されました。これらの結果は細胞観察の結果と一致しています。また、従来法 (WST-8法) による解析結果とも一致しました。
考察
がん細胞における抗がん剤作用解析や神経系細胞における神経毒性解析において、CM20によるモニタリングにより、画像観察や従来法 (WST-8法) とほぼ同一の試験結果を得ることができました。
CM20で評価することのメリット
CM20による評価のメリットとしてはまず、そのサンプリング間隔の短さにより経時的変化の詳細を知ることができる点があげられます。たとえばSH-SY5Yを用いた試験では、およそ12時間の6-OHDA処理によってほぼ全ての細胞が細胞死を起こしたことが分かります。一方、エンドポイントアッセイではこのような情報は得ることができません。
同時に、経時的データを1枚のプレートだけで取得可能な点もCM20のメリットの一つです。従来法では測定時点ごとにプレートを用意する必要があり、測定時点に比例して作業量が増加するとともに、解析可能な枚数にも限度がありました。また、従来法では測定時点が増えるとともにデータ解析も煩雑となりますが、CM20では自動的に多点観察が可能で、結果のグラフも自動的に出力されます。
さらに、CM20では、解析期間を通して細胞の画像が記録されるため、細胞増殖の様子や形態変化も後から振り返ることができ、そこから得られる情報も多いという利点もあります。従来法では数点の解析によって適切な処理時間を推測し、再試験する必要があるような場合でも、CM20を用いた解析では、1回の試験で適切な処理時間を後から判定し、その処理時間内のデータを抽出することが可能です。
山口先生からのコメント
CM20を使用してまず感心したのが、その細胞数カウントの的確性です。モニター上にCM20が認識した細胞が1つ1つ区別して表示されますが、初期のパラメータ設定を適切におこなう事で再現性高く定量評価ができる評価法であることを確認できました。従来の間接的な細胞数測定法と異なり、標識等が一切不要で細胞への影響が抑えられると同時に信頼性の高い細胞数評価法といえると思います。
また、プレート一枚で多数のタイムポイントのデータをほぼ自動的に取得できるので、作業量を大きく減らせるとともに、重要なデータを見逃しにくいという点も魅力的に感じました。たとえばエンドポイントでの解析では、細胞が全滅あるいはコンフルエントに達して差がみられない場合でも、途中の段階では薬剤の種類や濃度による差が出ている可能性があります。このような場合、CM20を用いることで処理時間を検討する手間や時間を大幅に省略することができ、研究の効率化および高速化が可能であると感じました。
本アプリノートにご協力賜りました先生
株式会社エーセル 研究主幹 博士(農学)
山口 貴大 先生
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。