非染色オルガノイドのイメージングデータの自動解析
オルガノイドの薬物反応を測定するための効率的な非染色画像のバッチ解析ワークフロー
はじめに
スフェロイドやオルガノイドなどの3D in vitroモデルは、従来の2D細胞培養モデルよりも、生理学的により適切な微小環境を研究者に提供します。しかし、オルガノイドの反応を効率的に測定するためのワークフローを作成することは容易ではありません。
本研究では、イメージングソフトウェアcellSensのマクロ機能を使用し、非染色オルガノイドのデータ用にバッチ画像解析のワークフローを作成しました。そして、その結果をCellTiter-Glo 3D細胞生存率アッセイと比較し、解析速度を評価するとともにオブジェクトの検出と測定における精度と感度を判定しました。
アプリケーションワークフロー

利点
- 非染色オルガノイドのイメージング
- 自動化された画像処理、セグメンテーション、測定、データエクスポート
- 薬物スクリーニングプロセスを迅速化するバッチ解析
方法
オルガノイドの培養
大腸がん患者由来のオルガノイドをCostar 96ウェルプレートで培養しました。ウェルのいくつかにスタウロスポリン(staurosporine:ST)を添加し、添加に対するオルガノイドの反応を比較しました。
イメージング
オルガノイドのイメージングは、オリンパスFV3000共焦点レーザー走査型顕微鏡の透過検出器を使用しました。近赤外線レーザー(640 nm)と4倍の対物レンズを使用して、透過画像を取得しました。オルガノイドは様々なZポジションに存在するため、5umのZステップサイズでZスタック画像を取得しました。
cellSensのマクロ機能を用いた画像解析
cellSensのマクロ機能を用いた画像解析に必要なのは、マクロの記録とバッチ解析の実行の2ステップのみです。
1. マクロの記録
マクロマネージャーでは、複数のステップを一つのコマンドとして記録することができます。この解析では、以下のステップを記録しました。
- 検出チャンネルの選択:明視野画像を解析するための透過検出チャンネルを選択しました。
- ソーベルフィルターの適用:「エッジ検出フィルター」として、ソーベルフィルターを適用しました。
- EFI処理:2Dプロジェクションを作製するため、焦点拡大画像(Extended focus image:EFI)処理を適用しました。
- セグメントの実施:オルガノイドのセグメントには自動閾値設定を適用しました。検出されたオルガノイドの空領域を埋めるために穴埋めオプションを使用しました。
- メディアンフィルターの適用:オブジェクトのマスクのエッジを平滑化して小さなノイズを除去するため、メディアンフィルターを適用しました。
- カウントアンドメジャーの実施:オルガノイドの数と形態学的特徴を測定しました。特定のオルガノイド集団の選択には、サイズフィルターが使用可能です。
- ワークブックにエクスポート:測定値をスプレッドシートにエクスポートしました。

図1:マクロのプロセスとして記録したcellSens画像解析のステップ
2. バッチ解析の実行
マクロ機能のバッチ実行モードを使用し、指定したフォルダ内の複数の画像に対して記録したマクロを実行しました。解析結果は、スプレッドシートに自動的にエクスポートされます。
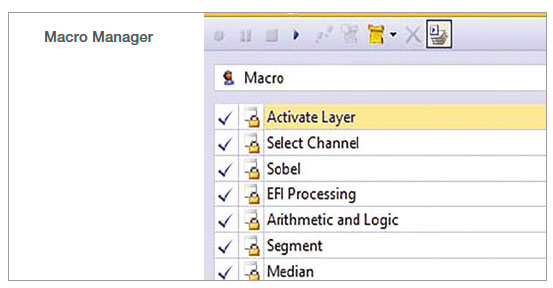
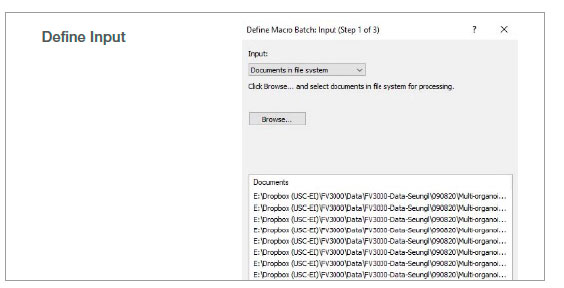
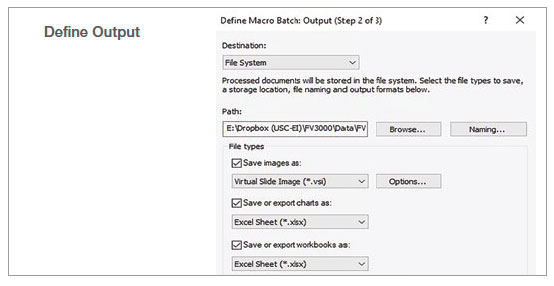
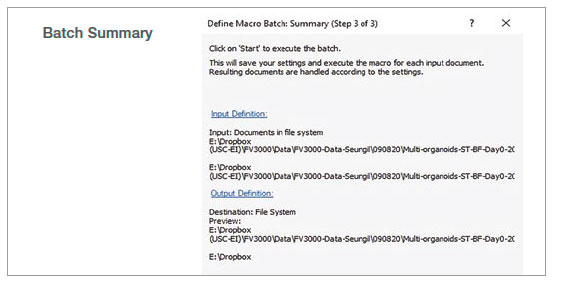
図2:記録したマクロプロセスを使用したバッチ解析のステップ
CellTiter-Glo 3D生存率アッセイ
測定日ごとに別個の96ウェルプレートにオルガノイドを用意し、CellTiter-Glo 3D試薬を各ウェルに添加、マルチウェルプレートリーダーを使用して細胞生存率シグナル(ATP量)を測定しました。
結果
オルガノイドのサイズ
薬剤非添加のオルガノイドの培養では、オルガノイドのサイズに関連するパラメーター(面積、外周、半径)が経時的に増加しました。0.1 μMのST添加によって、細胞およびオルガノイドの死が誘発されました。ST添加のオルガノイドでは、オルガノイドの成長が完全に抑制され、オルガノイドのサイズの著しい増加は見られませんでした。
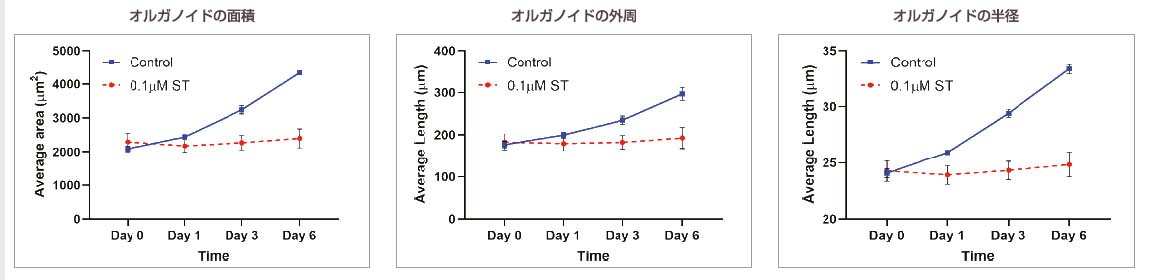
図3:対照:n=370、0.1 μM ST:n=234。非添加オルガノイドと0.1 μMのST添加オルガノイドで比較したオルガノイドのサイズに関連するパラメーターの経時的変化。
オルガノイドの形態
オルガノイドの形態に関連するパラメーター(形状係数および真円度)を測定したところ、形状係数値はST添加オルガノイドで高く、これらのオルガノイドはより丸い形状を持つことが示唆されました。非添加オルガノイドで形状係数値が低いことは、これらのオルガノイドがより非対称であり、かつ分岐した形状を持つことを示唆しました。非添加オルガノイドとST添加オルガノイドの真円度値に著しい変化は見られませんでした。
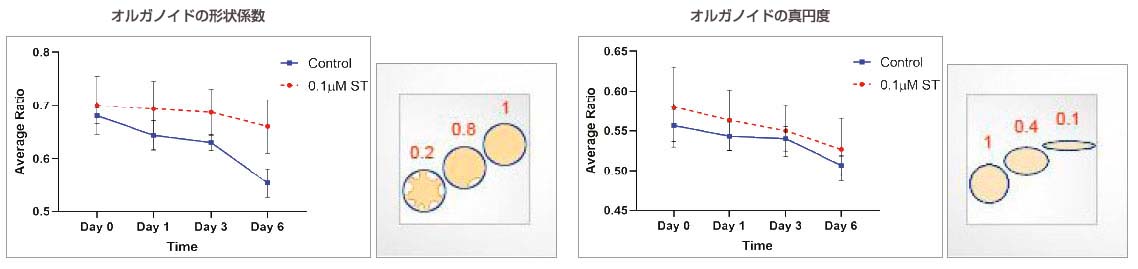
図4:オルガノイドの形態に関連するパラメーターの経時的な測定値
細胞生存率アッセイとの比較
オルガノイドの成長をCellTiter-Glo 3Dとイメージングを用いて比較測定しました。cellSensの解析(面積)では、オルガノイドの成長における差が早い段階で見られました。イメージング法では時間が経過しても同じプレートを使用するため、cellSensの定量の方が各データポイントの変動が小さくなりました。細胞生存率アッセイは、エンドポイントアッセイであり、各測定時点で複数のプレートを使用するため、バラつきが大きくなります。

図5:細胞生存率アッセイとイメージングベースのcellSens解析との比較
結論
イメージングソフトウェアcellSensのマクロ機能を用いることで、非染色データの2Dバッチ画像解析プロセスを確立できます。今回のケースでは、オブジェクトの検出と測定における精度と感度はcellSensの方がCellTiter-Glo 3D細胞生存率アッセイよりも高いことが検証されました。さらに、CellTiter-Gloでは単一のパラメーターを読み出すのに対し、cellSensはイメージングデータを使用することで複数パラメーターによる解析が可能です。また、プログラミング言語の知識がなくても、マウスを数回クリックするだけで解析が自動実行でき、効率的なワークフローを簡単に構築することができます。
著者
Seungil Kim、Brandon Choi[Lawrence J. Ellison Institute for Transformative Medicine、University of Southern California(南カリフォルニア大学付属ローレンスJエリソン改革医療研究所)、カリフォルニア州ロサンゼルス]
Shohei Imamura(オリンパス・アメリカ)
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。