ライブセルイメージング・細胞生物・分子生物学分野での発光イメージング活用事例
インデックス
1.Emerald Luc (ELuc)によるペルオキシソーム局在の観察
細胞内局在の様子を鮮明に捉えることが可能
(本アプリケーションノートは旧・発光イメージングシステムLV200で取得したものです)
発光イメージングシステムLV200を用いて、ルシフェラーゼのペルオキシソーム局在を観察しました。また、20倍から100倍までの対物レンズを用いて、局在の解像度の違いや明るさの変化も同時に検証しました。
ペルオキシソーム局在タンパク質発現ベクターとして、高発光型ルシフェラーゼEmerald Luc(ELuc; 東洋紡績(株))のC末端にペルオキシソーム局在配列SKLを導入して、SKL-Luciferase発現ベクター(ELuc/SKL)を作製しました。Φ35mm-ガラスボトムディッシュに播いたHeLa細胞にELuc/SKLベクターをトランスフェクションして一晩培養後、ルシフェリン(最終濃度500μM)を加え、LV200にセットし、37℃下で撮影を行いました。[対物レンズ倍率:20倍、40倍、60倍、100倍、露出時間:5分、binning:なし、CCDカメラ:ORCA-AG(浜松ホトニクス(株)]
対物レンズの高倍率化に伴い解像度が向上し、ルシフェラーゼのペルオキシソーム局在を確認することができた(図1※1)。その反面、細胞毎の輝度は低下しました。これは、明るさがレンズの総合倍率の2乗に反比例ことに起因します。そのため、高い解像度を必要とする細胞内局在の観察には、40~100倍の高倍率の対物レンズを使用し、広い視野で多くの細胞の発光量変化を定量解析する場合には、10~20倍の低倍率の対物レンズを使用するという様に、目的に応じた対物レンズの使い分けが重要となります。
従来の一般的な発光取得技術ではディッシュ全体の発光強度データしか得られませんでした。しかしLV200では、鮮明な発光画像を取得できるため、シングルセルレベルの発光強度変化に加え、細胞内小器官における発光強度変化も同時に解析できます。細胞内局在が観察できれば、細胞内局在データとレポーターアッセイを組み合わせた実験や、マルチカラーによる細胞内小器官染分け、細胞内輸送に関する研究などが可能となります。
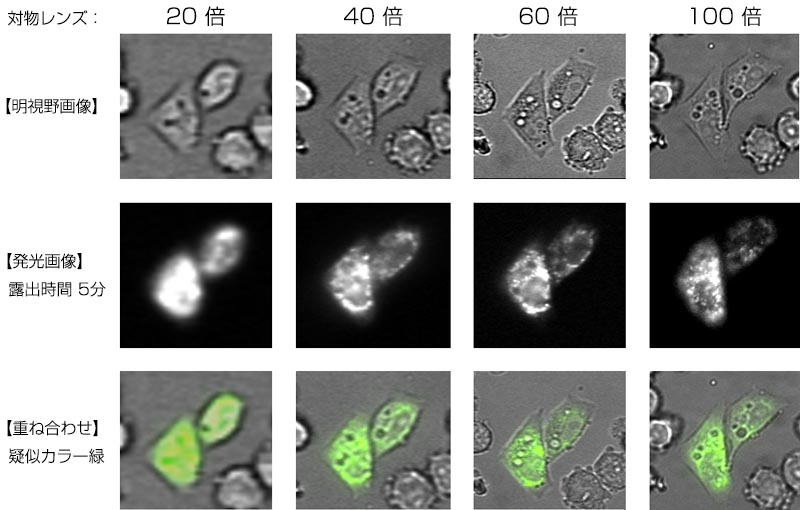
※ 20倍の画像は拡大しているため、実際の見え方とは異なります。
図1.ペルオキシソーム局在※1
2.蛍光と発光検出を組み合わせたイメージング
蛍光と発光検出を組み合わせた解析を行うことで、GFPマーカーを用いた遺伝子導入細胞の同定、刺激による動態変化と転写因子の遺伝子発現を同一細胞内で観察することが可能
(本アプリケーションノートは旧・発光イメージングシステムLV200で取得したものです)
発光イメージングシステムLV200は励起光照射および蛍光検出時にフィルターによる分光機能を備えているため、発光イメージングに加えて簡易的な蛍光イメージングも行うことが可能です。本検討では、発光観察と蛍光観察を組み合わせた以下の実験を行いました。
核局在GFPと細胞質発現ルシフェラーゼの観察
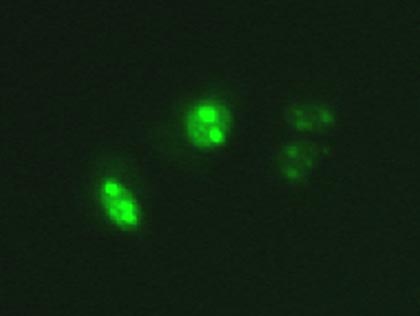
HeLa細胞にpEGFP-NLSおよびpGL4-controlベクターをトランスフェクション後、分光フィルターを用いてGFP観察後、発光観察のためルシフェリン(最終濃度 100μM)を加えて撮影を行った(対物レンズ: 60倍、露出時間: 1分、binning: 1×1 、CCDカメラ: ORCA-II-ERG(浜松ホトニクス(株))。GFP、ルシフェラーゼ共に目的の場所に局在していることが分かる(図2※1)。ルシフェラーゼレポーターアッセイベクターをGFPなどの蛍光タンパク質で標識をしておき、GFPをトランスフェクション時のマーカーとして使用することで、確実に遺伝子導入された生細胞について継続的な遺伝子発現モニタリングを行うこともできます。
核局在EGFP |
細胞質内 |
明視野画像との重ね合わせ |
図2. GFPとルシフェラーゼ発現の局在観察※1
PKCθ (Protein Kinase C θ) 局在とNF-κB遺伝子発現変化観察
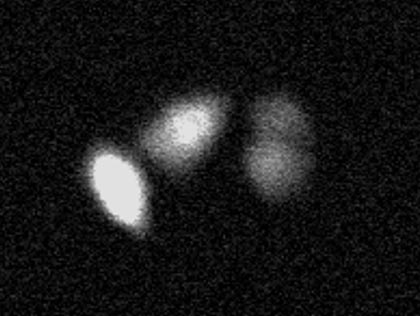
プロテインキナーゼの一種であるPKCは、細胞内情報伝達系の主要な情報伝達因子として、転写調節、細胞増殖、分化の制御などに関与していると考えられています。pPKCθ-EGFPおよびpGL4-NF-κB発現ベクターをトランスフェクションしたHeLa細胞に、PMA (最終濃度 5ng/ml)刺激後、分光フィルターを用いてGFP発現の観察を行いました(図3※1)。
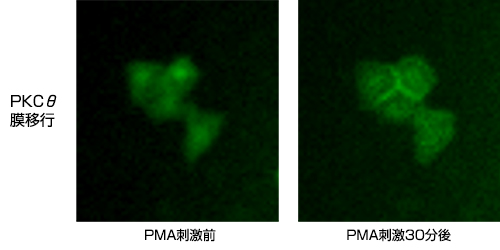
図3. PMA刺激後のPKCθ局在変化観察※1
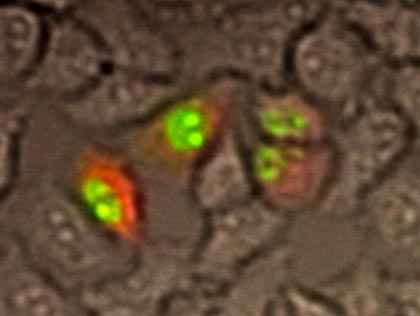
PMA刺激によりGFP標識PKCθが細胞膜に移行している様子が分かります。転写因子NF-κBに関して経時的に発光画像の取得を行った後、数値化を行った(図4※1、図5※1)。PMA刺激後、NF-κB遺伝子発現が次第に高くなり、8時間ほどで最も発現が高くなっている様子が分かります。(ルシフェリン濃度 100mM、対物レンズ: 40倍、binning: 1×1 、CCDカメラ: ImagEM(浜松ホトニクス(株))、露出時間: 10分、15分間隔で10時間撮影)。
従来の生細胞におけるシグナル伝達経路の解析では、分子挙動について蛍光タンパクを指標としたプローブにより検出し、シグナル伝達に関与する転写因子群の解析については、細胞を破砕した状態で別途プロモーターアッセイ等を行うのが一般的でした。これまでは上記のように複数の実験手法を組み合わせて解析を行っていましたが、発光イメージングシステムを用いて、シグナル伝達経路上流の分子動態を蛍光検出し、定量性の高いルシフェラーゼを下流の転写因子発現モニタリングの指標として用いることで、同一細胞内におけるシグナル伝達カスケードについて、安定的な解析を行うことが可能となります。
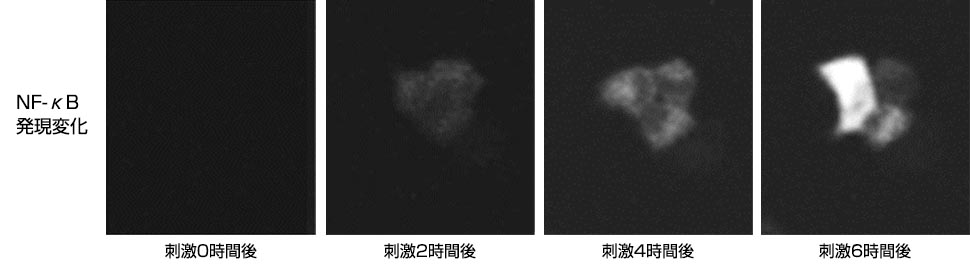
図4.PMA刺激後のNF-κB遺伝子発現変化観察※1
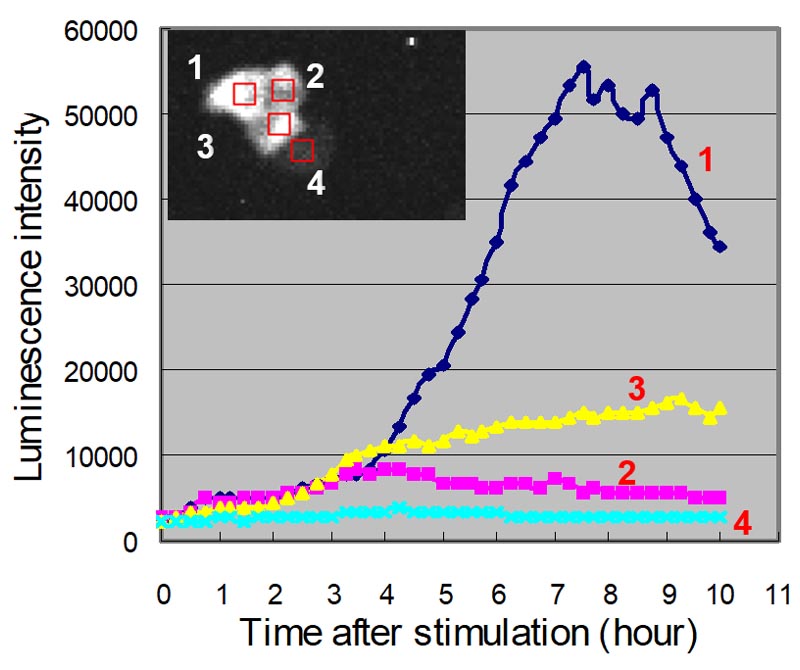
図5.PMA刺激後のNF-κB遺伝子発現変化※1
3.発光イメージングによるモデル植物の観察
シロイヌナズナの根における細胞種特異的な発光シグナルを観察
(本アプリケーションノートは旧・発光イメージングシステムLV200で取得したものです)
高等植物の分子遺伝学研究において用いられるシロイヌナズナの根は「透明で観察しやすい」、「細胞の種類が少ない」、「細胞系譜を容易に追跡できる」などの特徴を持つことから、植物の形態形成や刺激応答などの現象を細胞レベルで詳細に解析することができます。また、蛍光タンパク質や発光タンパク質を利用することで、根の細胞における分子レベルの活性を生きたまま観察することも可能です。
本検討では、発光遺伝子を持つジーントラップ系統と発光イメージングシステムの組み合わせにより、シロイヌナズナの根における細胞レベルの遺伝子発現を観察することができたので、ここに紹介します。
ジーントラップ系統は、ゲノム上のランダムな位置に発光遺伝子が挿入されており、挿入位置近傍の転写制御配列の影響を受けて様々なパターンで発光タンパク質が合成されます。発光タンパク質由来の発光シグナルのパターンを観察することで、ゲノム上で発光遺伝子の近傍に存在する遺伝子の発現パターンを推測することが可能になります。
複数のジーントラップ系統を観察して、2つの独立した系統(035-02、046-08)で根の細胞種特異的な発光パターンが観察されました。
035-02系統を発光イメージングシステムLV200で観察したところ根の最外層の細胞で発光シグナルが強いように見える(図6A)。この事から発光遺伝子の近傍に存在する遺伝子が、根の最外層に強く発現していることが推測できます。046-08系統をLV200で観察したところ、根端の維管束前駆細胞で強い発光シグナルが観察された(図6B)。この事から発光遺伝子の近傍に存在する遺伝子が、維管束前駆細胞に強く発現していることが推測できます。
以上のように、LV200を用いて根の細胞特異的な発光シグナルが観察できました。この観察結果を基にした近傍遺伝子の機能解析や発光パターンを指標にした細胞レベルの形態形成や刺激応答などの研究が進展することが期待されます。
参考文献
1) Yoshiharu Y Yamamoto et al., Plant J. 35, 273-283 (2003)
観察に用いたジーントラップ系統は、理化学研究所植物科学研究センター植物ゲノム機能研究グループで作製されたものです。
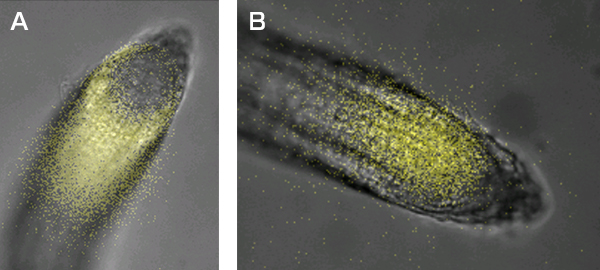
図6.シロイヌナズナの根で細胞特異的に発光シグナルを示す系統
Aは035-02系統。Bは046-08系統。各個体は、発芽後3日~7日に2.5mMルシフェリンをスプレーして、その後撮影しました。カメラは浜松ホトニクス(株)社製のCCDカメラImagEMで、発光画像撮影時の条件はbinning:1x1、EMゲイン:255で全ての撮影時で共通です。AはLV200を用い、対物レンズは60倍で発光画像撮影時の露出時間は3分です。BはLV200を用い、対物レンズは60倍で発光画像撮影時の露出時間は20秒。撮影後に、明視野画像に対して、発光画像のシグナルを黄色の擬似カラーにして重ね合わせました。
※1 HeLa細胞は医学研究で最も重要な細胞株の一つで、科学の発展に偉大な貢献をしました。しかし、この細胞の元となったヘンリエッタ・ラックス(Henrietta Lacks)さんの同意が得られていなかった事実を認識しなければなりません。HeLa細胞の使用は、免疫学や、感染症学、癌研究などにおける重要な発見に貢献しましたが、同時に医学における個人情報保護や倫理についての重要な議論も引き起こしました。
ヘンリエッタ・ラックスさんの生涯と現代医学への貢献における詳細は、以下にアクセスしてご覧ください。
http://henriettalacksfoundation.org/
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。