FV3000を用いた血管網を備えたオンチップ腫瘍モデルの観察:経血管的な薬剤投与モデルとしての医薬品開発への応用
腫瘍組織は、活発な活動を支えるために周囲から血管を呼びこむことが知られています。腫瘍組織内に誘導された血管は、腫瘍のライフラインとして機能し、腫瘍の活動を支える腫瘍微小環境の重要な役割を担います。従来、腫瘍への薬剤の応答評価にスフェロイドモデルを使用してきましたが、腫瘍微小環境で重要な血管と、その血管内の流れを再現できていませんでした。
今回の研究では、マイクロ流体デバイス上に作成したスフェロイド内に血管を誘導して腫瘍組織モデル内に流れる血管を構築し、血管の流れを利用した薬剤投与の効果を測定しました。
血管網を持つ流体デバイス内の腫瘍スフェロイドを三次元的に観察
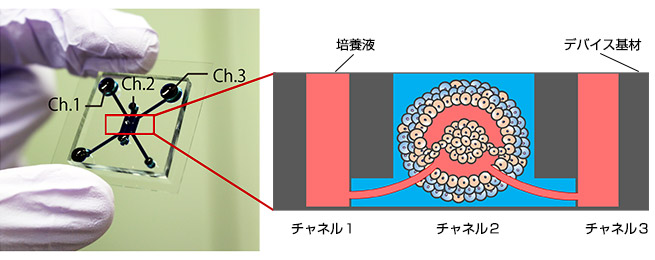
図1:マイクロ流体デバイスと腫瘍モデル
(左)マイクロ流体デバイスの写真 (右)血管生成した腫瘍モデルの模式図
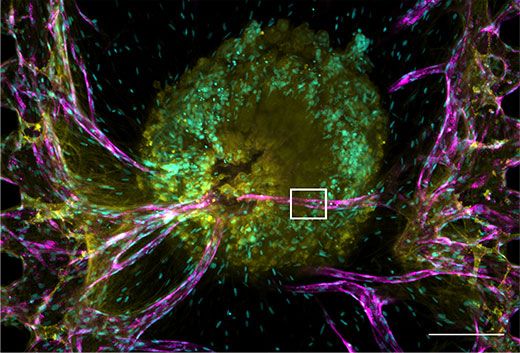
本研究では、マイクロ流体デバイス内にヒト乳腺癌細胞(MCF-7)を含むスフェロイドとヒト臍帯静脈内皮細胞(HUVEC)を共培養することで、血管網を含む腫瘍微小環境を再現しました。確認のため、共焦点顕微鏡FV3000RSを用いて、マイクロ流体デバイス上の腫瘍スフェロイドとその血管の三次元観察を行いました。今回のような厚みのあるサンプルの深部を撮影しようとするとレーザー強度が必要ですが、細胞へのダメージが生じたり、蛍光が褪色したりしてしまう可能性があります。FV3000RSは高感度なGaAsP検出器と、検出効率の高い「TruSpectral」分光システムを標準搭載しているため、レーザー強度を上げることなくサンプル深部の微弱な蛍光も明るく取得することができます。その結果、デバイス上の両端からから派生した血管網が腫瘍スフェロイドの内部まで貫入している様子や、また画像を三次元的に観察し、血管の管腔構造(図2b)を確認することができました。
(a) | (b)
|
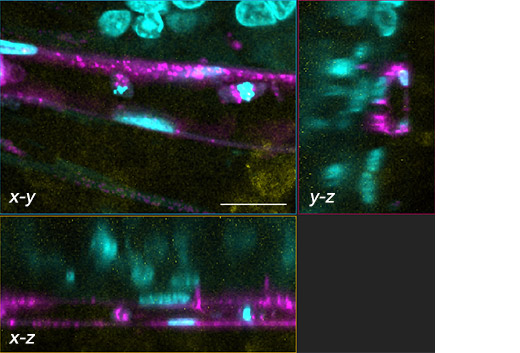
図2:血管網を備えた腫瘍スフェロイドの画像
核:シアン(405nm、Hoechst 33342)、RFP-HUVEC:マゼンダ(561nm、RFP)、E-cadherin:黄色(640nm、Alexa Fluor 633)
(a)腫瘍スフェロイドのプロジェクション画像。スケールバー:200μm。対物レンズ:UPLSAPO10X2。
(b)(a)の白い長方形の領域の三次元断面(x-y、x-z、y-z)の画像。スケールバーは20μm。対物レンズ:UPLSAPO40X2。
レゾナントスキャナーによる血流の高速イメージング
更に、蛍光ビーズ(直径:3.1μm)を使用して、腫瘍スフェロイドに構築された血管網の「流れ」を調べました。速い血流を観察する際、通常のガルバノスキャナーでは画像取得速度が十分でない場合があります。本実験では、高速レゾナントスキャナーを搭載しているFV3000RSで高速タイムラプス撮影を行いました。血管網は流体デバイスと接続され、その内部を蛍光ビーズが流れる様子を観察することができました。その結果、チャネル3に注入されたビーズが、血管の管腔構造とスフェロイドを通過してチャネル1に達していることを確認することができました。
動画:マイクロ流体デバイス上で構築された血管と腫瘍スフェロイドの内部を蛍光ビーズが流れる様子
撮影条件:65msec/frame。スケールバーは100μm。
更にこの後の実験により、従来のウェルでの培養に対し、血流を含む腫瘍微小環境の評価が可能になり、薬剤効果が血管内の流れの有無によって異なることを明らかにしました(論文参照)。今後は、経血管的な薬剤投与モデルとして、医薬品開発への活用が期待されます。
横川隆司先生からのコメント
本研究では、腫瘍スフェロイドからの血管新生因子によって、スフェロイド内に血管網を構築しています。構築された血管網がどのようにマイクロ流体デバイスの流路構造と接続しているのか、さらにもっと重要なことには、血管網が管腔構造を持つのか可視化する必要がありました。FV3000を用いることで、組織内部に存在する血管(RFP-HUVEC)と蛍光ビーズ(緑)の流れを可視化することができました。
アプリケーションノート制作にご協力賜りました先生:
横川隆司先生1 |
梨本裕司先生2 |
京都大学大学院工学研究科 マイクロエンジニアリング専攻 ナノシステム創成工学講座 ナノメトリックス工学分野 教授1
東北大学 学際科学フロンティア研究所 新領域創成研究部 助教2
実験を可能にしたFV3000の技術
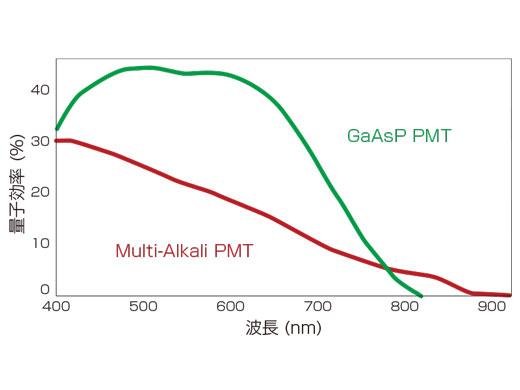
高感度なTruSpectral分光システムとGaAsP検出器
Related Videos |
|
従来に比べ40%以上効率よく蛍光シグナルを回収できる透過型回折格子を採用した新分光システム「TruSpectral」を搭載。また、量子効率の高いGaAsP検出器により、微弱な蛍光シグナルを捕らえることが可能です。
ガルバノスキャナーとガルバノ/レゾナントのハイブリッドスキャナー
Related Videos動画:レゾナントスキャナーによるマウス血管内の血栓と血小板イメージング(フルフレーム30fps で撮像) 標本作製、画像の取得・提供にご協力賜りました先生: | FV3000RSには、ハイブリッドスキャンユニットには、高精度イメージング用のガルバノスキャナーと、高速イメージング用のガルバノ/レゾナントスキャナーの両方が搭載されています。高速イメージングでは、512×512ピクセルで30fps、512×32ピクセルで438fpsのスキャンが可能です。 |
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。