このページはお住まいの地域ではご覧いただくことはできません。
特長
 | Confocal Super Resolution for All Live Cell SamplesIXplore SpinSRは、標本のより深部への三次元ライブ観察を実現した超解像イメージングシステムです。スピニングディスク共焦点光学系を採用し、生細胞への光毒性を抑えたスピーディーな画像取得を実現します。 |
|---|
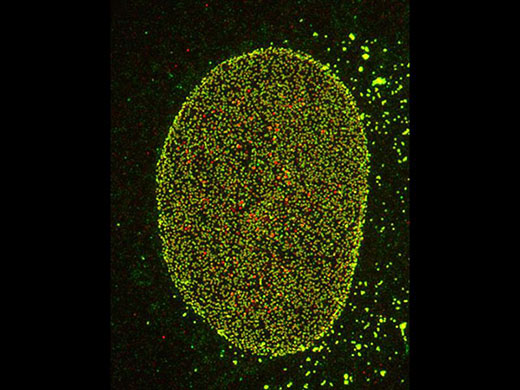
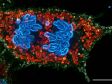
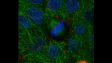
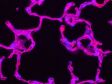
 左:共焦点観察/右:超解像観察 | オリンパス独自の超解像イメージングオリンパス独自の高速超解像処理Olympus super resolution(OSR)により超解像のライブディスプレイができます。 Olympus super resolution(OSR)の詳細はこちら ※画像:ストレスファイバー Fアクチン(緑)/ミオシン(赤)
|
|---|
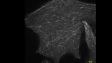
高速スキャンIXplore SpinSRはライブセル超解像イメージングを実現し、高速な変化を捉えるだけでなく、できるかぎり光毒性を抑えることで正しい現象を捉えることが可能です。ハードウェア性能に加え、オリンパス独自の高速超解像処理によって超解像のライブディスプレイを実現します。 | Hela生細胞の伸長する微小管先端に結合するEB3タンパクEB3を遺伝子導入によりGFPでラベル。※1 標本作製、画像の取得・提供にご協力賜りました先生:
|
|---|
Related Videos
神経細胞の3次元タイムラプス
標本作製、画像の取得・提供にご協力賜りました先生:
| 深部超解像イメージングIXplore SpinSRでは、共焦点光学系と生細胞の屈折率にマッチしたシリコーン浸対物レンズを採用することで、光学セクショニング効果による背景光(ボケ)の少ない鮮明な超解像画像を深部でも可能にしました。 |
|---|
高い汎用性
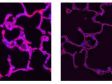
1クリックで超解像観察から共焦点観察、ワイドフィールド観察への切替ができ、同じサンプルを各観察手法で比較することが可能です。
|
|---|
マルチカラー超解像イメージング2カメラ同時観察ユニットオプションで2つのカメラを同時に接続したシステムを構築でき、2 色同時の超解像イメージングが可能です。 簡単設定他の超解像手法に比べ、設定パラメーターが少なく簡単にマルチカラー超解像イメージングができます。 |
デコンボリューション超解像画像にデコンボリューションを行う事により、さらに細部の観察が可能となります。 |
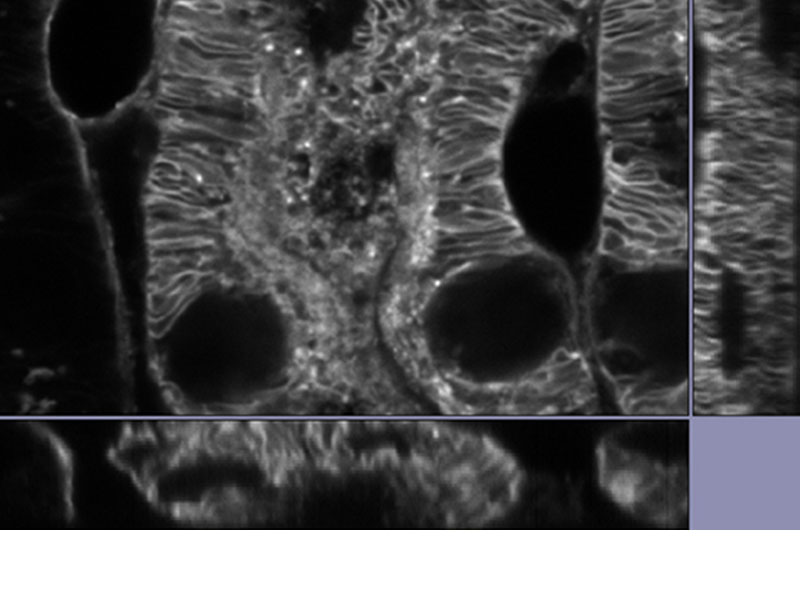 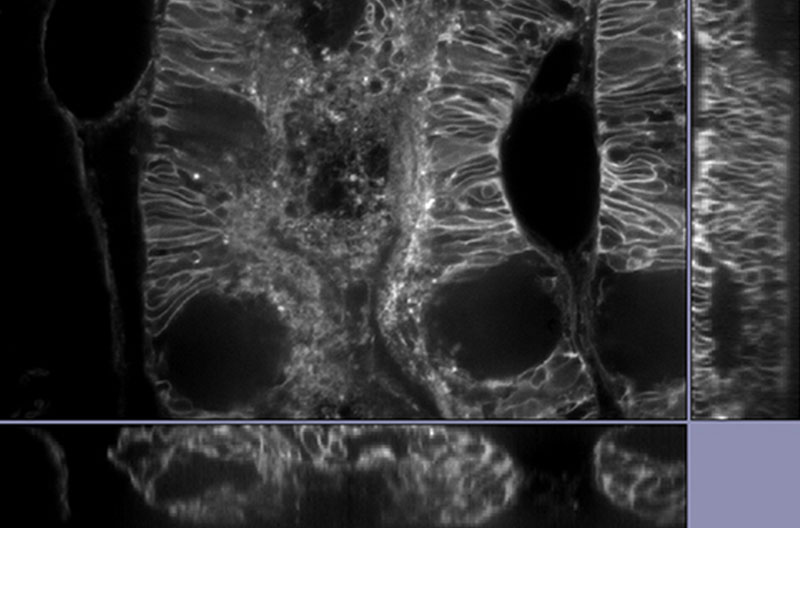 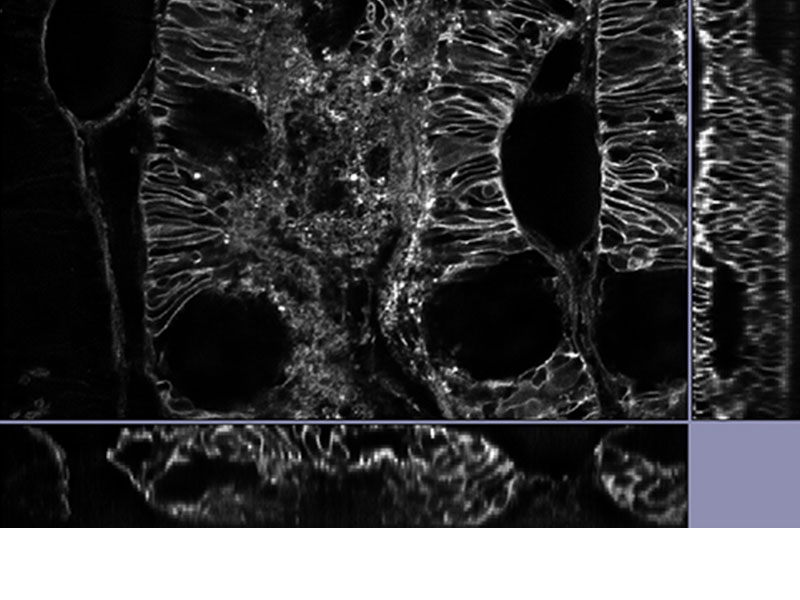 |
|---|
参考文献S. Hayashi and Y. Okada, “Ultrafast superresolution fluorescence imaging with spinning disk confocal microscope optics,” Mol. Biol. Cell 26(9), 1743–1751 (2015). S. Hayashi, “Resolution doubling using confocal microscopy via analogy with structured illumination microscopy,” Jpn. J. Appl. Phys. 55(8), 082501 (2016). A. Nagasawa-Masuda and K. Terai, “Yap/Taz transcriptional activity is essential for vascular regression via Ctgf expression and actin polymerization,” PLoS ONE 12(4), e0174633 (2017). H. Nakajima, et al., “Flow-Dependent Endothelial YAP Regulation Contributes to Vessel Maintenance,” Dev. Cell 40(6), 523-536.e6 (2017). K. Tateishi, et al., “Three-dimensional Organization of Layered Apical Cytoskeletal Networks Associated with Mouse Airway Tissue Development,” Sci. Rep. 7, 43783 (2017). E. Herawati, et al., “Multiciliated cell basal bodies align in stereotypical patterns coordinated by the apical cytoskeleton,” J. Cell Biol. 214(5) 571-586 (2016). M.-T. Ke, et al., “Super-Resolution Mapping of Neuronal Circuitry With an Index-Optimized Clearing Agent,” Cell Rep. 14(11) 2718–2732 (2016). |
※1
HeLa細胞は医学研究で最も重要な細胞株の一つで、科学の発展に偉大な貢献をしました。しかし、この細胞の元となったヘンリエッタ・ラックス(Henrietta
Lacks)さんの同意が得られていなかった事実を認識しなければなりません。HeLa細胞の使用は、免疫学や、感染症学、癌研究などにおける重要な発見に貢献しましたが、同時に医学における個人情報保護や倫理についての重要な議論も引き起こしました。
|
ご質問や見積もり依頼はこちらから |
機能
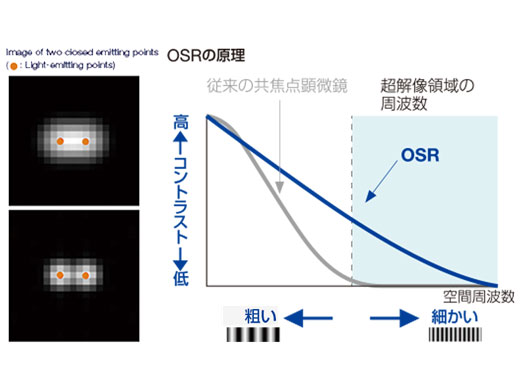
OSR(Olympus Super Resolution)の原理共焦点画像がもつ潜在的な超解像性をオリンパス独自の技術により可視化する手法です。光学理論に基づいた忠実な超解像成分の回復処理により、平面分解能 120nmを実現しました。 |
|
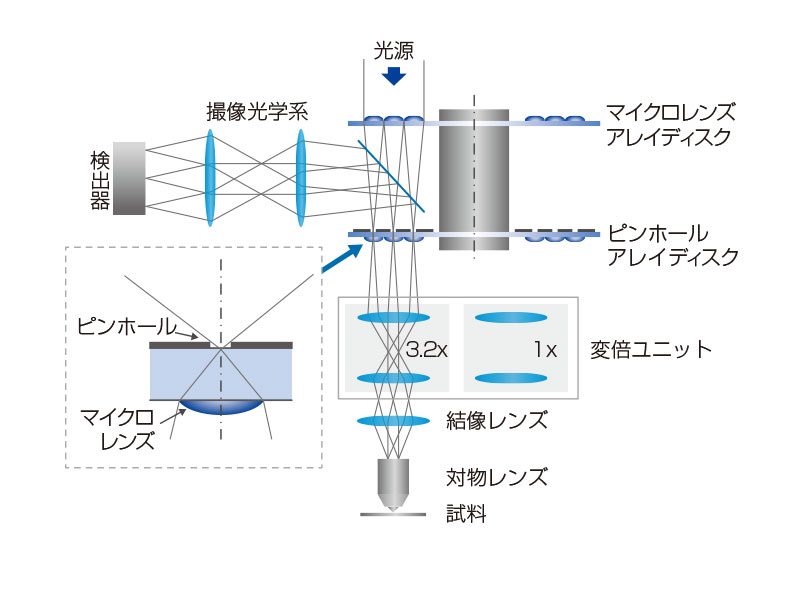
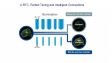
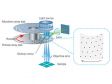
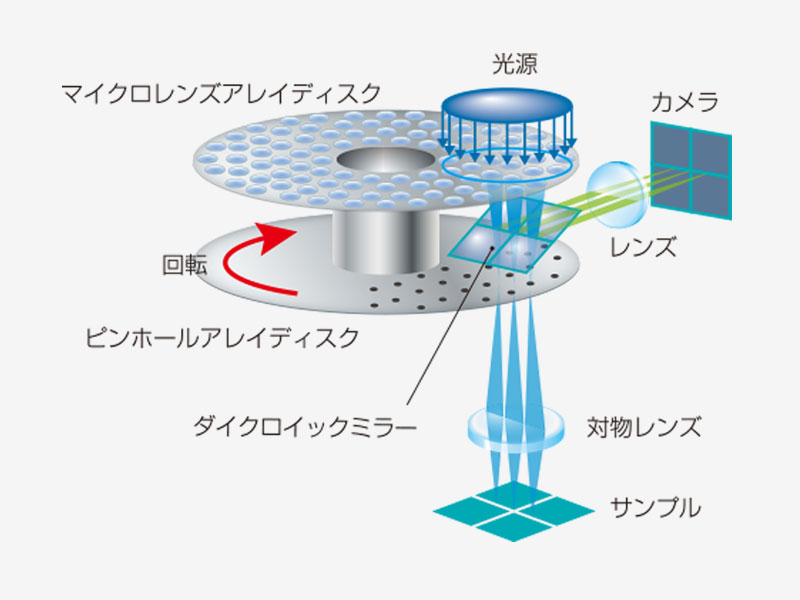  | スピニングディスク共焦点光学系共焦点ピンホールを多数有すディスクを高速に回転させ、一枚の共焦点画像をカメラで高速に取得します。これにより最速5ms/fでの画像取得が可能であり、高速に起こる生物現象を捉えることができます。多数あるピンホールは十分な間隔を持ち、クリアな画像取得ができると共に、視野数18(共焦点モード)を確保する光学系によって、広い視野を一度に取り込むことを可能にしています。 また、共焦点光学系をベースにした超解像技術を活用した光学セクショニングにより、背景光(ボケ像)のない鮮明な超解像画像を取得できます。 標本作製、画像の取得・提供にご協力賜りました先生: |
|---|
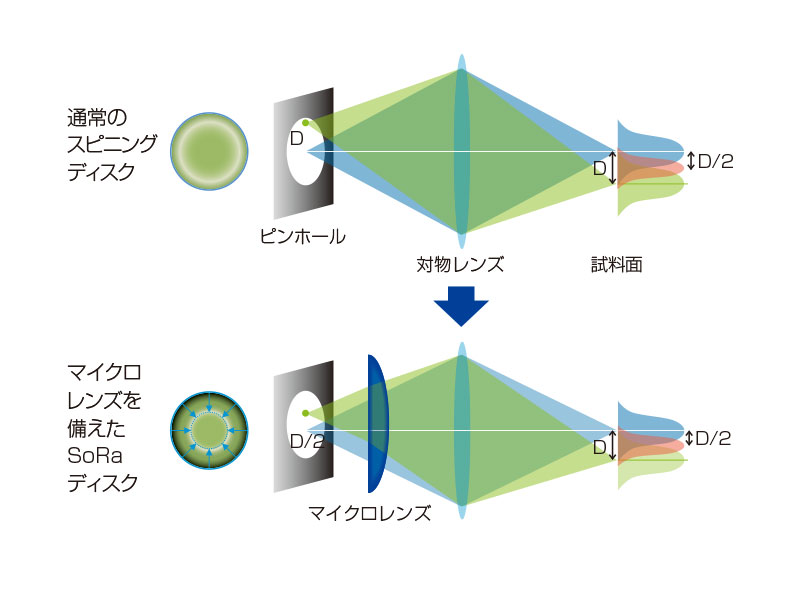
ライブセル超解像に適した明るいスピニングディスク共焦点ピンホールにマイクロレンズを備えたスピニングディスクにより、従来よりも明るい超解像画像取得を実現します。弱いレーザーパワーでのイメージングが可能になるため、サンプルに対する光毒性を抑えることができ、ライブセルイメージングに適しています。
通常の共焦点顕微鏡の結像関係は、照明系のPSF(点像分布関数)と検出系のPSFとの積で表されます。ピンホールの光軸中心からDの位置の結像を確認すると、図のように照明系のPSFと検出系のPSFの積となり、光軸中心からD/2の位置情報を中心として伝達されていることが分かります。これは、D/2の位置の情報がピンホール上ではDに拡大されていることと同等になりますが、これを補正するために、マイクロレンズを用いてピンホールに投影される個々の焦点を1/2に光学的に縮小することにより、理想的な結像関係になります。この場合の分解能は、ピンホールを無限小に小さくした場合の理想的な共焦点顕微鏡とほぼ等しくなり、高速で、細胞にやさしいスピニングディスクの特徴もそのまま維持されます。 関連論文:T. Azuma and T. Kei, "Super-resolution spinning-disk confocal microscopy using optical photon reassignment", Opt. Express 23, 15003-15011 (2015). |
| 視野周辺まで均一な画像性能中間変倍ユニットによって、共焦点モードと超解像モードを切り替えることができます。オリンパス専用の中間変倍ユニットは、超解像用対物レンズの性能を最大限発揮させる基本光学設計、倒立型顕微鏡IX83に最適なテレセントリック光学系を搭載しています。これにより、視野周辺まで均一な画像性能を得ることができます。 |
|---|
深部観察を可能にする光学設計深部観察では、球面収差は大きく影響します。球面収差とは、光路中の屈折率ミスマッチ(対物レンズの浸液とサンプルの屈折率など)によって発生し、分解能やコントラストの低下を招きます。特に開口数の大きい対物レンズでの影響度が高く、超解像イメージングの深部観察するために考慮しなければならないことのひとつです。屈折率はサンプルに依存しますが、一般的な生細胞やカルチャー組織スライスでは、おおよそne=1.38であり、それに近い屈折率の浸液を利用したシリコーンオイル浸対物レンズは超解像イメージングの深部観察に最適な対物レンズであり、球面収差を抑えることで数十マイクロメートル深部の細胞内構造を観察することを可能にします。 | Related Videos |
|---|
| 遠隔補正環ユニット補正環は対物レンズの中のレンズ位置を調整することで、光路中の屈折率ミスマッチによって発生する球面収差を補正し、分解能、明るさ、コントラストなどの画質を向上させることができます。特に超解像画像で使用される開口数の高い対物レンズでは球面収差の影響が大きいため、補正環を調整することは重要です。遠隔補正環ユニットは、すべての補正環付きUIS2対物レンズで使用することができ、より簡単に補正環調整を可能にします。 |
|---|
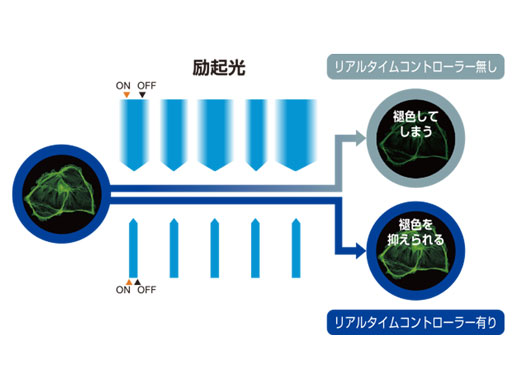
リアルタイムコントローラーによる正確なデバイス制御3Dタイムラプス観察やライブセルイメージングでは、光毒性を減らすためにできるだけ無駄な光を当てる時間を短くすることが望ましく、高い時間分解能が求められます。リアルタイムコントローラーは、独立したCPUボードを搭載し、マイクロ秒オーダーでのカメラやレーザー制御を同期させ、複雑な実験系でも遅延やロスのない処理を行います。 |
|
|---|
Related Videos | フォーカスを維持するIX3-ZDC2IX3-ZDC2は、光毒性の少ないレーザークラス1のIRレーザーを用いて容器底面を検出し、ピントを合わせます。ワンショットAFは、厚みのあるサンプルに対して任意にフォーカス位置を設定でき、Zスタックを効率よく取得できます。また、コンティニュアスAFでは常に同じZポジションを保持できるため、高速なタイムラプスイメージングでもピントを維持します。 |
|---|
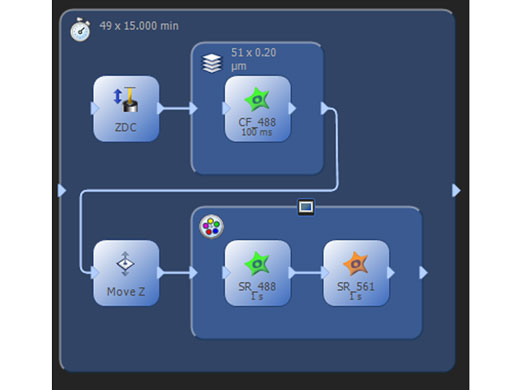
手軽に多次元画像が取得可能プロセスマネージャーでは、マルチカラー、 Z スタックやタイムラプスといった多次元画像を簡単に取得できます。また、エクスペリメントマネージャーでは、ひとつの実験内で撮影条件を変更したり、3 次元の共焦点画像取得からある Z ポジションの超解像画像取得など、自由度の高い実験系をグラフィカルなアイコンを設置するだけで設計可能です。 |
|
|---|
ご質問や見積もり依頼はこちらから |
仕様
| 顕微鏡フレーム | IX83P2ZF | |
|---|---|---|
| 対応する観察手法 > 超解像観察 | ○ | |
| 対応する観察手法 > 共焦点観察 | ○ | |
| 観察法 > 蛍光 (B, G励起) | ○ | |
| 観察法 > 蛍光 (U励起) | ○ | |
| 観察法 > 微分干渉 | ○ | |
| 観察法 > 位相差 | ○ | |
| 観察法 > 明視野 | ○ | |
| レボルバー > 電動式(6穴) | ○ | |
| 焦準機構 > 電動式 |
| |
| 焦準機構 > Zドリフトコンペンセーター | ○ | |
| 鏡筒 > 広視野 (FN22) > ティルティング双眼 | ○ | |
| 照明系 > 透過ケーラー照明 > LED光源 | ○ | |
| 照明系 > 透過ケーラー照明 > 100Wハロゲンランプ | ○ | |
| 照明系 > 落射蛍光照明 > 100W水銀ランプ | ○ | |
| 照明系 > 落射蛍光照明 > ライトガイド光源 | ○ | |
| 蛍光ミラーユニットカセット > 電動式(8穴) | ○ | |
| ステージ > 電動式 | ||
| ステージ > マニュアル式 > IX3-SVR 右奥ロングハンドルステージ |
| |
| ステージ > マニュアル式 > IX3-SVL 左手前ショートハンドルステージ |
| |
| コンデンサー > 電動式 > ユニバーサルコンデンサー | W.D.=27mm、NA=0.55、電動絞り、電動ポラライザー付 | |
| コンデンサー > マニュアル式 > ユニバーサルコンデンサー | NA 0.55/ W.D. 27 mm | |
| コンデンサー > マニュアル式 > 超長作動距離コンデンサー | NA 0.3/ W.D. 73.3 mm | |
| 共焦点スキャンユニット | スピニングディスク共焦点スキャンユニット | |
| 超解像処理 | Olympus Super Resolution (OSR) フィルター | |
| アクセサリー | 遠隔補正環調整ユニット (IX3-RCC) | |
| 外形寸法 | 323 (W) x 475 (D) x 706 (H) mm (IX83P2ZFフレーム) | |
| 質量 | 約47kg(IX83P2ZFフレーム) |
アプリケーション
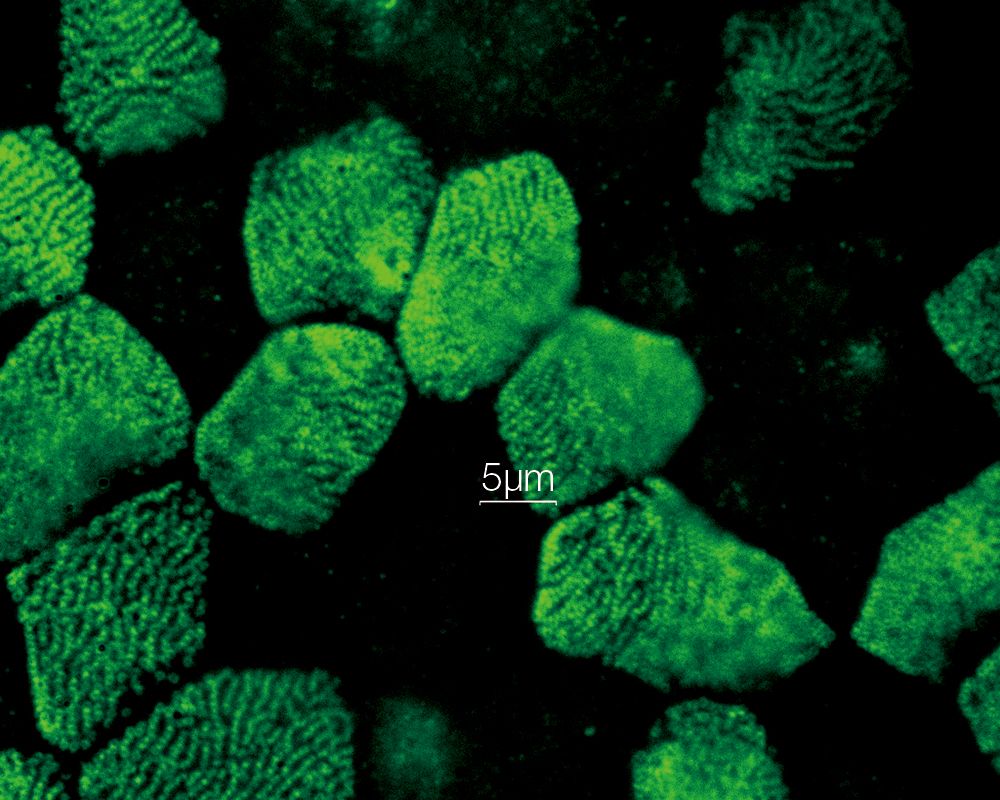
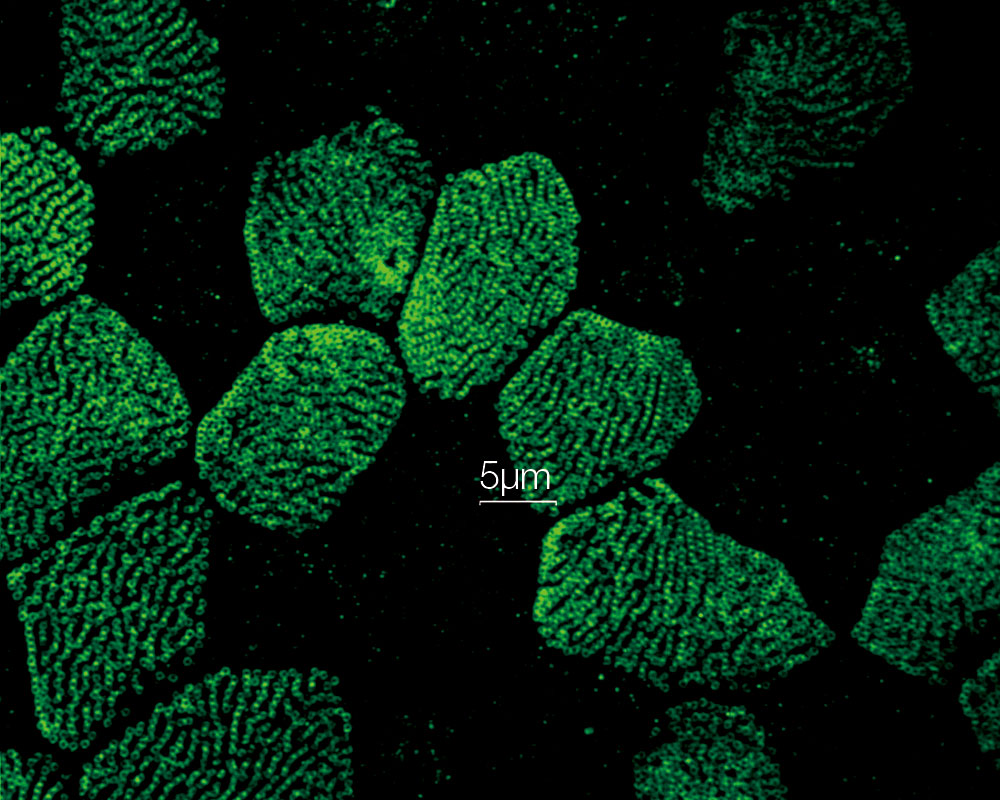
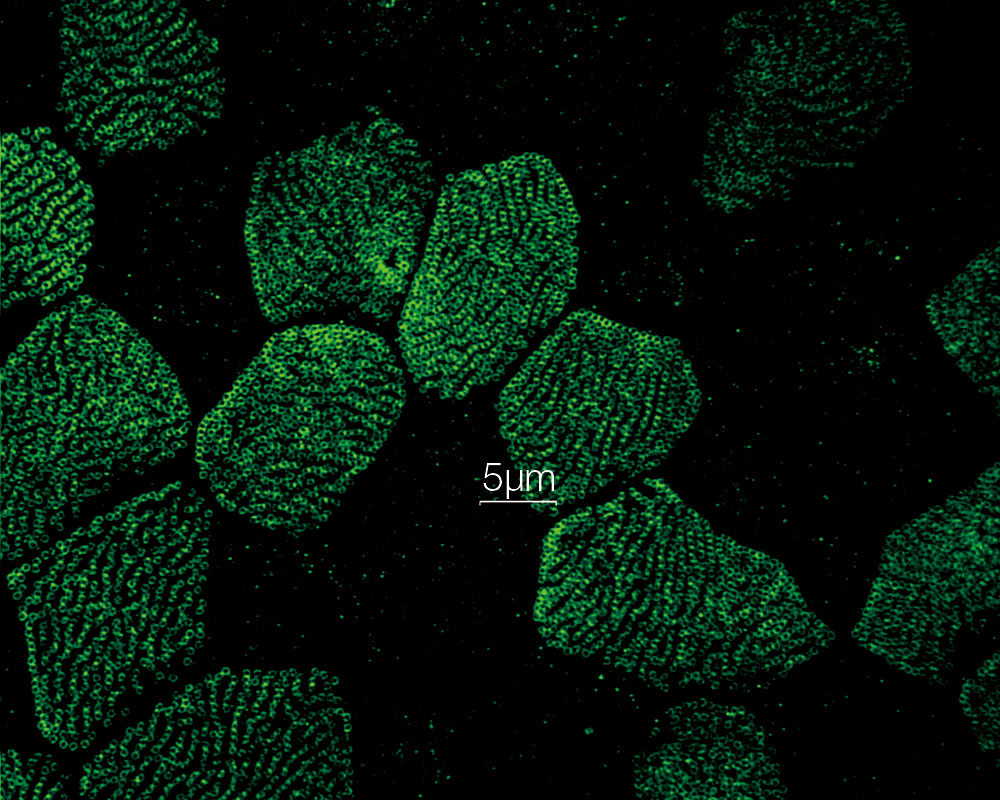
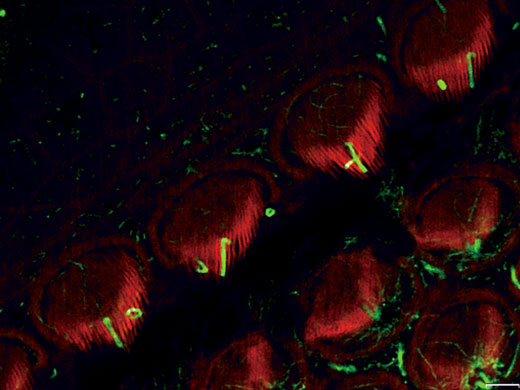
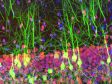
内耳コルチ器外有毛細胞ステレオシリアとキノシリア(アクチン:赤、微小管:緑) 標本作製、画像の取得・提供にご協力賜りました先生: |
|
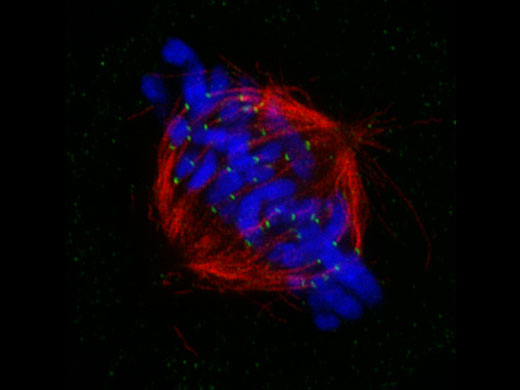
Related Videos | 培養上皮細胞の分裂装置(微小管、Z01) 標本作製、画像の取得・提供にご協力賜りました先生: |
|---|
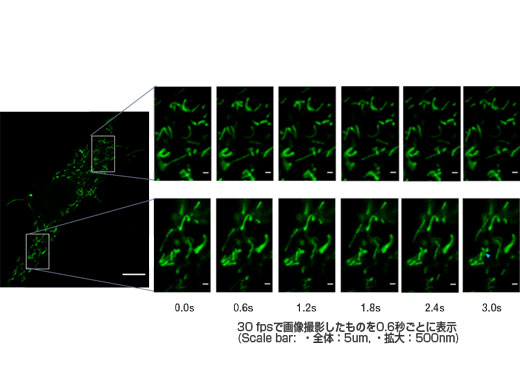
GFPでラベルしたミトコンドリアのビデオレート(30fps)での高速観察 標本作製、画像の取得・提供にご協力賜りました先生: 東北大学大学院 工学研究科 林 久美子 先生 |
|
|---|
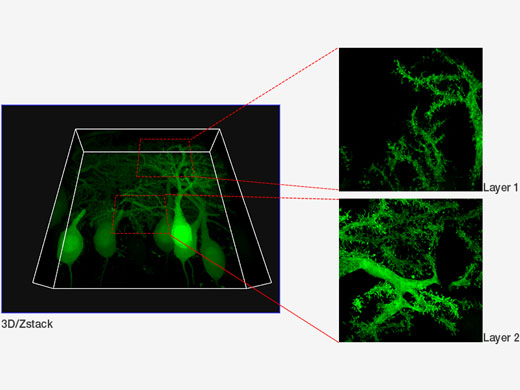 | GFPでラベルした脳スライスのプルキンエ細胞 標本作製、画像の取得・提供にご協力賜りました先生: |
|---|