Accelerating Experimental Success Using a Systematic Cell Culture Workflow
The expansion and modernization of the cell culture process are driving demand for technologies that enable standardization, accurate documentation, increased speed, and reduced workloads. This white paper describes solutions that support an efficient and standardized cell culture workflow to help accelerate experimental success in cell-culture-based applications.
Increasing Demand for an Improved Cell Culture Workflow
An effective cell culture process lays the foundation for success in applications throughout the life science and pharmaceutical industries, from stem cell and cancer research to regenerative medicine. The ability to accurately observe and document cells as they grow, proliferate, and differentiate in vitro is central to ensuring quality and reproducibility throughout the cell culture workflow. To address this, many laboratories are introducing technologies that support standardization and accurate documentation, while also improving speed and efficiency.
Supporting Efficiency, Standardization, and Documentation in Cell Culture
At its most basic, the cell culture process involves quantifying cell proliferation and density (otherwise known as confluency) while evaluating cell morphology. Adapting to a cell culture workflow that makes these processes more efficient, accurate, and standardized helps improve the reproducibility of downstream experiments:
- Standardizing conditions ensures that samples are comparable between researchers and experiments. Cells cultured under inconsistent conditions can demonstrate altered growth patterns and gene expression, impacting cellular function.
- Documenting results provides an accurate picture of cell behavior over time, enabling traceability for future reference, audits, peer review queries, or patent applications.
- Speed and efficiency maintain culture health by minimizing the time cells are outside of optimal incubation conditions; a fast workflow also frees up time for scientists to focus on other tasks.
The modern cell culture process can take advantage of improvements to classic cell culture systems such as the inverted microscope, while also incorporating technological advancements that assist in automating the cell culture lab (Figure 1).
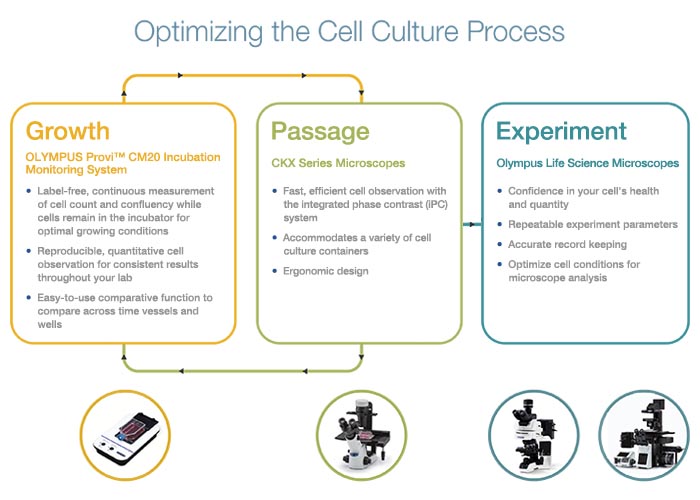
Figure 1. Technologies that support an optimized cell culture workflow
Hardware Features for an Improved Cell Culture Microscope
Success in cell cultivation comes from insightful observation and workflow efficiency. As microscopy has evolved, systems designed for cell culture observation and analysis have incorporated various hardware features to address workflow challenges (Figure 2).

Figure 2. The CKX53 cell culture microscope (left) and the Olympus Provi™ CM20 incubation monitoring system (right) offer features to streamline standardization and quality control in the cell culture workflow.
For example, ergonomic components, such as natural hand positioning for focusing and sampling, increase the speed of cell processing. This benefits the cell cultures by reducing the time that cells spend outside of optimal incubation conditions. Added time outside of an incubator increases the risk of contamination and can stress the cells, which can alter physiology and lead to inconsistencies between samples.
These systems also feature a compact design to fit inside biosafety cabinets. Observation can be carried out in a sterile environment, reducing the risk of contamination.
Consistent High-Contrast Observation for Cell Culture
Another improvement to the cell culture workflow is the ability to perform fast and high-contrast observation. Pairing cell culture microscopes with advanced optics provides a clear, wide view that facilitates fast and efficient screening.
Advances in observation methods also improve the imaging process for cell culture. Phase contrast is a popular method for cell biologists. However, properly applying this method requires preparing and centering each objective and using each objective with its appropriate phase ring. This can be time consuming and lead to errors if researchers misalign or use the incorrect phase rings when switching magnifications.
To address this, Evident offers integrated phase contrast (iPC) technology, which provides a high-contrast image without the need to change the ring slit when switching between 4X–40X objectives. This simpler workflow improves efficiency and removes a potential point of inconsistency between researchers.
Versatility for a Wide Range of Observation and Analysis Tasks
Extending the versatility of the cell culture microscope, fluorescence imaging capabilities enable the researcher to perform routine observation and functional studies on the same system. This saves both space and costs. A single system can be used for multiple stages of the cell culture workflow: from monitoring the seeding, proliferation, and passaging to high-contrast fluorescence imaging of cellular assays using a wide range of dyes.
Simple and Flexible Image Acquisition
An important part of the cell culture process is the routine documentation of cells through imaging. Many inverted tissue culture microscopes have the flexibility to add various digital cameras so the researcher can image as they work.
Until recently, these cameras needed to be connected to an imaging computer. A computer can take up valuable bench space in the tissue culture room, and the corded connection between the camera and computer required the devices to be placed near each other, limiting the placement of both items. Modern camera systems address these challenges through flexible and space-saving imaging options. For example, the Olympus EP50 camera can wirelessly connect to a range of different devices: a computer, tablet, or smartphone. This wireless setup also enables the microscope to be moved around the tissue culture space and placed in convenient locations.
Adding greater flexibility, the EP50 camera has operating system, software, and storage options built right into the camera. As a result, a monitor can be mounted directly to the camera to create an all-in-one imaging solution. This setup removes the need for an external computer completely. The entire unit can also be safely used inside of a biosafety cabinet, enabling imaging in a sterile environment.

Figure 3. CKX53 cell culture microscope and EP50 camera
Generating Quantifiable Cell Growth Data
An essential piece of successful cell culture is the proper long-term monitoring of cell growth and confluency. Cell culture growth undergoes three distinct phases: lag phase, log phase, and plateau phase (Figure 4).
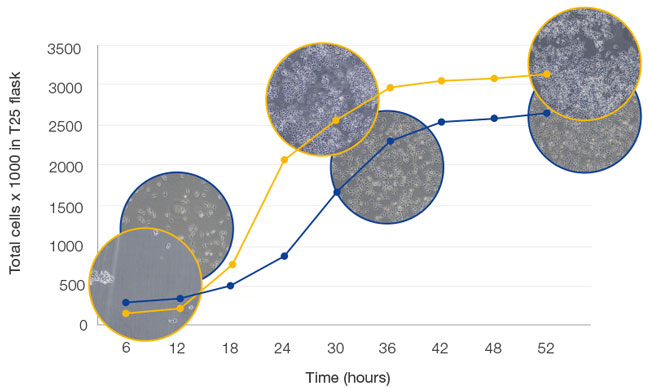
Figure 4. Cell growth
Cell proliferation begins in the lag phase, turning into the exponential log phase as the growth factor concentration increases. When nutrients are consumed or cell density increases, contact inhibition occurs and cell proliferation stagnates. Choosing the right time to process proliferating cells is vital since it helps ensure that they have grown enough for a sufficient yield but have not yet reached saturation.
Whether preparing cell samples for passaging, downstream experimentation, or storage, accurate cell counting is critical for the following reasons:
- Passaging: consistent seeding densities mean cultures grow at the same rate and health
- Downstream experimentation: identical cell counts facilitate comparable results
- Storing: knowing the cell concentration and viability in each vial is important when reviving a cell line from storage
Estimations of confluency and cell count are often made visually, which can be highly variable. If you place the same plate of cells in front of multiple researchers, you may get a wide range of estimations of cell count and confluency.
Consistency in Monitoring
While a conventional microscope can help ensure that cultures are being evaluated consistently, it is equally important that cultures are monitored regularly. If cells are not checked on the correct days or even time of day, the optimal time for passaging or other experimental variation may be missed (Figure 5). Passaging at an incorrect or inconsistent time can also cause downstream problems to cultures and experiments. By combining cell culture software with an incubation monitoring system for continuous monitoring, researchers can know exactly when cells are ready to passage.
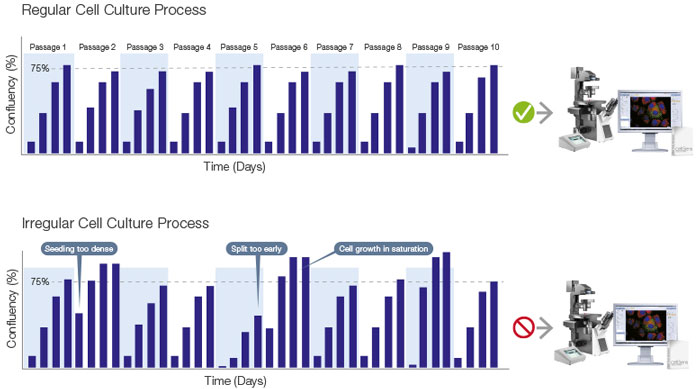
Figure 5. Constant monitoring of cell growth enables a standardized process.
Automated Cell Analysis Using Artificial Intelligence
Incubation monitoring systems such as the CM20 system offer advanced artificial intelligence software. AI-driven cell analysis enables users to automatically evaluate the health of cell cultures using consistent parameters, reducing human error and allowing for more accurate, reproducible cell lines.
Further, these data and analysis parameters can be easily stored, reused, and transferred. This reduces training time and helps ensure that different users throughout the lab follow the same procedures for evaluating cell health.
By standardizing your workflow through quantitative data collection, you can detect an abnormal cell culture earlier in the process, saving time and minimizing the use of costly lab consumables on unusable cell cultures.
Changing the Cell Culture Paradigm with Remote Monitoring
Another improvement to the cell culture workflow is remote monitoring of cell cultures. In a conventional cell culture workflow, a researcher must be present to manually drive the culture monitoring process forward. Incubation monitoring systems such as the CM20 system can monitor cell culture plates on a continuous basis without the need for researcher intervention. These devices are placed directly in the cell culture incubator and provide quantitative cell culture data remotely (Figure 6).

Figure 6. The CM20 incubation monitoring system acquires cell data in the incubator.
Improving Cell Health
Incubator monitoring systems are inherently good at maintaining cell health. Since they are placed directly into the incubator, cell culture plates do not need to be removed from the incubator for regular monitoring. This ensures that cells are consistently maintained in optimal conditions and reduces the risk of contamination.
Incubator monitoring systems can also use illumination methods during imaging designed specifically to support cell viability. Overexposure to the brightfield illumination methods used in conventional microscopes can be damaging to cells. To address this, the CM20 incubation monitoring system uses an alternative illumination method called epi-oblique illumination. Epi-oblique illumination uses a 630 nm LED to reduce phototoxicity, even with continuous observation.
The combination of an incubator monitoring system and culture software also enables the seamless generation of quantifiable cell growth data used to create an accurate growth log, avoiding unnecessary dissociation and in-solution counting for the optimization of culture conditions. These systems are designed to transmit data remotely, so the researcher can monitor their culture progress wherever they are (Figure 7).

Figure 7. See cell culture data remotely using the CM20 system.
Redesigning the Cell Culture Workflow
Cell culture forms the cornerstone of life science applications, and high-quality results demand a high-quality cell cultivation process. Although cell culture is a mature field, new technologies are constantly making both incremental and significant improvements to ensure consistent, efficient, and quantifiable results.
Updated cell culture microscopes provide improved ergonomics, better and more consistent optics, and the flexibility to incorporate more imaging modalities such as fluorescence.
Incubator monitoring systems enable the acquisition of continuous quantitative data while minimizing cell damage and eliminating a significant amount of routine manual work.
These systems work best in concert with one another. While incubator monitoring systems replace the significant workload of routine monitoring, precise cell counting, and passaging, fluorescent cell evaluation still is most successful with a trained researcher at a microscope.
By creating a new workflow that adopts smart laboratory technologies, scientists can create a cell culture system that is efficient, fully documented, and highly standardized. As a result, scientists can accelerate their work for life science experiments and regenerative medicine applications.
Author
Joanna Hawryluk, Product Manager, Evident
Avi Smith, Product Manager, Evident
Products related to this application
was successfully added to your bookmarks
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.