딥 러닝을 사용한 약물 테스트의 다계층 핵 표현형 예측
서문
약물에 반응하는 핵 수용체와 같은 단백질의 활동적인 움직임을 정량화할 때는 염료 및 착색제를 사용한 강력한 핵분할 방식이 필요합니다. 그러나 이 프로세스에는 눈에 띄는 제한 사항이 있습니다. 살아 있는 세포 착색 과정은 시간이 오래 걸리고, 비용이 많이 들며, 광독성, 광퇴색 및 감광성 화합물(예: R18811)의 비활성화를 일으킬 수 있습니다.
이러한 문제를 극복하기 위해 cellSens™ 이미지 처리 소프트웨어와 TruAI™ 딥 러닝 기술을 함께 사용하여 형광 라벨을 사용하지 않고 세포핵을 식별하는 신경망(NN)을 개발했습니다. 그런 다음 약물 반응에서 서로 다른 세포 표현형을 구별하도록 NN을 훈련했습니다. 여기에 NN 워크플로를 적용하여 세포 내 남성호르몬 수용체(AR) 표적 약물로 처리한 살아 있는 전립선 암 세포에서 AR을 예측합니다.
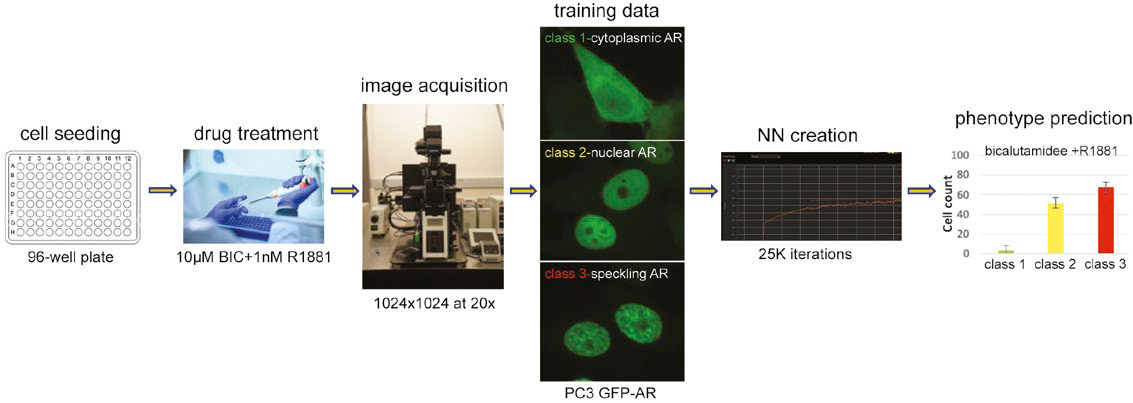
그림 1: 훈련된 NN을 사용하여 다계층 핵 표현형을 예측하는 워크플로
세포질 AR은 활성화 시 전사조절 부위로 국지화되는 핵으로 전위되고, 이는 컨포칼 현미경을 사용하여 특징적인 스페클 패턴으로 시각화할 수 있습니다. AR 역동성을 예측하기 위해 먼저 핵 착색제를 사용하지 않고 세포핵을 검출하는 NN을 생성했습니다. 그런 다음 GFP-AR 핵 전위 및 전사 촉진(스페클) 상태, 즉 화합물의 AR 표적 기능을 테스트하기 위한 필수 분석 판독값에 기반하여 세포를 분류했습니다. 마지막으로, NN 워크플로가 핵 착색 없이 이러한 중요한 AR 표현형을 성공적으로 예측한다는 것을 입증했습니다.
이점:
- 형광 라벨을 사용하지 않고 핵 표현형 식별
- 핵 염료(착색 및 이미지 처리)에 소모되는 시간 및 비용 절감
- 광독성 및 광퇴색 감소
- 감광성 화합물의 활동 보존
방법
약물에 반응하는 것으로 자주 관찰되는 3개의 주요 AR 표현형으로 구성된 훈련 데이터 세트를 생성했습니다. 이미지 중 절반을 사용하여 NN을 생성했고, 나머지 절반으로 성과를 평가했습니다. 마지막으로, 핵 착색제 없이 독립적인 데이터 세트에 다계층 NN을 적용했습니다.
3가지 AR 표현형을 통한 데이터 준비 훈련
NN 구축의 첫 번째 단계로써, 다음 3가지 주요 AR 표현형으로 구성된 훈련 데이터 세트를 생성했습니다.
- 비활성 세포질 AR(무처리군, NTC)
- 리간드 결합이지만 비활성인 핵 AR(10μM 비칼루타마이드)
- 활성 핵 AR 스페클(1 nM R1881)
실측 자료 데이터를 생성하기 위해 SiR-DNA를 사용하여 핵을 착색했습니다. Olympus FV3000 레이저 컨포칼 현미경의 갈바노 스캐너를 사용하는 UPLSAPO 20X 대물렌즈로 1024 x 1024 픽셀 비율 이미지를 확보했습니다. 여기서 전체 데이터 세트(60개 이미지)를 훈련 세트 및 유효성 검증 세트(각 30개 이미지)에 대한 두 개의 동등한 부분으로 분리했습니다. NN을 훈련하기 위해 핵 착색제를 통해 3개의 AR 표현형(데이터의 50%, 총 30개 이미지)에서 각기 10개의 최대 강도 투영 GFP-AR 이미지를 사용했습니다.
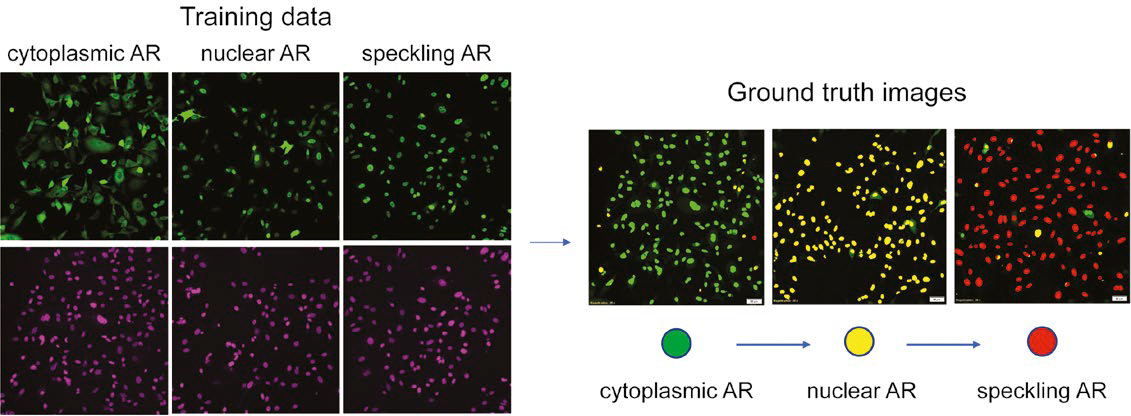
그림 2: 핵 착색에 기반한 다계층 AR 표현형 훈련 데이터 준비. (왼쪽) 녹색: AR-GFP, 보라색: SiR-DNA. (오른쪽) 실측 자료 데이터 세트의 평가.
실측 자료 최적화
그림 2는 NN에서 평가한 실측 자료 데이터를 보여주며, 세포질 AR은 녹색, 핵 AR은 노란색, 스페클 AR은 빨간색으로 표시되어 있습니다. 이 색 부호화 분할 맵을 사용하여 핵 검출 및 분할 오류를 수동으로 교정하고 잘못 분류된 핵을 재분류하여 실측 자료를 미세 조정했습니다.
TruAI™ 딥 러닝 기술을 사용한 신경망 생성
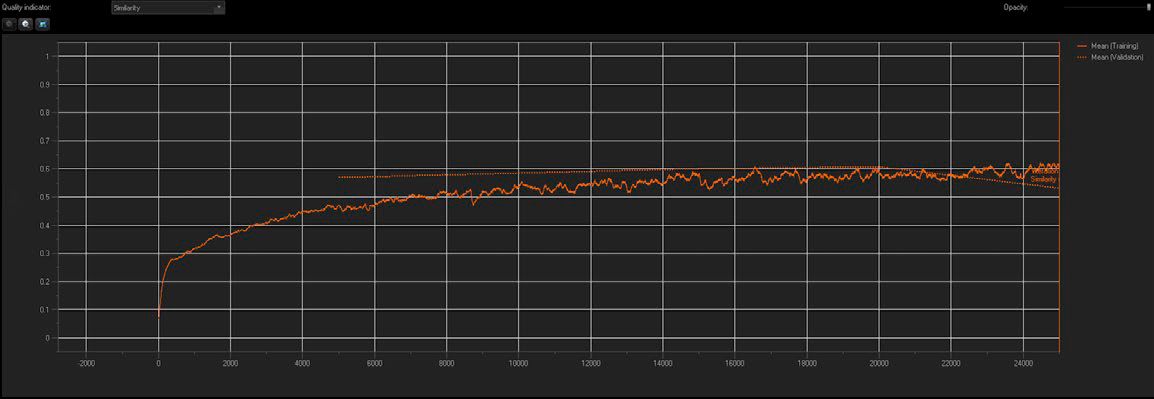
그림 3: NN 훈련에서 유사성 지표와 유효성 검증 중간값을 실시간으로 보고함
TruAI 기술을 사용하여 각 AR 표현형에서 10개의 훈련 이미지를 포함하고 다계층 구성을 갖춘 표준 NN을 생성했습니다. NN의 품질과 정확도는 실시간으로 보고되었습니다. 그림 3과 같이, 유사성 지표는 안정기에 도달할 때까지 훈련의 각 프로세스에서 연속적인 반복을 통해 증가했고, 훈련 포화를 나타냈습니다(아래쪽 화살표). 매 5,000회 반복마다(20% 진행률) 체크 포인트가 생성되었고, 최적의 체크 포인트는 자체 유사성 지표 값과 함께 훈련된 NN으로 저장되었습니다.
결과
블라인드 데이터의 다계층 신경망 유효성 검사
실측 자료 또는 NN 훈련(블라인드 데이터)에 사용되지 않은 이미지 중 50%를 사용하여 다계층 NN 모델의 유효성을 검사했습니다. 그런 다음 세포 파괴물과 잘못 분할된 세포를 제거하기 위해 영역 필터(최소 49.83 μm, 최대 555.44μm)를 적용하여 유효성 검사 결과로 모델 매개변수를 미세 조정했습니다. 훈련된 NN 모델은 핵 착색제 없이 다계층 AR 표현형을 독립적으로 예측했습니다. 그림 4는 10개 이미지의 데이터를 사용한 표현형 계층 분포를 보여줍니다.
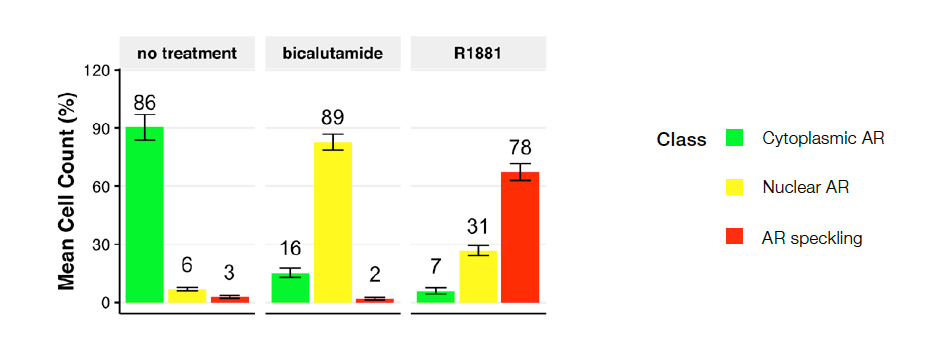
그림 4: 다음 조건에 대한 세포 계층 분포: 무처리군(왼쪽), 비칼루타마이드(가운데) 또는 R1881(오른쪽). 도표는 계층 1(세포질 AR), 계층 2(핵 AR) 및 계층 3(스페클 AR)으로 분류된 세포의 백분율을 나타냅니다. 무처리군은 주로 계층 1 세포로 나타났습니다. 비칼루타마이드(AR 길항제)는 계층 2 방향으로의 변화를 유도했고, R1881(AR 작용제)는 계층 3으로 연결되었으며, 활성 AR은 전사조절 활성 부위로 국지화되었습니다.
독립적인 데이터 세트의 다계층 AR 표현형 예측
다음으로, 독립적인 이미지에서 다계층 NN 모델을 평가하기 위해 비칼루타마이드와 엔잘루타마이드라는 두 개의 임상 항안드로겐제를 사용하여 새 데이터 세트를 준비했습니다(그림 5).
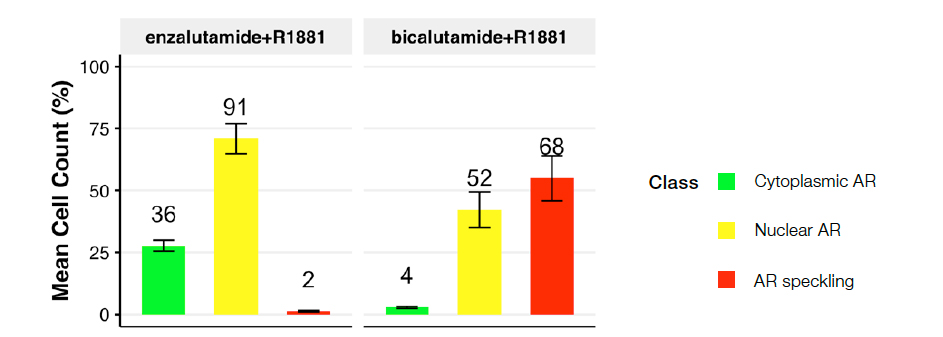
그림 5: 다음 조건에 대한 세포 계층 분포: R1881 + 엔잘루타마이드(왼쪽) 또는 비칼루타마이드(오른쪽). 도표는 처리 조건에 걸쳐 예측된 핵 계층 분포를 나타냅니다.
2세대 항안드로겐제 엔잘루타마이드를 사용한 치료는 스페클 AR(계층 3)이 거의 없거나 전무한 주요 세포질 AR(계층 2) 모집단으로 연결되었고, 리간드 유도 AR 활성화의 효과적인 차단을 보여주었습니다. 그러나 효과가 적은 구형 항안드로겐제 비칼루타마이드는 활성 AR(계층 3) 방향의 주목할 만한 변화로 연결되었고, 1nM R1881 유도 AR 활성화를 효과적으로 차단할 수 없음을 보여주었습니다. 이러한 데이터는 이전 연구를 입증합니다2.
결론
Olympus FV3000 컨포칼 현미경 및 cellSens™ 소프트웨어를 TruAI™ 딥 러닝 모듈과 함께 사용하여 미착색 핵을 검출하고 분할하기 위한 NN을 생성했고, 약물에 반응하는 AR 표현형 변화에 기반하여 세포를 하위 분류했습니다. 이 접근법은 테스트 시간(실험 설정)과 비용을 줄여 약물 테스트 효율성을 증대할 수 있습니다.
또한 NN은 광독성, 광퇴색 및 감광성 화합물의 비활성화와 같은 아티팩트를 줄여 데이터 품질을 증대할 수 있고, 연구자와 기존 이미지 분석 파이프라인에서 간과할 수 있는 미세한 변화를 검출할 수 있습니다. 이 딥 러닝 접근법은 단백질 국지화부터 형태 변화까지의 핵 또는 세포 기반 매개변수에 기반하여 세포 모집단 하위분류에 더욱 광범위하게 적용할 수 있습니다.
참고 문헌
- Risek B, Bilski P, Rice AB, Schrader WT. 안드로겐 수용체 매개 사멸은 광활성 안드로겐 수용체 리간드에 의해 규정된다. Mol Endocrinol. 2008 Sep;22(9):2099-115. doi: 10.1210/me.2007-0426. 2008년 6월 18일 전자 출간. PMID: 18562628; PMCID: PMC2631375.
- Sugawara T, Lejeune P, K hr S, Neuhaus R, Faus H, Gelato KA, Busemann M, Cleve A, Lücking U, von Nussbaum F, Brands M, Mumberg D, Jung K, Stephan C, Haendler B. BAY 1024767은 거세 저항성 전립선암 환자에게서 발견된 안드로겐 수용체 돌연변이를 차단한다. Oncotarget. 2016 Feb 2;7(5):6015-28. doi: 10.18632/oncotarget.6864. PMID: 26760770; PMCID: PMC4868737.
저자
- 캘리포니아 주 로스앤젤레스 남캘리포니아대학교 로렌스 J. 엘리슨 변형의학연구소 Harish Sura, Katherin Patsch 및 Sengil Kim
- Olympus Corporation of the Americas 전략 프로젝트 관리자 Shohei Imamura
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.