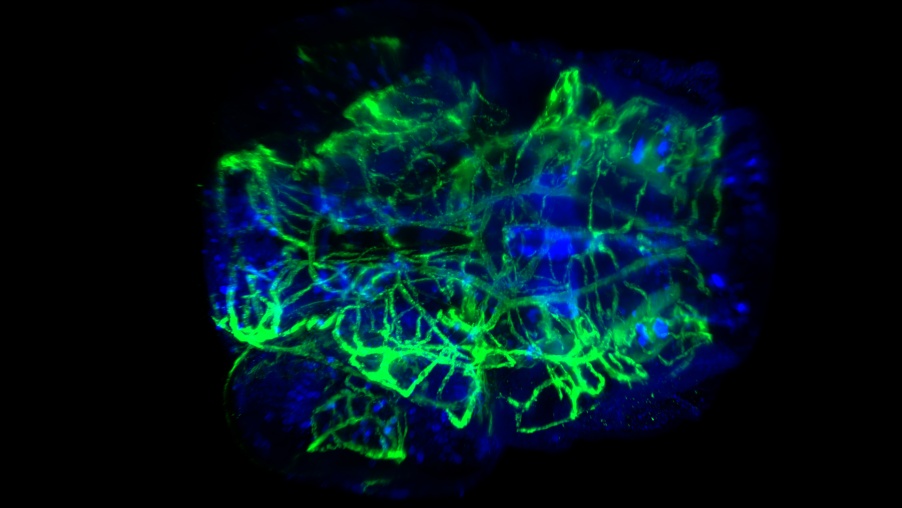
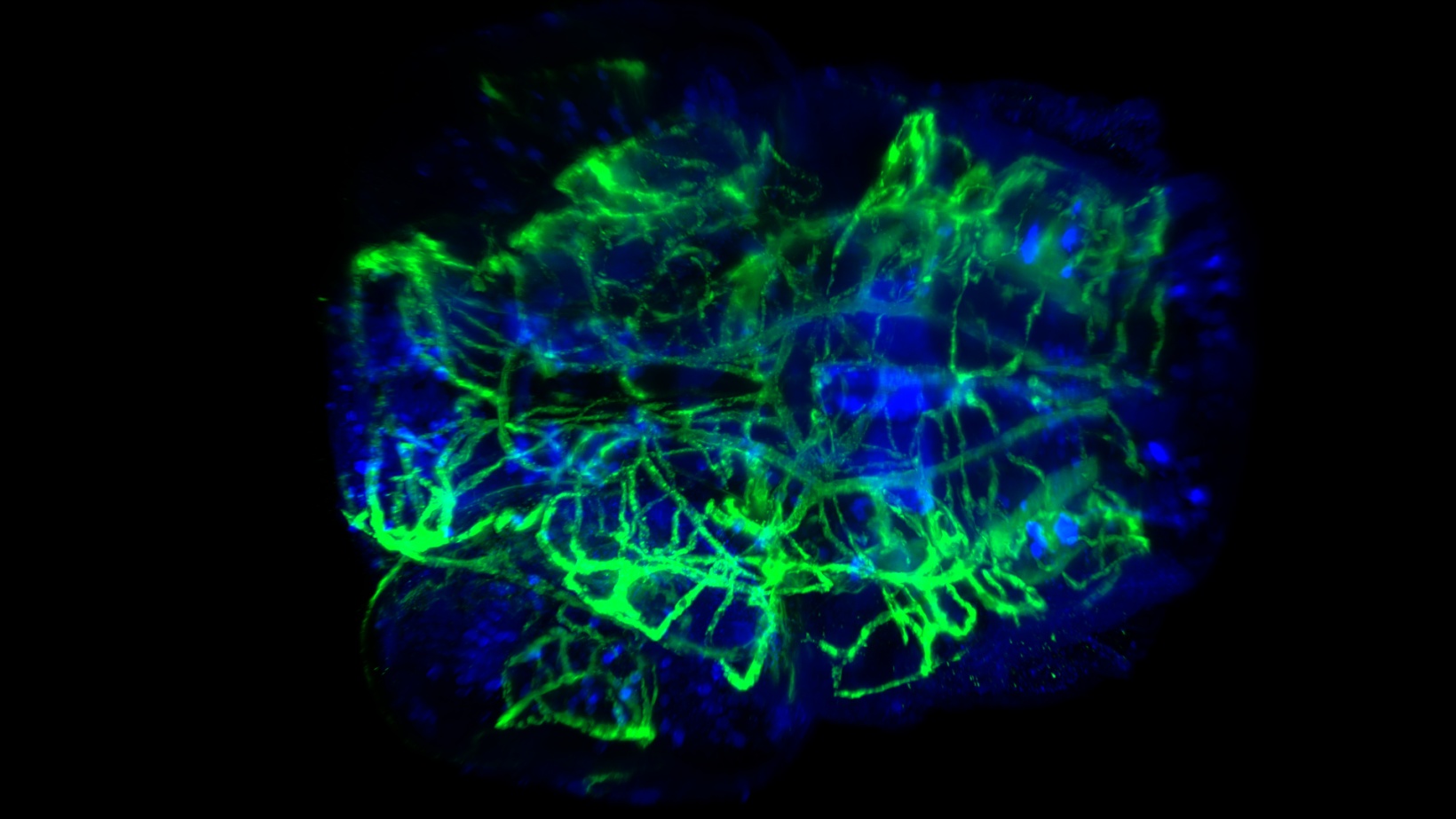
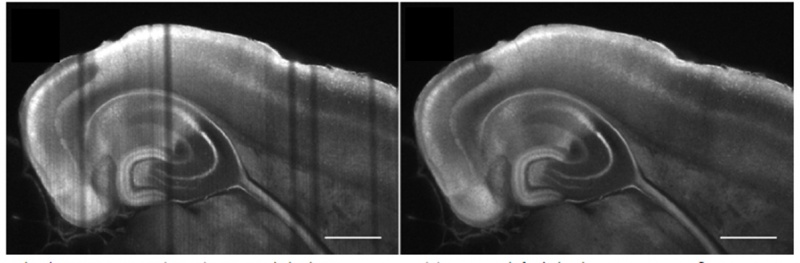
투명화된 제브라피시 유충 머리 혈관 및 신경 염색. 0.5 NA. 및 CUBIC-2로 20x에서 캡처됨. 이미지 제공: P. Affaticati & A. Jenett of the Tefor Facility, France.
우리는 3차원의 늘 변화하는 세계에 살고 있습니다. 하지만 현미경에서 살아 있는 빠른 과정을 관찰하는 데 필요한 속도와 3D로 이미지를 획득하는 능력은 난제로 남아 있습니다. 다른 광학 현미경 기법과 비교하여 형광 현미경은 신호-노이즈 비율 및 광독성에 여전히 큰 제한이 있기는 하지만 높은 특이성 및 대비를 얻을 수 있습니다.
컨포칼 현미경 같은 기존 처리 방법은 초점면 내의 핀홀을 사용하여 광학적 절편이라고 하는 과정인 아웃포커스 광을 제거합니다. 이 방법이 신호-노이즈 비율을 증가시키기는 하지만 샘플은 여전히 반복적으로 대량의 아웃포커스 광에 노출되어야 함에 따라 광퇴색 가능성이 높아집니다.
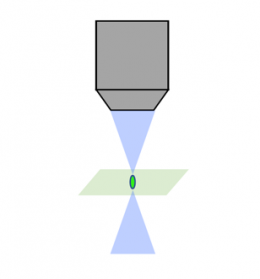 레이저 스캐닝 컨포칼 | 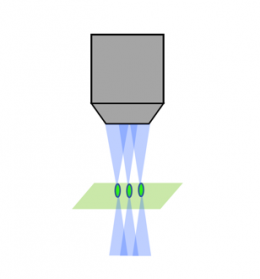 회전 디스크 컨포칼 | 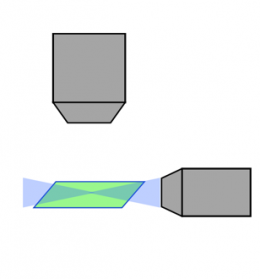 광시트 |
그런 다음 빛이 있었습니다—광시트 형광 현미경의 도래
1900년대 초에 과학자들은 생물학적 이미징을 개선할 방법을 모색하기 시작하였습니다. Richard Zsigmondy 및 Henry Siedentopf(Heddleston & Chew, 2016; Adams et al., 2016)가 개발한 “초현미경”이라고 하는 광학 장치에 의해 이러한 기술 중 하나가 출현하였습니다. 이 초기 광시트 현미경은 조명 및 검출 광 경로를 분리하고 최초의 직각 광시트 현미경을 만들어서 기존 광학적 아키텍처에서 벗어났습니다.
약 100년 후에 Voie 등은 직각면 아키텍처를 사용하여 기니피그 달팽이관을 시각적으로 절편하는 최초의 광시트 형광 현미경(LSFM) 이미지를 발표하였습니다(Heddleston & Chew, 2016; Adams et al., 2016). 보다 최근에 LSFM의 변형들이 개발되어 박테리아, 초파리, 제브라피시 및 다양한 기타 조직들의 이미지가 획득되었습니다.
광시트 형광 현미경의 일반화
선택 평면 조명 현미경(SPIM)이라고도 하는 최신 LSFM 시스템은 원주 렌즈를 사용하여 광학적 절편의 얇은 광시트를 생성하기는 하지만 이전 현미경 같이 직각 아키텍처의 변형을 활용합니다. 이 얇은 광시트는 이미징 대물렌즈의 초점면 내 샘플의 소구역만을 여기시킵니다. 방출 수집을 위한 고속 sCMOS 카메라와 결합된 LSFM은 기존 컨포칼 기술과 비교하여 더 깊어진 샘플링 심도, 신호-노이즈 비율 향상 및 광독성 감소를 위한 이미징 속도 증가를 제공합니다.
이제 광시트 형광 이미징은 전체 장기 또는 살아 있는 표본의 조사를 위한 핵심적 현미경 기법으로 인정됩니다. 하지만 과학계에서 그 발전은 비교적 제한된 범위 및 최신 모델 시스템에의 적응 능력에 의해 여전히 방해를 받고 있습니다. 최근 몇 년 동안 “기성” LSFM 시스템이 생물학적 분야 내에서 연구원들의 요구를 충족하는 데 보다 쉽게 사용할 수 있게 되었습니다. 하지만 모든 시스템이 똑같이 제조되는 것은 아니며 사용자의 요구를 충족하는 기능이 얼마나 다른지를 고려하는 것이 중요합니다.
LSFM 시스템 비교 시 4가지 중요한 고려 사항
사용자에게 최상의 광시트 형광 시스템을 선택할 때 고려해야 할 여러 가지 중요한 특성이 있습니다.
- 가장 중요한, 샘플 준비:
일반적으로 대규모의 고정된 샘플을 절편하여 슬라이드에 올려놓는 기존 현미경과 달리, 광시트 현미경 샘플은 온전하게 이미지가 획득되므로 시각적으로 맑아야 하며 투명화가 수반됩니다. 다양한 조직을 투명화하기 위한 여러 프로토콜이 있으며 투명화액도 시중에 많이 나와 있습니다. 몇 가지 대중적인 방법을 검토하려면 Pablo Ariel의 “조직 투명화 초급 가이드(A beginner’s guide to tissue clearing)”(Int J Biochem Cell Biol. 2017 Mar. 84: 35–39)를 읽어보는 것이 좋습니다. - 광학적 아키텍처:
조명 및 검출 경로를 위한 광학적 아키텍처는 이미지의 품질뿐 아니라 관찰될 수 있는 샘플의 특성 및 크기에도 큰 영향을 줄 수 있습니다. 예를 들어, 샘플 내의 불투명 구조에서 굴절되어 방출된 빛에 의해 줄무늬 아티팩트가 야기됩니다. 이 문제를 해결하려면 온갖 크기의 살아 있는 또는 투명화된 샘플에 대한 이미지 획득을 위해 수많은 광학적 아키텍처가 설계되어 있어야 합니다. 이러한 아키텍처의 한 가지 예는 샘플을 비추고 줄무늬 아티팩트 문제를 해결하도록 다중 조명 경로가 정렬되어 있는 다방향 SPIM(mSPIM)입니다. mSPIM 시스템은 특정 용도에 최적 성능을 제공할 수 있지만 연구에 가장 적합한 시스템 선택 시 고려해야 하는 유연성, 모듈성 및 실용적 사용 면에서 모두 제한을 공유합니다.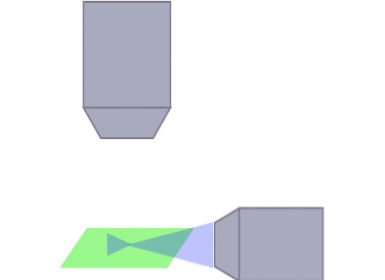
SPIM
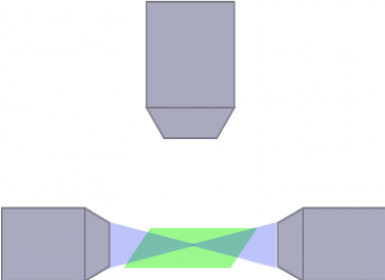
mSPIM
(Schwarz, et al. PLoS One, 2015)
- 샘플 유연성:
매년 새로운 시스템들이 시중에 나오면서 LSFM의 분야가 빠르게 확대되고 있지만 각기 다른 디자인 때문에 수용할 수 있는 샘플의 유형 면에서 변동성 수준이 높습니다. 어떤 시스템은 스페로이드 같은 작은 샘플만 이미지를 획득할 수 있는 반면에 다른 시스템은 더 큰 조직만 이미지를 획득할 수 있습니다. 이는 또한 고정된 표본이나 살아 있는 표본의 이미지를 획득하는 것으로만 제한될 수 있습니다. 비록 이러한 특이성 유형이 하나의 샘플 유형에 초점을 맞추는 단일 사용자에게 이상적일 수 있지만 전체 연구부서와 장비를 공유하거나 연구를 확대하는 능력이 손상됩니다. 사용자의 LSFM 시스템이 다루어야 할 수 있는 모든 잠재적 샘플 유형을 고려하는 것이 중요합니다. 최근에 더 유연한 LSFM 시스템들이 샘플 변동성의 이러한 간극을 메우도록 설계되었습니다. 예를 들어, Alpha3 광시트 형광 현미경은 살아 있는 유기체를 포함하여 단일 세포에서 전체 쥐 뇌까지 다양한 표본을 수용할 수 있습니다.* - 데이터 관리:
마지막으로, 잠재적으로 가장 중요한 것은 데이터 관리입니다. 단일 실험이 수백 기가바이트(GB) 심지어 테라바이트(TB) 데이터에 달하는 것이 금시초문은 아닙니다. 현지 IT 그룹과 협업하여 데이터 요구 계획을 작성하는 것이 좋습니다. 해당 데이터 세트를 렌더링하고 분석하기 위해 별도의 분석 소프트웨어 패키지를 구매해야 할 수 있는 것에 유의하십시오.
관련 콘텐츠
창조의 1세기—Olympus 생명과학 이미징 시스템의 스토리
*Alpha3 시스템이 모든 지역에서 이용 가능한 것은 아닙니다. 자세한 내용은 해당 지역 Olympus 판매대리인에게 문의하십시오.