Not Available in Your Country
Sorry, this page is not
available in your country.
개요
 | 모든 라이브 셀 표본을 위한 컨포칼 초고해상도빠른 3D 초고해상도 이미징 및 타임 랩스 실험의 연장된 세포 생존율을 위해 설계된 IXplore SpinSR 현미경 시스템은 전용 표지 절차의 필요 없이 120nm에 이르는 XY 해상도를 제공합니다. |
|---|
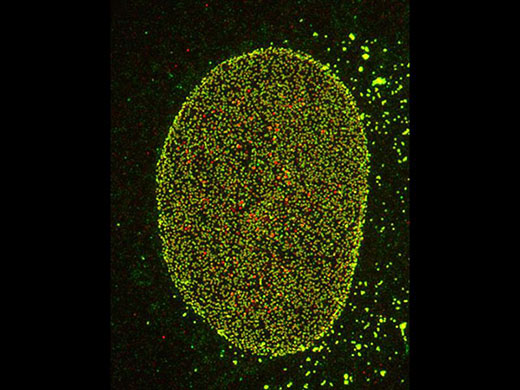
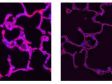
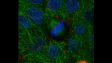
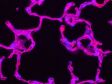
 Left: Confocal / Right: Super Resolution | 높은 수준의 초고해상도컨포칼 기법과 올림푸스 초고해상도(OSR)를 사용하여 컨포칼 이미지를 120nm XY 해상도까지 분해합니다. *이미지: Hela 세포의 스트레스 섬유 : 액틴에는 팔로이딘-알렉사488(초록색), 미오신 중쇄에는 알렉사 568(빨간색)으로 항체 염색 |
|---|
살아있는 표본에 적합OSR 알고리즘은 실시간으로 작동하여 프레임 평균화 또는 이미지 재구성으로 인한 지연을 제거하여 즉각적인 초고해상도 이미지를 제공하므로 결과를 더 빨리 얻을 수 있습니다. 이를 통해 초고해상도 실험 설계에 라이브 셀 실험을 포함할 수 있으며, 이는 회전 디스크 컨포칼의 초고속 이미징 속도 및 다중 채널 획득 기능을 통해 더욱 향상됩니다. | EB3 단백질은 Hela 라이브 셀에서 확장되는 미세소관의 상단에 결합됩니다. EB3 단백질은 유전자 변형을 통해 GFP로 표지되었습니다.*1 이미지 데이터 제공: 국립 첨단 산업 과학 기술 연구소 생물 의학 연구소 Kaoru Kato 박사 |
연구 간소화IXplore SpinSR 현미경 시스템을 기존 실험 및 표본 프로토콜에 쉽게 통합시킬 수 있습니다. 버튼 클릭 한 번으로 동일한 표본을 사용하여 광시야, 컨포칼 및 초고해상도로부터 전환할 수 있습니다. 나머지는 현미경이 관리합니다. cellSens 소프트웨어의 이미지 분석 도구를 사용하여 이미지 데이터를 더욱 향상시킬 수 있습니다. 소프트웨어의 효율적인 워크플로를 통해 사용자는 데이터를 효과적으로 관리하고 고급 분석을 수행하여 새로운 통찰력을 얻을 수 있습니다. TruSight 디콘볼루션 알고리즘은 OSR 알고리즘과 원활하게 작동되도록 설계되어 과도한 처리를 방지합니다. 두 알고리즘이 결합하면 더 선명하고 깨끗한 이미지를 제공합니다. |
|---|
표본 내부의 초고해상도 세부 정보 표시세포 내 구조를 관찰하려면 초점이 맞지 않는 형광이 최종 이미지의 실제 데이터를 흐리게 하지 않도록 해야 합니다. IXplore SpinSR 현미경 시스템은 컨포칼 광학 시스템을 통합하여 실리콘 오일 광학을 비롯한 다양한 대물 렌즈를 사용할 수 있어 두꺼운 표본에서도 흐림이 적은 선명한 초고해상도 영상을 촬영할 수 있습니다. 또한 특별한 형광단이나 이미징 버퍼가 필요하지 않으므로 초고해상도로 변환하고자 할 때 표본이나 준비 프로토콜을 변경할 필요가 없습니다. | 관련 영상2주간 성상 교세포와 공동 배양 후 EGFP로 표지된 주의 라벨이 붙은 쥐의 1차 신경 세포의 타임 랩스 이미지. 미성숙한 척추(노란색 화살표)와 성숙한 척추(파란색 화살표)의 차이를 쉽게 알 수 있으며, 시간에 따른 형태학적 변화를 탐지할 수 있습니다. 3D는 노출 시간 프레임당 500ms, 41개의 슬라이스에 대해 0.15um Z 스텝로 촬영되었습니다. 이미지는 1시간 동안 2분마다 촬영되었습니다. FV31S-DT로 표시되는 3D. 이미지 데이터 제공: Yuji Ikegaya 박사 |
|---|
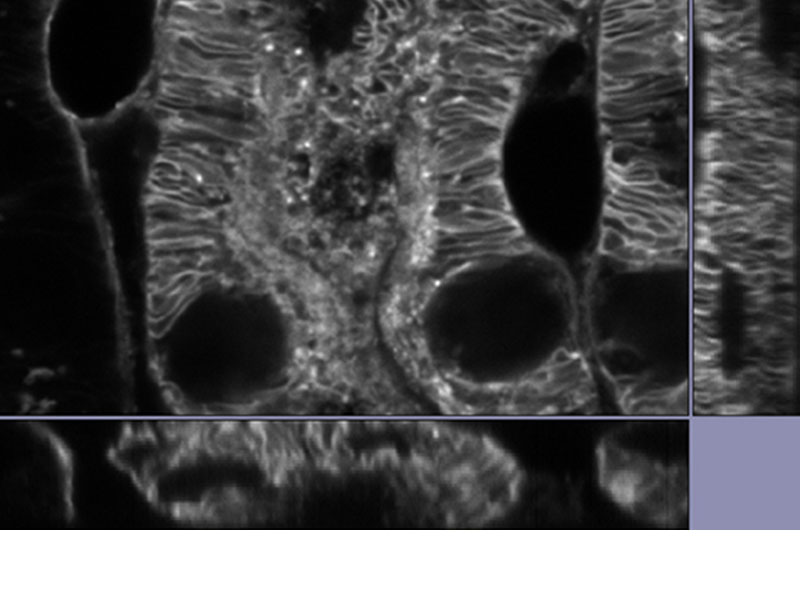 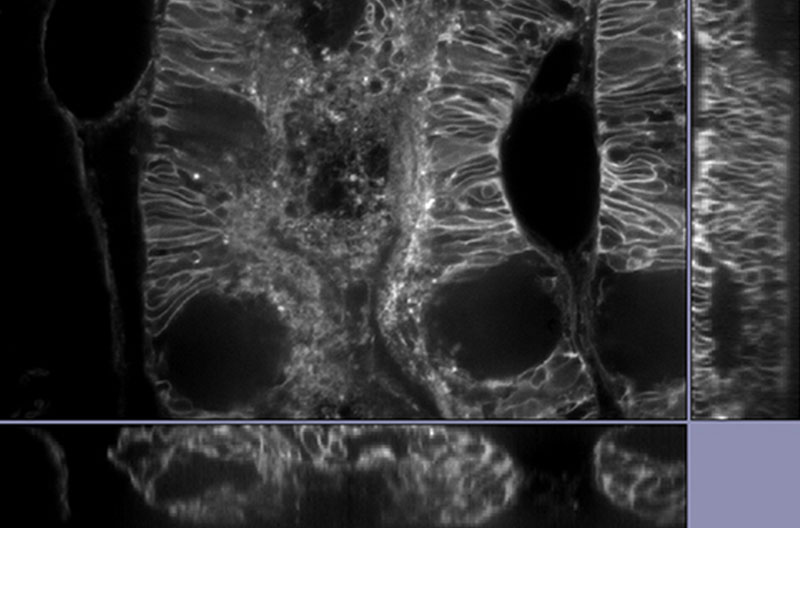 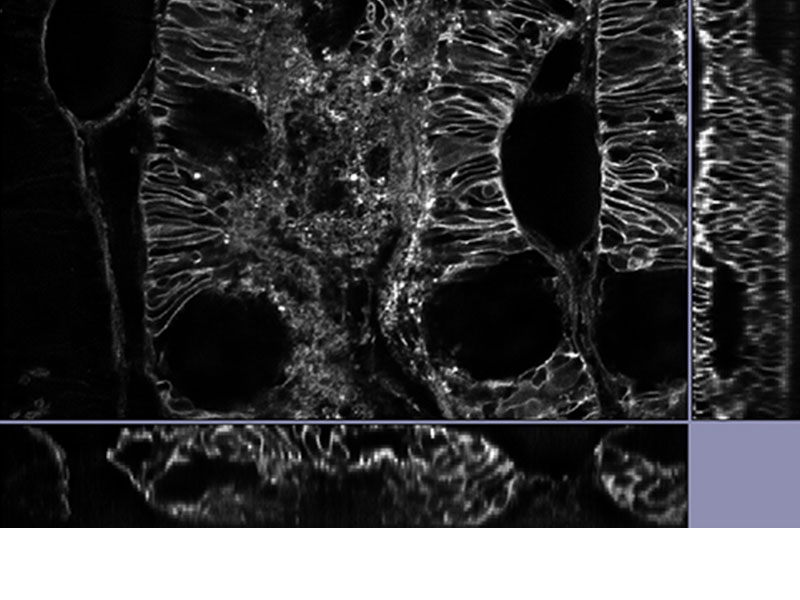 | 데이터 공개당사의 TruSight 디콘볼루션은 초고해상도와 결합하여 디콘볼루션만 단독 사용할 때보다 더 깨끗하고 선명한 이미지를 제공합니다. 3D 제약 반복 디콘볼루션은 더 선명한 3D 이미지를 위해 Z 축의 블러링을 제거합니다.
*이미지: 알렉사488로 염색된 쥐의 신장 조직 |
|---|
2색 동시 이미징Ixplore SpinSR 시스템은 두 대의 카메라를 동시에 사용하여 빠른 2색 국소화 초고해상도 이미징을 제공합니다. 이는 기존 형광단과 레이저 라인을 사용하여 달성됩니다. |
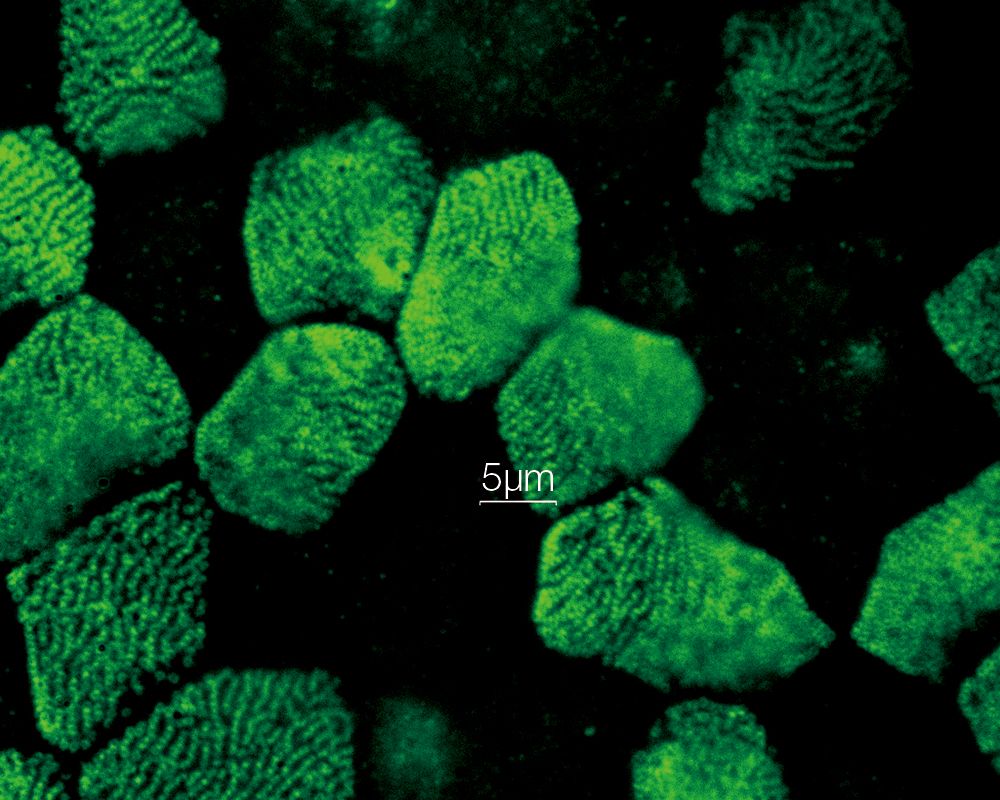
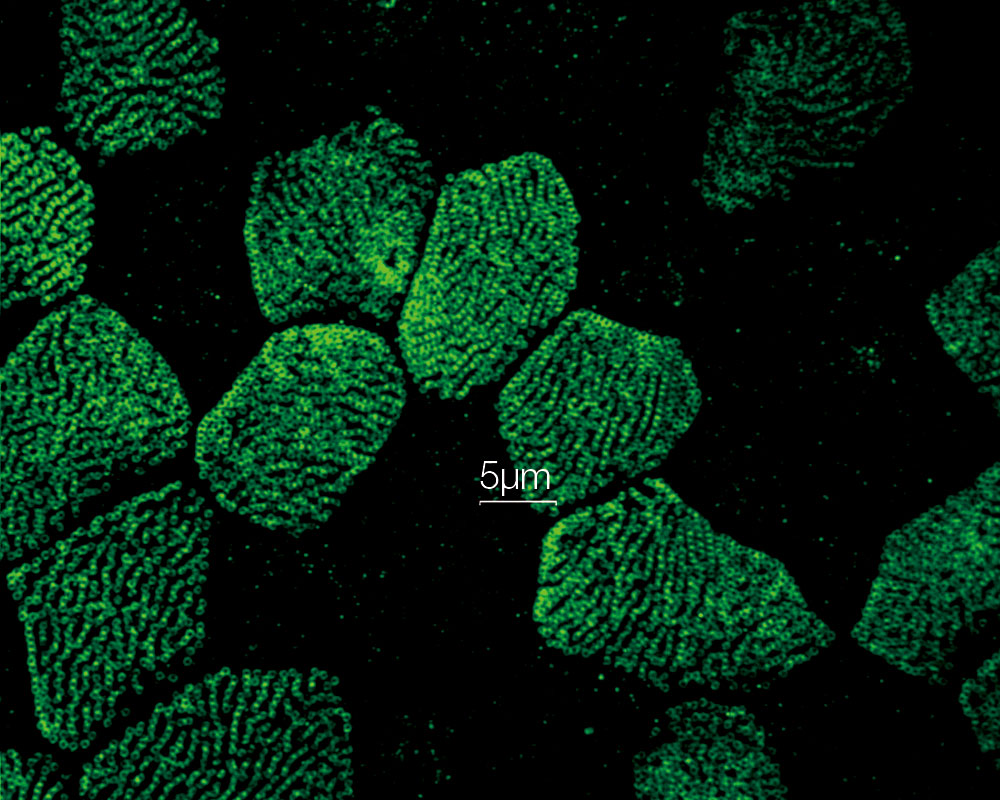
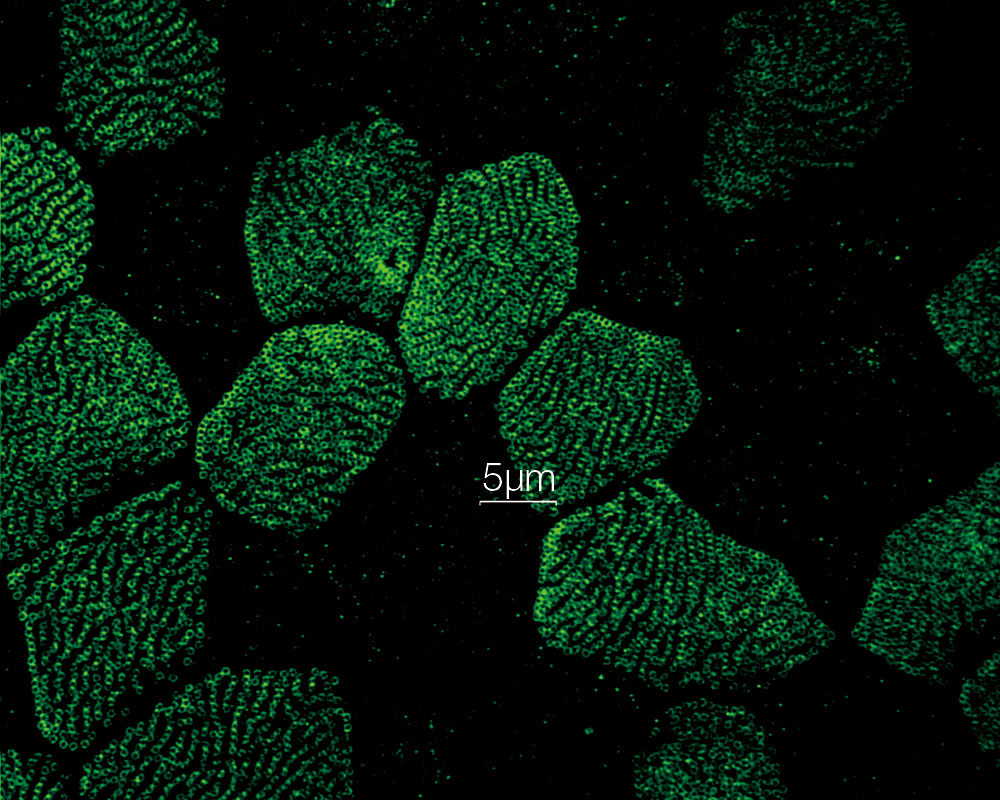
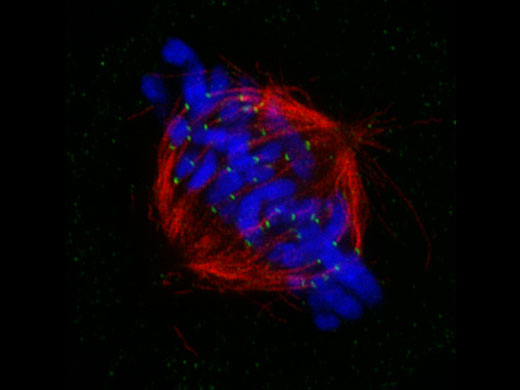
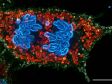
중기세포에서의 유사 분열 방추*1 인간 자궁경부암에서 유래한 HeLa 세포를 각각 α-튜블린(미세소관, 빨간색) 및 Hec1(동원체, 초록색)에 대해 고정되고 염색했습니다. DNA는 DAPI(염색체, 파란색)로 염색했습니다.. 염색체는 염색체의 중심 영역에 조립된 동원체를 통해 유사 분열 방추를 구성하는 미세소관과 상호 작용합니다. |
Hela 세포의 핵공 복합체 Nup153(알렉사488 : 초록색), Nup62(알렉사555 : 빨간색) |
참고문헌S. Hayashi and Y. Okada, “Ultrafast superresolution fluorescence imaging with spinning disk confocal microscope optics,” Mol. Biol. Cell 26(9), 1743–1751 (2015). S. Hayashi, “Resolution doubling using confocal microscopy via analogy with structured illumination microscopy,” Jpn. J. Appl. Phys. 55(8), 082501 (2016). A. Nagasawa-Masuda and K. Terai, “Yap/Taz transcriptional activity is essential for vascular regression via Ctgf expression and actin polymerization,” PLoS ONE 12(4), e0174633 (2017). H. Nakajima, et al., “Flow-Dependent Endothelial YAP Regulation Contributes to Vessel Maintenance,” Dev. Cell 40(6), 523-536.e6 (2017). K. Tateishi, et al., “Three-dimensional Organization of Layered Apical Cytoskeletal Networks Associated with Mouse Airway Tissue Development,” Sci. Rep. 7, 43783 (2017). E. Herawati, et al., “Multiciliated cell basal bodies align in stereotypical patterns coordinated by the apical cytoskeleton,” J. Cell Biol. 214(5) 571-586 (2016). M.-T. Ke, et al., “Super-Resolution Mapping of Neuronal Circuitry With an Index-Optimized Clearing Agent,” Cell Rep. 14(11) 2718-2732(2016). |
*1 비록 헬라 세포가 의료 연구에서 가장 중요한 세포주가 되었다고 해도, 과학에 대한 Henrietta Lacks의 공헌이 동의를 받지 않은 것이었다는 것을 인정해야만 합니다. 이로 인해 면역학, 전염병, 암에 대한 중요한 발견이 이루어졌지만 사생활, 윤리, 의학적 동의에 대한 중요한 논의도 촉발되었습니다. |
도움이 필요하십니까? |
응용 기술
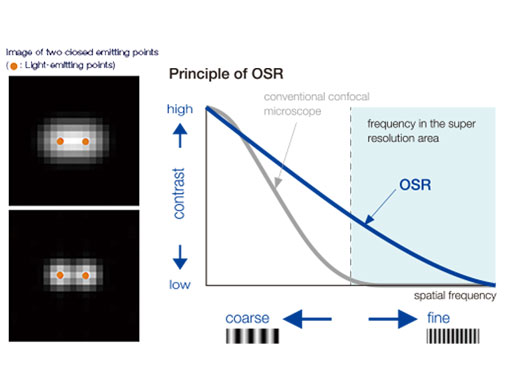
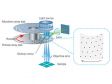
OSR 원리Olympus 초고해상도(OSR) 기술은 120nm까지의 측방향(XY) 분해능을 구현합니다. 컨포칼 이미지에서 높은 공간 주파수 데이터를 활용하도록 고유하게 설계되었습니다. 처리 후에 최종 이미지는 점 크기 감소를 통해 더 선명해질 뿐만 아니라 매우 가까운 구조에 대해 더 나은 해상도를 제공합니다. |
|
 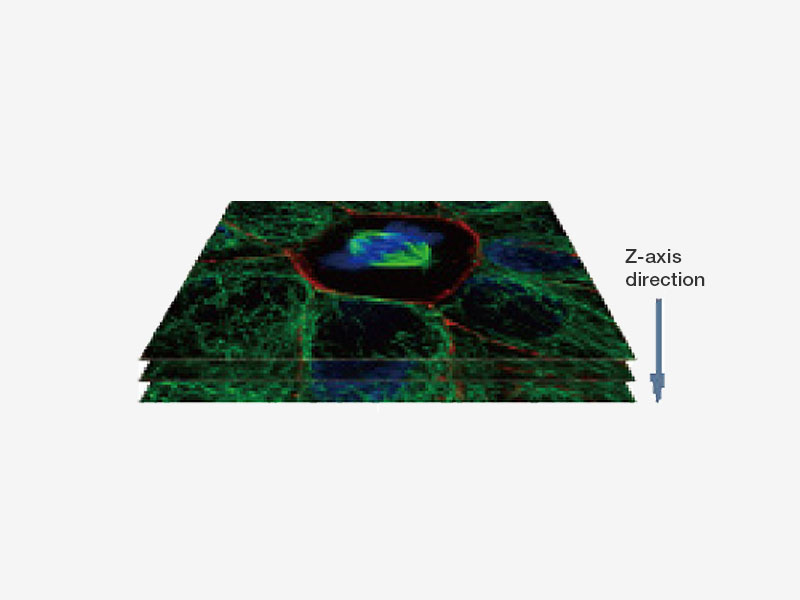 | 빠른 초고해상도 이미징 및 광시야SpinSR10의 민감한 이미징 센서는 전체 시야를 면밀하게 스캔하기보다 전체 표본 영역의 스냅샷을 한 번에 포착함으로써 빠른 이미징을 가능하게 하여 연구자들이 빠르게 진행되는 생물학적 현상을 관찰할 수 있도록 해줍니다. 현미경의 광학 시스템은 광시야 및 컨포칼 모드에서 18의 시야수(FN)를 지니므로 시야가 더 큰 이미지를 포착할 수 있으며, 사용자는 두 대의 카메라를 통해 듀얼 컬러 초고해상도 이미지를 동시에 촬영할 수 있습니다. 컨포칼 광학 시스템을 기반으로 한 올림푸스 초고해상도 기술은 배경이 감소된 선명한 초고해상도 영상을 획득할 수 있는 광절단을 가능하게 합니다. 응용 이미지 데이터 제공 : Hatsuho Kanoh, Tomoki Yano, Sachiko Tsukita |
|---|
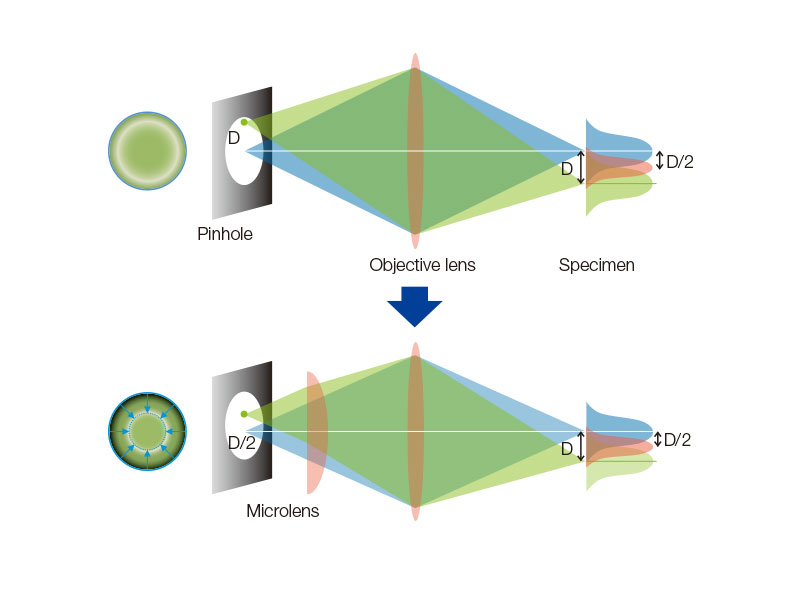
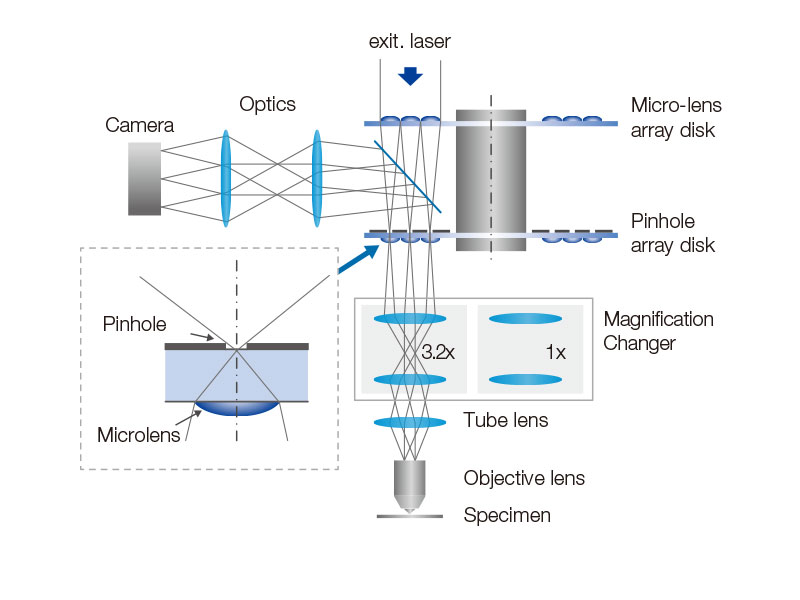
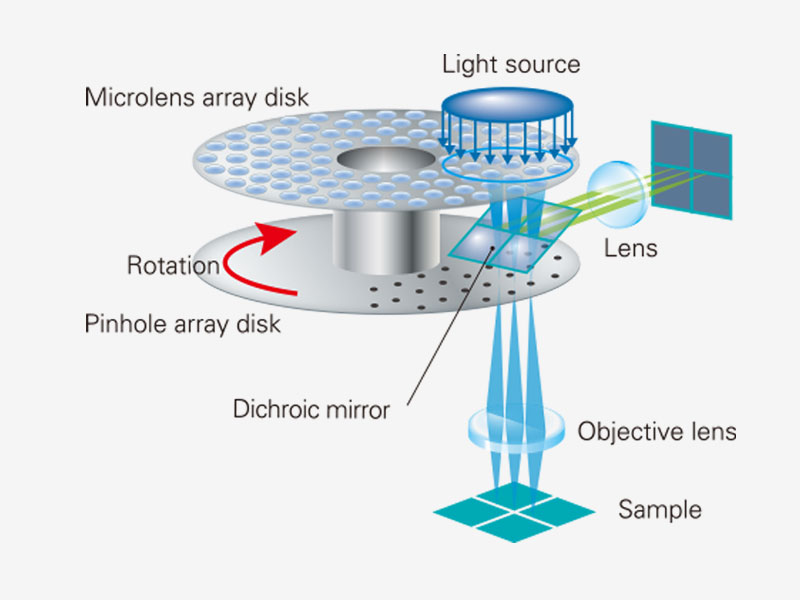
밝은 라이브 셀 이미징을 제공하는 회전 디스크SoRa 디스크가 장착된 고감도 모델은 컨포칼 핀홀에 마이크로 렌즈가 장착된 회전 디스크 덕분에 더 밝은 초고해상도 이미지 촬영을 구현합니다. 각 컨포칼 핀홀은 더 낮은 레이저 출력으로 이미지를 촬영할 수 있으므로 표본의 광표백 및 광독성을 줄이는 동시에 밝은 초고해상도 이미지를 구현할 수 있습니다.
일반 컨포칼 현미경에서는 조명 점상 강도 분포 함수(PSF)와 검출 PSF에 의해 결상이 이루어집니다. 광축의 D 위치에 있는 핀홀의 결상은 조명 PSF와 검출 PSF에 의해 이루어집니다. 광축의 D/2 위치에서 나오는 정보는 전달되지만 분해되지 않는다는 것을 확인할 수 있습니다. 이를 교정하기 위해 마이크로렌즈를 핀홀에 장착하고, 핀홀에 투사된 개별 초점을 광학적으로 중앙에 재지정하여 이상적인 이미지를 생성하며, 밝기와 해상도를 높입니다. 이런 과정은 핀홀의 크기를 극히 작게 줄인 이상적인 컨포칼 현미경에 필적하는 해상도를 만들어냅니다. 참고문헌: T. Azuma and T. Kei, “Super-Resolution Spinning-Disk Confocal Microscopy Using Optical Photon Reassignment” 옵틱스 익스프레스 23호, 15003-15011 (2015). |
| 시야 전체에 걸친 고른 조명IX83P2ZF 도립 현미경용으로 설계된 배율 변환기는 전체 시야에서 균일한 조명을 제공합니다. 변환기의 텔레센트릭 광학 시스템은 대물 렌즈의 성능을 극대화하는 동시에 컨포칼과 초고해상도 간의 매끄러운 전동 전환을 가능하게 합니다. |
|---|
향상된 Z 해상도올림푸스 실리콘 이멀젼 대물렌즈는 심부 조직 관찰을 위해 설계되었습니다. 관측 깊이는 굴절률 불일치에 의한 구면 수차로 인해 부정적인 영향을 받습니다. 실리콘 오일의 굴절률(ne=1.40)은 라이브 셀 또는 배양된 조직 슬라이스(ne=1.38)의 굴절률에 가깝기 때문에 최소한의 구면 수차로 수십 마이크로미터 깊이에서 내부 세포 구조에 대한 초고해상도 이미징이 가능합니다. | 관련 영상 |
|---|
| 구면 수차 감소원격 보정환 장치는 굴절률 불일치로 인한 구면 수차를 보정하기 위해 대물렌즈 내의 렌즈 위치를 조정하는 데 사용되어 신호, 해상도 및 대비를 크게 향상시킵니다. IX3-RCC 장치는 보정환이 장착된 모든 Olympus UIS2 대물렌즈와 함께 작동합니다. |
|---|
감소된 광독성라이브 셀와 관련된 실험을 위해 설계된 회전 디스크는 광독성과 표백을 줄여줍니다. Olympus 실시간 제어기(U-RTCE)는 자동 촬영 중에 장치의 속도와 정밀도를 최적화하며, TruFocus 시스템은 각 프레임에 대한 초점을 유지하고 데이터 수집 중에 표본에 대한 응력을 줄여줍니다.
|
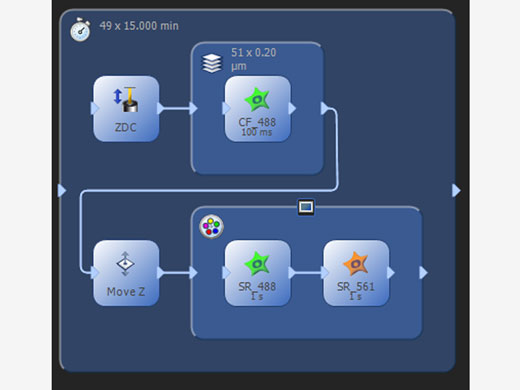 | 복잡한 실험 관리프로세스 관리자는 다색, Z 스택 및 타임 랩스 이미지를 쉽게 촬영할 수 있습니다. 프로그래밍 가능한 그래픽 실험 관리자(GEM)를 통해 사용자는 시각적 인터페이스에서 보다 복잡한 자동화를 설계하여 다양한 실험 이미징 프로토콜 및 장치 트리거링을 지원할 수 있습니다. 이미징 프로세스 중에 언제든지 필요에 따라 쉽게 변경할 수 있는 유연한 실험 프로토콜을 사용자가 정의할 수 있습니다. |
|---|
도움이 필요하십니까? |
사양
| Microscope Frame | IX83P2ZF | |
|---|---|---|
| Observation Method > Super Resolution | ✓ | |
| Observation Method > Confocal | ✓ | |
| 관찰 방법 > 형광(Blue/Green Excitation) | ✓ | |
| 관찰 방법 > 형광(Ultraviolet Excitation) | ✓ | |
| 관찰 방법 > 미분간섭(Differential Interference Contrast) | ✓ | |
| 관찰 방법 > 위상차(Phase Contrast) | ✓ | |
| 관찰 방법 > 명시야(Brightfield) | ✓ | |
| 리볼빙 노스피스 > 수동 > 전동 | ✓ | |
| 초점 > 전동 |
| |
| 초점 > 초점 흐름 보정기 | ✓ | |
| 경통 > Widefield (FN 22) > 꺽임형 이안경통(Tilting Binocular) | ✓ | |
| 조명 > 투과 퀠러 조명 > LED 램프 | ✓ | |
| 조명 > 투과 퀠러 조명 > 할로겐 램프 | ✓ | |
| 조명 > 형광 조명 > 수은 램프 | ✓ | |
| 조명 > 형광 조명 > 라이트 가이드 조명 | ✓ | |
| Fluorescence Mirror Turret > Motorized (8 position) | ✓ | |
| 재물대 > 전동 | Contact your local sales representative to hear about motorized stage options | |
| 재물대 > 기계식 > IX3-SVR 오른손 잡이용 기계식 재물대 |
| |
| 재물대 > 기계식 > IX3-SVL Mechanical Stage with Left Short Handle |
| |
| 집광기 > 자동 > 범용 집광기 | W.D. 27 mm, NA 0.55, motorized aperture and polarizer | |
| 집광기 > 수동 > 범용 집광기 | NA 0.55/ W.D. 27 mm | |
| 집광기 > 수동 > 매우 긴 작동거리의 집광기 | NA 0.3/ W.D. 73.3 mm | |
| Confocal Scanner | CSU-W1 | |
| Super Resolution Processing | Olympus super resolution (OSR) filter | |
| Accessories | Remote correction collar controller (IX3-RCC) | |
| 규격 | 323 (W) x 475 (D) x 706 (H) mm (IX83 microscope frame) | |
| 중량 | Approx. 47kg (IX83P2ZF) |
애플리케이션 갤러리
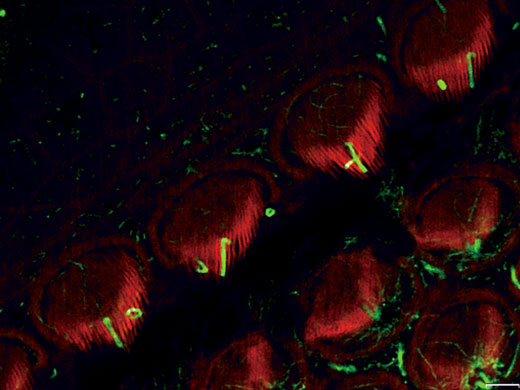
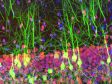
코르티 기관 내 내유모 세포의 섬모와 운동모(악틴 : 주황색, 튜불린 : 초록색) 이미지 데이터 제공: Hatsuho Kanoh1, Toru Kamitani1,2, Hirofumi Sakaguchi2, Sachiko Tsukita1 |
|
관련 영상 | 유사 배양 상피 세포 (염색체: 파란색, 튜블린: 초록색, ZO1: 빨간색) 이미지 데이터 제공: Hatsuho Kanoh, Tomoki Yano, Sachiko Tsukita |
|---|
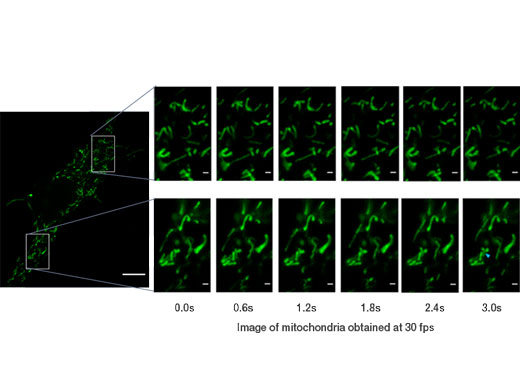
GFP로 표지된 미토콘드리아. 30 fps로 촬영되어 개별적인 미토콘드리아의 움직임을 볼 수 있습니다. 이미지 데이터 제공: 도호쿠 대학교 공학 대학원 Kumiko Hayashi 박사 |
|
|---|
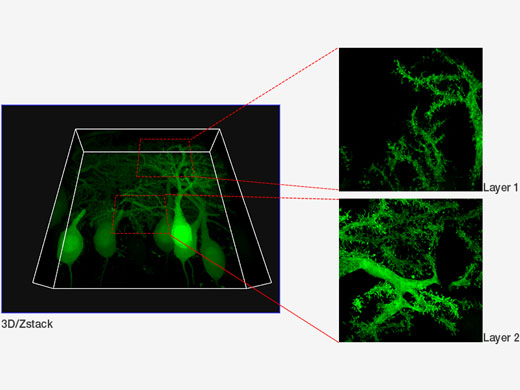 | GFP로 표지된 퍼킨제 세포 다양한 Z 위치에 있는 컨포칼 및 초고해상도 이미지의 XYZ 이미지. 초고해상도 이미지는 Z(10 슬라이스)로 투사됩니다. FV31S-DT로 표시되는 3D. 이미지 데이터 제공: Yukari Takeo, Michisuke Yuzaki, PhD., 게이오 대학교 의과 대학 생리학과 |
|---|