Análise 3D de organoides tumorais derivados de pacientes
Foram analisadas quantitativamente imagens confocais de organoides tumorais derivados de pacientes (PDO — Patient-Derived tumor Organoids) usando o software NoviSight™ 3D para avaliar suas características morfológicas e ligação de anticorpos de medicamentos com alvo molecular.
Introdução
Os modelos de tecido 3D são populares para a descoberta de medicamentos, uma vez que simulam o microambiente in vivo. PDOs são uma das ferramentas mais poderosas para recapitular a resposta original do paciente ao medicamento. Na verdade, um estudo recente revela que os perfis fenotípicos e genotípicos dos PDOs apresentam um alto grau de semelhança com o tumor original do paciente. Principalmente, os PDO poderiam prever a reatividade a medicamentos com mais de 80% de exatidão.
Ao usar organoides tumorais derivados de pacientes de Fukushima (F-PDO®), o microscópio confocal de varredura a laser FLUOVIEW® FV3000 da Olympus e o software de análise NoviSight 3D, oferecemos um novo processo de trabalho para a morfologia do PDO e a distribuição de medicamentos.
Resumo gráfico
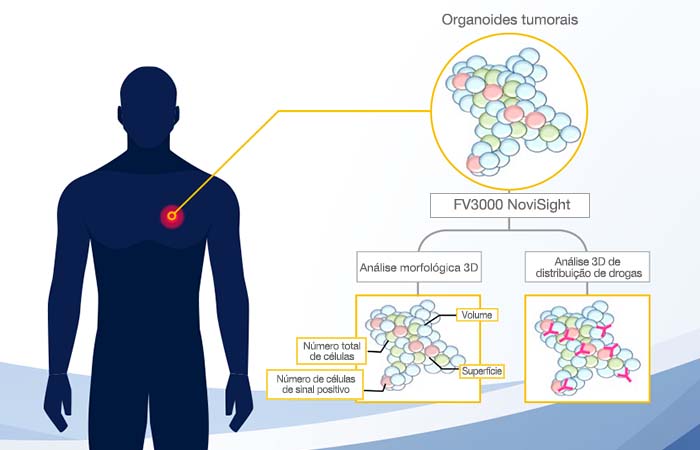
Benefícios
- Gere imagens e analise PDO enquanto retém as informações em sua estrutura 3D.
- O software NoviSight pode identificar objetos em 3D, classificar os objetos e fornecer dados estatísticos.
Métodos
Preparação de células
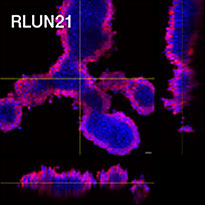
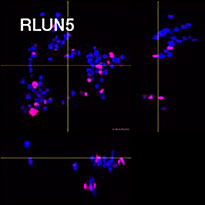
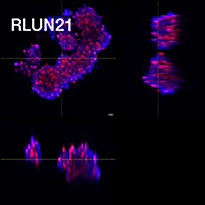
Para preparar as células, usamos três tipos de F-PDOs de pulmão (RLUN5, RLUN16 e RLUN21). RLUN5 foi cultivado a partir de um tumor de carcinoma adenoescamoso, enquanto RLUN16 e RLUN21 foram cultivados a partir de um tumor de carcinoma escamoso. RLUN21 forma grandes agregados de células e apresenta um citoplasma maior do que os outros (Fig. 1).
Os F-PDOs foram então centrifugados, coletados e fixados com paraformaldeído a 4% de um dia para o outro. Erbitux®, um inibidor do receptor do fator de crescimento epidérmico (EGFR — Epidermal Growth Factor Receptor), e Herceptin®, um inibidor do receptor 2 do fator de crescimento epidérmico humano (HER2), foram marcados com HiLyte™ Fluor 555 (Chemical Dojin) e incubados com F-PDOs por três horas.
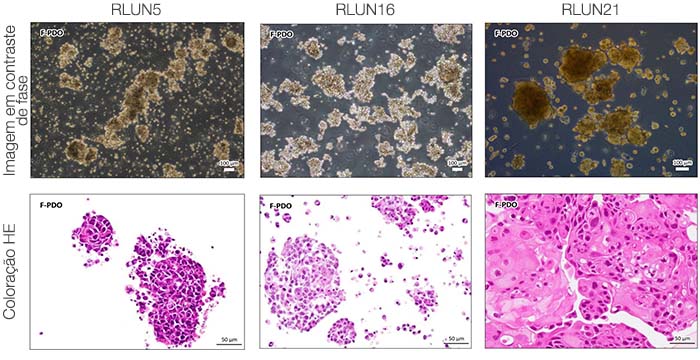
Figure 1 F-PDOs
Imunocoloração e limpeza
Realizamos o protocolo de imunocoloração Hama et al. com algumas modificações (Fig. 2). Cada F-PDO fixado foi incubado de um dia para o outro com um anticorpo Ki67 (Abcam, 16667) e diluído com a solução AbScale (0,33 M de ureia e 0,2% de Triton-X100). Após lavagem com AbScale, os F-PDOs foram incubados com um segundo anticorpo por três horas e diluídos com AbScale. Após lavagem com a solução de enxágue AbScale por uma hora, os F-PDOs foram fixados novamente com paraformaldeído a 4%. Em seguida, foram lavados com uma solução salina tamponada com fosfato (PBS — Phosphate-Buffered Saline) e incubados de um dia para o outro usando o reagente de limpeza ScaleS4 com DAPI. Então, foram feitas imagens dos F-PDOs limpos com o microscópio confocal de varredura a laser FV3000 da Olympus.

Figura 2 Esquema de imunocoloração e limpeza dos F-PDOs
Formação de imagem e análise
Usamos um aumento de 10× ou 30× com 2 μm de Z-pitch para capturar imagens dos F-PDOs limpos para análise 3D.
Uma configuração de Z-pitch apropriada é importante para uma análise exata de células 3D. As imagens foram então importadas para o software NoviSight™ e reconstruídas em 3D. O software NoviSight pode reconhecer objetos 3D, como um núcleo, e convertê-los em dados quantitativos.
Resultados
Quantificação 3D da morfologia dos F-PDOs
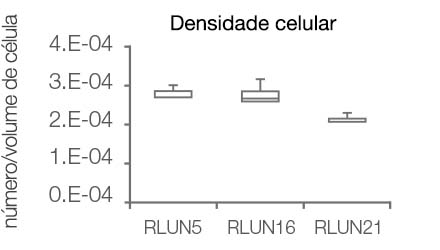
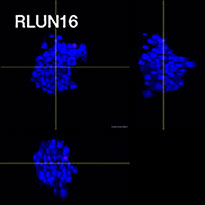
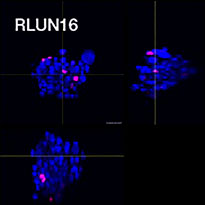
O software NoviSight nos permitiu quantificar os PDOs usando várias imagens de plano Z. Ao colorir seus núcleos, o software de análise capturou toda a estrutura e permitiu o reconhecimento de uma única célula (Fig. 3A). Ele também adicionou cada objeto reconhecido no gráfico como uma única representação gráfica. Quando o software reconheceu cada núcleo como um objeto, extraímos células Ki67 positivas tanto graficamente quanto tridimensionalmente gerando representações gráficas de alta intensidade de Ki67 (Fig. 3B). Usando esses métodos, quantificamos o número de células, o volume, a densidade celular e a proporção de células Ki67 positivas do F-PDO (Fig. 3C). Descobrimos que a proporção de células Ki67 positivas de RLUN21 era menor do que a dos outros. Além disso, o citoplasma maior RLUN21 pode ter causado sua baixa densidade celular.
A | |||
 RLUN21 original | 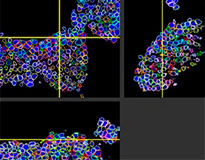 Reconhecimento nuclear | 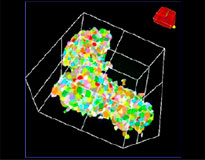 Visualização do volume do reconhecimento nuclear | 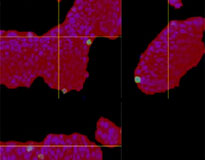 RLUN21 |
B![As células Ki67 positivas/negativas foram classificadas pela intensidade de Ki67. O software NoviSight pode exibir células classificadas em uma [visualização de galeria].](https://static1.olympus-lifescience.com/data/Image/Application/novisight-analysis/appnote_novisight-analysis_06.jpg?rev=CF80) | C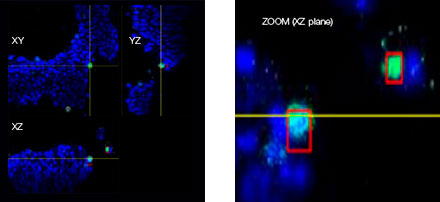 |
D
| RLUN5 | RLUN16 | RLUN21 | |
| número de células | 926 (±719) | 294 (±162) | 2595 (±1480) |
| volume (voxels) | 3.35.E+06 (±3.26.E+06) | 1.08.E+06 (±6.85.E+05) | 1.13.E+07 (±9.12.E+06) |
 | 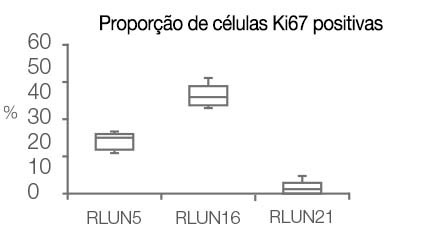 |
| Figura 3 Quantificação 3D da morfologia dos F-PDOs |
A. Três visualizações laterais originais de RLUN21, reconhecimento nuclear NoviSight 3D (visualização de três lados e do volume) e reconhecimento da estrutura do NoviSight.
B. As células Ki67 positivas/negativas foram classificadas pela intensidade de Ki67. O software NoviSight pode exibir células classificadas em uma “visualização de galeria”.
C. As células Ki67 positivas classificadas podem ser exibidas em 3D com um círculo vermelho.
D. Dados quantitativos dos F-PDOs.
Análise 3D de distribuição de medicamentos
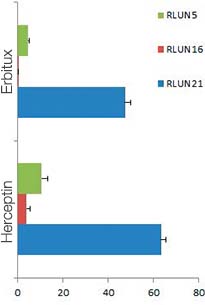
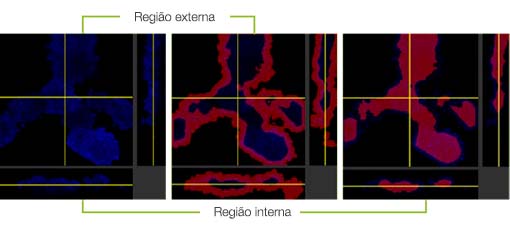
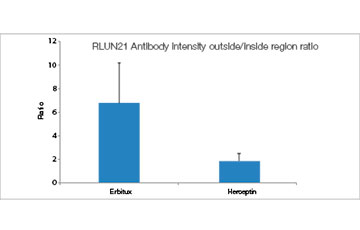
Quando adicionamos o Erbitux ou Herceptin marcado com HyLight-555 a cada F-PDO, o Erbitux ligou-se uniformemente a RLUN21 a partir de sua superfície, enquanto o Herceptin ligou-se irregularmente a RLUN21. O módulo de reconhecimento de volume do software NoviSight™ quantificou a proporção de volume positivo do medicamento anticorpo (Fig. 4A). Em seguida, usamos o software NoviSight para quantificar a diferença nos estilos de ligação, já que ele pode modificar a região direcionada para análise. Para isso, criamos duas regiões alvo: uma região de volume reduzido a partir da superfície em uma certa porcentagem e uma região de volume de contorno com qualquer largura. Calculamos a intensidade dos medicamentos anticorpos durante os volumes. Notamos uma grande diferença quantitativa entre o volume reduzido e o volume de contorno no Erbitux, enquanto havia pouca no Herceptin. Isso significa que o Erbitux se ligou fortemente à região de contorno de RLUN21, enquanto o Herceptin se ligou a RLUN21 sem parcialidade. Este método permitiu mostrar quantitativamente a distribuição de medicamentos anticorpos.
A
 |
 |
| Reconhecimento do volume de medicamentos anticorpos 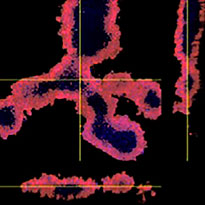 |
|
 |
| Reconhecimento do volume de medicamentos anticorpos 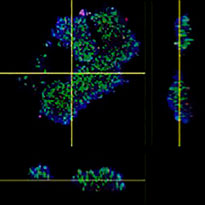 |
Volume positivo de anticorpos (%)
B
 |  |
| Figura 4 Quantificação 3D da distribuição de medicamentos anticorpos |
A. Três imagens laterais dos F-PDOs com Erbitux ou Herceptin e reconhecimento do volume das ligações de medicamentos anticorpos do NoviSight. O gráfico mostra o volume de ligação de anticorpos no volume total.
B. Módulo de modificação da região do NoviSight. O NoviSight pode modificar a região direcionada para análise para fornecer dados quantitativos na região limitada.
Conclusão
Neste estudo, revelamos que o software NoviSight pode realizar análises quantitativas de PDOs de forma morfológica e farmacológica usando imagens capturadas pelo microscópio confocal de varredura a laser FV3000 da Olympus. Ao combinar as imagens de alta resolução do microscópio FV3000 com a alta exatidão de reconhecimento do software NoviSight, podemos produzir resultados quantitativos mais confiáveis.
Reference
- Vlachogiannis G et al., (2018) Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359(6378):920-926. doi: 10.1126/science.aao2774
- Takahashi et al., (2019) An In Vitro System for Evaluating Molecular Targeted Drugs Using Lung Patient-Derived Tumor Organoids. Cells. 8(5), 481. doi:/10.3390
- Tamura H, et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep.,40, 635-646, 2018
- Hama et al., (2016) Deep Imaging of Cleared Brain by Confocal Laser-Scanning Microscopy. Nature Protocol Exchange. doi:/10.1038 Mayu
Autores
Mayu Ogawa (Olympus)
Reconhecimento
Este estudo foi apoiado pelo Professor Takagi da Fukushima Medical University. Para saber mais sobre os F-PDOs (organoides derivados de pacientes de Fukushima), visite https://www.fmu.ac.jp/home/trc/en/contract-research-provision/f-pdo/
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.