Talvez você tenha se afastado de sua pesquisa devido a uma paralisação do laboratório, uma licença planejada ou uma emergência repentina. Não importa a situação, voltar ao trabalho laboratorial depois de um tempo longe pode ser assustador. Como você se organiza, configura seus experimentos e atinge seus objetivos?
Para facilitar a transição para o laboratório, criamos este guia de quatro etapas para colocar seus experimentos em funcionamento
1. Ligue o equipamento
Embora essa questão possa parecer sem importância, a realidade é que ligar o equipamento de maneira inadequada pode afetar negativamente o desempenho do sistema. Aqui estão algumas diretrizes gerais a serem seguidas:
- Ligue o computador primeiro: seu PC é o ‘cérebro’ do seu sistema de microscópio, então lembre-se, em primeiro lugar, de ligar e fazer logon no PC.
- Ligue todos os componentes do sistema: dependendo do seu sistema, a ordem de ativação dos componentes pode ser importante. Por exemplo, o CBH nos sistemas Olympus deve ser ligado antes do TPC. Consulte o seu manual para obter instruções específicas.
- Inicie o software: se você encontrar erros durante a inicialização do software, estamos aqui para ajudar! Fale com seu representante de vendas local ou clique aqui para assistência técnica.
2. Prepare-se para a geração de imagens
Assim que seu equipamento estiver ligado, reserve um tempo para preparar, carregar e nivelar adequadamente sua amostra para geração de imagens. Aqui estão seis dicas úteis:
Preparar a amostra
Primeiro, selecione a lamínula apropriada. As lamínulas devem ter #1,5 ou 0,17 mm de espessura (170 µm). As objetivas Olympus projetadas para lamínulas precisam da espessura certa para uma boa qualidade de imagem. Se a lamínula for muito espessa ou muito fina, podem ocorrer artefatos ópticos.
Certifique-se de verificar a espessura da lamínula e use lâminas de vidro padrão. Para algumas aplicações, pode-se usar lâminas de plástico. Mas em imagens de fluorescência, o plástico é muito autofluorescente. Isso causa um fundo forte nos canais azuis e verdes e, às vezes, nos canais vermelhos.
Limpar a lamínula e a lâmina antes da imagem também é importante. Uma boa solução de limpeza é o etanol 70% em água destilada. Outra opção é um limpador óptico, como Sparkle Optical Lens Cleaner da A.J. Funk and Co.
Quando limpar a óptica, sempre use papel para lentes. Os tecidos faciais ou de laboratório são abrasivos e podem danificar as superfícies ópticas.
Colocar a amostra
Em seguida, carregue a amostra preparada na orientação correta para o seu microscópio. Sempre carregue as lamínulas voltadas para cima em um microscópio vertical e para baixo em um microscópio invertido.
Com microscópios invertidos, é importante verificar se sua amostra está bem selada. Se a amostra não estiver bem selada, o líquido pode entrar em contato com as objetivas ou o porta-objetivas. Este líquido pode corroer ou oxidar revestimentos ópticos, cola óptica ou outras partes do hardware e dos componentes eletrônicos do microscópio.
Ao carregar a amostra, preste atenção especial à distância de trabalho da objetiva. Em termos simples, a distância de trabalho é o quão perto a objetiva deve estar para focar no espécime. As distâncias de trabalho podem variar de um pouco mais de 100 µm a vários milímetros.
Precisa encontrar a distância de trabalho da sua objetiva? Basta verificar as especificações inscritas ou nosso catálogo de objetivas online.

Figura 1. Os microscópios invertidos requerem que as lâminas sejam carregadas de cabeça para baixo. Um erro comum é carregar as lâminas com a lamínula voltada para cima em um microscópio invertido, levando a uma imagem borrada. Sempre verifique se as superfícies ópticas estão limpas e use papel para lentes para limpar essas superfícies.
Nivelar a amostra
Os pesquisadores geralmente não precisam se preocupar com o nivelamento da amostra em muitas situações. A platina é fixa e plana, o porta-amostras é plano e a lâmina é plana.
Ainda assim, em aplicações mais sensíveis como microscopia confocal, TIRF ou tiling, a planura da amostra é crítica. Quando a amostra é inclinada, pode ocorrer sombreamento. O sombreamento pode levar a artefatos ao unir imagens ou mudanças na intensidade com base em sua posição na imagem.
Uma maneira de melhorar o nivelamento da amostra é por meio dos parafusos de nivelamento encontrados em alguns suportes da platina. Normalmente, eles estão localizados nos cantos dos suportes da platina. Parafusos de nivelamento desalinhados são uma fonte comum de inclinação da amostra. Retirar totalmente esses parafusos é uma abordagem razoável se você estiver preocupado com a inclinação da amostra proveniente no suporte da platina.
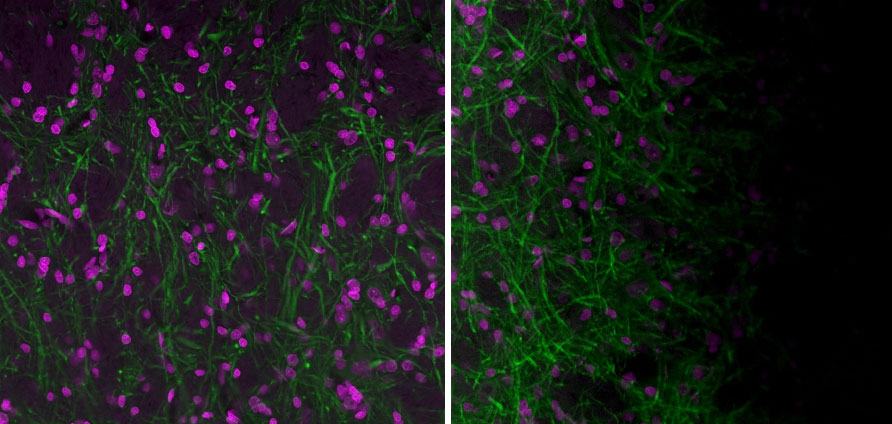
Figura 3. Esquerda: imagem adquirida com um microscópio confocal de varredura a laser Olympus FV3000 bem alinhado e uma amostra plana. Direita: Imagem adquirida com um microscópio FV3000 bem alinhado, mas uma amostra que não é plana. Às vezes é difícil determinar a origem do sombreamento. Frequentemente, uma amostra que não está plana no suporte de amostra pode causar o artefato de sombreamento. Imagens adquiridas com objetiva UPlanXApo 20X. Magenta é Hoechst e verde é MAP2 (MCA-5H11) corado com Alexa 488.
Determinar o meio de imersão
A Olympus oferece cinco tipos principais de objetivas: ar, imersão em água, imersão de contato em água, óleo padrão e óleo de silicone. Se o meio de imersão errado for usado na objetiva, a qualidade da imagem será prejudicada. Além disso, pode causar danos se o óleo entrar em certas partes de uma objetiva que não foi projetada para uso com óleo.
Por essas razões, é fundamental saber o meio de imersão projetado para suas objetivas. Nossas objetivas são codificadas por cores para que você possa reconhecer facilmente o meio de imersão necessário e usar o meio correto.
Além disso, considere seu fluxo de trabalho. Você pode não querer obter imagens a 60X com óleo de silicone e, em seguida, mudar imediatamente para uma objetiva 60X de imersão em água. A mistura de óleo de silicone e água não resultará em imagens nítidas. Além disso, a lâmina precisaria ser removida e limpa antes de usar a imersão em água.
Por fim, certifique-se de usar óleo do fabricante das suas objetivas, pois ele foi projetado para sua óptica.

Figura 4. Óleo padrão ou óleo de imersão tipo F (à esquerda) e óleo de imersão de silicone (à direita). A Olympus oferece muitas lentes para óleo padrão e várias para óleo de imersão de silicone. Certificar-se de usar o óleo correto é vital para o sucesso da imagem. Evite misturar esses dois óleos em uma lamínula.
3. Adquirir imagens
Agora que você preparou sua amostra, pode passar para a etapa de aquisição da imagem. Aqui estão algumas dicas úteis para captura de imagens:
Melhores práticas para aquisição de imagens
Ao adquirir imagens por meio de microscopia confocal ou de fluorescência de campo amplo, geralmente é preferível usar baixa iluminação e maior sensibilidade de detecção ou ganho. Isso reduz a radiação nociva do laser ou da lâmpada de arco que causa fotodegradação e alterações na biologia.
Certos canais iônicos e áreas apagadas podem ser ativados pela luz de excitação. No entanto, deve-se usar iluminação suficiente para produzir uma imagem de qualidade adequada. A alta iluminação pode gerar uma bela imagem. Considere como equilibrar luz para excitação e luz para detecção e o objetivo final do experimento.
Colar de correção
Algumas de nossas objetivas possuem um colar de correção. Isso pode ser confuso de usar sem o treinamento adequado. As diretrizes gerais incluem:
- Use 0,0 quando não usar lamínula ou 0,17 para lamínula #1.5.
- Verifique se o colar de correção está marcado para temperatura. Algumas objetivas têm escalas diferentes dependendo da temperatura ambiente ou a 37 °C (98,6 °F). Defina o colar de correção, comece a geração de imagens e otimize o colar de correção enquanto mantém o foco para o brilho da imagem. Esta última etapa requer paciência e prática. Se a otimização for impossível, fique perto das marcas gerais do colar de correção de 0,0 ou 0,17 como um primeiro passo.

Figura 5. Três objetivas 60X. A objetiva 60X UplanXApo (direita) usa óleo padrão e não possui colar de correção. A objetiva de óleo UplanApo 60X (esquerda) usa um colar de correção definido para 0,17 (lamínulas #1.5). O 60X UPlanSApo (centro) usa óleo de silicone e o colar de correção é definido para 0,17 (#1,5) a 37 °C (98,6 °F). Otimizar a posição do colar de correção pode ser fundamental para obter uma imagem nítida.
Alinhamento do condensador
Se a fluorescência for sua aplicação principal, o condensador pode não ser usado durante a operação normal do microscópio. Neste caso, use os botões do condensador para mover o condensador para longe da amostra.
Se você planeja usar campo claro, contraste de fase ou imagem DIC, a primeira etapa normalmente é verificar o alinhamento do condensador. No modo de campo claro, foque na amostra e feche a abertura do campo para visualizar as alhetas do condensador. Este processo é feito mais facilmente com aumento de 10x ou 20x.
Se as alhetas do condensador não estiverem nítidas ou centralizadas, alinhe o condensador na altura e/ou centralização executando a iluminação Köhler. Para encontrar informações sobre como alinhar o condensador pela iluminação Köhler, visite nosso Centro de recursos de microscopia online.
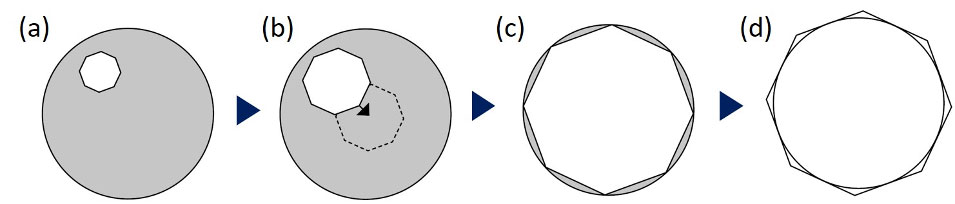
Figura 6. Procedimento de alinhamento do condensador: (a) feche a abertura do campo, (b) centralize o centro da alheta da abertura, (c) confirme o centro preciso, tornando a alheta inscrita na borda do campo de visão, (d) então faça a alheta circunscrito.
Tamanhos de arquivo
Os arquivos de microscópio podem ser muito grandes. Ainda assim, certas medidas podem ser tomadas para agilizar os tamanhos dos arquivos. Por exemplo, se você não precisa de dados, a ideia de imaginar tudo “por precaução” pode realmente tornar a vida mais difícil.
Imagine o que você precisa, com a resolução, a profundidade de bits e o campo de visão adequado. Evite criar mais ou menos imagens do que você precisa, pois ter arquivos maiores do que o necessário cria uma carga indesejada no armazenamento e processamento de dados.
Armazenamento de arquivos
Salve os arquivos o mais rápido possível. Podem ocorrer travamentos do computador e da unidade de disco rígido a qualquer momento, portanto, salve em mais de um local.
Tenha cuidado ao usar um pen drive USB ou um disco rígido externo. Eles são propensos a “infecções” e podem espalhar o vírus ou malware de computador para computador.
Nem sempre a infecção do PC do sistema de imagem pode ser percebida imediatamente. O sistema pode ficar lento ou travar aleatoriamente. Muitos sistemas de imagem não têm software antivírus para evitar a redução do desempenho do sistema. Como resultado, os PCs do sistema de imagem são mais fáceis de infectar.
Para atenuar esses riscos, verifique as unidades de armazenamento externo antes de conectá-las ao PC do sistema de imagem.
Formatos de arquivo
Olympus usa formatos de arquivo proprietários, como OIR, OIF, VSI e OIB. Esses formatos:
- Oferecem imagens de resolução máxima não compactadas
- Mantêm a arquitetura de arquivo apropriada para o sistema de imagem Olympus
- Registram metadados dos parâmetros de imagem
FIJI/ImageJ pode abrir esses arquivos Olympus com os plug-ins apropriados instalados. Recomendamos que você mantenha as imagens nos formatos de arquivo Olympus sempre que possível, mas entenda que às vezes é necessário exportar os arquivos para TIFF, JPEG 2000 ou outros formatos.
Observe a possibilidade de toda compactação ou resolução que pode ocorrer dependendo das opções de exportação de arquivo ou do tipo de arquivo de imagem. Evite usar imagens JPEG, pois as imagens costumam ser compactadas e, com frequência, ocorre perda de dados.
4. Desligar o sistema
Desligar o sistema corretamente é tão importante quanto iniciar corretamente. Aqui estão algumas práticas recomendadas:
Limpar o sistema de microscópio após o uso
Quando a imagem é concluída, a limpeza não é apenas uma atitude sábia, mas também evita danos ao hardware.
Por exemplo, o óleo padrão para objetivas de imersão em óleo pode secar e endurecer se deixado nas objetivas. O óleo que foi deixado de fora por dias é difícil de limpar e pode até escorrer para outras superfícies do microscópio. Aprenda como limpar lentes objetivas na aba Recursos, 6 dicas para limpar adequadamente o óleo de imersão de suas objetivas.
Esmaltes de unha de lâminas ou reagentes de limpeza cáusticos são encontrados com frequência na platina do microscópio ou na área de imagem. Limpe essas superfícies, especialmente onde o líquido ou outros resíduos estão visíveis. As superfícies comumente tocadas —como lentes oculares, painel de controle de toque e alças de foco — são as principais áreas para contaminação e infecção de um usuário para o outro.
Para reduzir a propagação de vírus, limpar essas superfícies é importante. Sugerimos o uso de etanol 70% em água destilada no papel para lentes para o controlador do painel de toque e oculares. Certifique-se de remover as conchas de borracha ao redor das oculares para evitar que o álcool danifique a borracha. Também é recomendado limpar a superfície da platina, a mesa de ar ou mesa de trabalho com etanol 70% em água destilada e papeis finos ou toalhas de papel.
Um bom princípio orientador é deixar o sistema de microscópio em melhor forma do que você o encontrou. Remova todas as amostras da área do microscópio após a imagem. A maioria das amostras é melhor armazenada a 37 °C (98,6 °F), temperatura ambiente, 4 °C (39,2 °F), -20 °C (-4 °F) ou -80 °C (-112 °F). A maioria das lâminas ou pratos são armazenados para evitar quebras e devem ser mantidos no escuro. Algumas amostras devem ser devolvidas à incubadora de células.
Para obter mais dicas de limpeza, leia nosso artigo: Como limpar e esterilizar seu microscópio.
Desligando o sistema de microscópio
Desligar o sistema corretamente ajuda a garantir:
- A manutenção adequada do hardware
- Que o sistema está pronto para o próximo usuário
Antes de desligar o sistema, verifique quando a próxima pessoa irá usá-lo. Se o sistema for usado imediatamente, considere fazer o logout enquanto mantém todo o hardware restante ligado. Mas se não for usado por uma hora ou mais, é aconselhável desligar o sistema. Isso reduz o uso de laseres, lâmpadas, ventiladores e outros componentes que devem ser substituídos e reparados com base no horário de operação.
Sempre saia do software antes de encerrar os componentes de hardware. Desligar uma caixa de controle do microscópio antes de sair do software, por exemplo, pode resultar em erro e problemas potenciais para o próximo usuário. Lembre-se de que o software é como o cérebro do sistema de imagem.
Guia de solução de problemas rápidos para retornar ao laboratório
Se você se deparar com imagem desafiadora, estamos aqui para ajudar! Aqui estão algumas soluções para problemas comuns que um microscopista pode enfrentar ao retornar ao laboratório:
Desafio nº 1: Minha imagem parece embaçada. Posso focalizar a imagem, mas nunca parece nítida.
Sugestões: Use papel para lentes para limpar as objetivas, a lamínula e as oculares com etanol 70% em água destilada. Certifique-se de usar as lamínulas #1.5. Por último, verifique se você está usando o meio de imersão correto para essa objetiva.
Desafio nº 2: Quando mudo a objetiva, perco totalmente o foco.
Sugestões: Verifique se as correções parfocais estão configuradas no TPC ou no software, quando disponíveis. Confirme se as objetivas estão totalmente aparafusadas. Verifique os requisitos de imersão da objetiva. Isso inclui verificar se o meio de imersão correto está sendo usado e se não está sendo misturado com outro meio. Não é incomum precisar de ajuste de foco ao passar de uma ampliação baixa para uma ampliação alta. No entanto, perder o foco ao passar de uma ampliação alta para uma baixa provavelmente indica um problema com a parfocalidade.
Desafio nº 3: Quando vejo minhas imagens fluorescentes, a imagem fica clara de um lado e escura do outro. Eu não acho que isso está correto.
Sugestões: Primeiro, verifique se esse padrão de claro de um lado e escuro do outro permanece quando você traduz a platina ou a amostra em XY. Se o padrão permanecer, considere que a amostra pode não ser plana. Se a amostra parecer plana, o laser ou a lâmpada de arco podem estar desalinhados. Se você suspeitar que o problema é o laser ou a lâmpada de arco, entre em contato conosco para obter suporte antes de tentar alinhar o caminho da luz de excitação por fluorescência. Entre em contato com seu representante de vendas local ou com o Centro de Assistência Técnica Olympus.
Desafio nº 4: Quando abro minhas imagens em outro software, as imagens não ficam tão bonitas quanto quando as abro no software Olympus.
Sugestões: Posso abrir os arquivos em outra instalação do software Olympus? Ficar dentro das soluções de software da Olympus é a maneira mais conveniente de manter a resolução ou as informações de metadados. Se o software de análise exigir TIFF ou outro formato de arquivo genérico, use arquivos raw, TIFF resolução total. Esses arquivos raw TIFF geralmente aparecem em preto, a menos que sejam abertos com um software de imagem. Além disso, alguns softwares Olympus interpolam quando o zoom é aplicado à imagem. Nem todo software interpola os píxeis quando muito zoom é aplicado. Isso às vezes pode fazer com que as imagens no software Olympus pareçam diferentes de FIJI/ImageJ.
Desafio nº 5: Meu laboratório tem usado as lamínulas #1 há anos e temos muitos casos delas no laboratório. É importante mudarmos para a lamínula de 1.5?
Sugestões: As objetivas Olympus são projetadas para lamínulas de 1.5, a menos que sejam lentes de imersão em água. Artefatos ópticos ocorrerão se não houver vidro suficiente entre a objetiva e a amostra. Até que ponto isso é importante depende do experimento e dos requisitos de imagem. Independentemente disso, suas imagens não serão tão resolvidas quanto poderiam e a imagem não é a ideal. Recomendamos mudar para lamínulas de 1.5 o mais rápido possível.
Conteúdo relacionado
Guia de microscopia remota: Seis dicas para preparar seu laboratório para o sucesso
Cinco maneiras práticas de acelerar seus experimentos de microscopia
.jpg?rev=4C75)
