Desde a sua concepção, a formação de imagem de fluorescência se tornou uma ferramenta indispensável para a pesquisa biológica. Ela ajudou inúmeros cientistas a visualizarem estruturas celulares e processos dinâmicos em nível microscópico.
Se você já tiver usado um microscópio de fluorescência para realizar a formação de imagem de amostras biológicas, você pode até ter percebido um sinal de fundo fraco onipresente permeando o tecido. A intensidade do sinal pode variar em estruturas diferentes e provavelmente exibirá mudanças de intensidade dependendo do comprimento de onda da sua fonte de excitação.
No entanto, antes de consultar os protocolos e as observações em busca de técnicas de coloração inadequadas, considere a composição biológica da sua amostra. Ela é celularizada? Pigmentada? Há uma quantidade significativa de proteínas estruturais presente? Se tiver respondido "sim" para qualquer uma dessas perguntas, o sinal que está vendo pode não ser tão estranho quanto você imagina. Parte do fundo, se não todo, emana naturalmente como autofluorescência.
A biologia é mais brilhante do que você imagina – Definindo a autofluorescência
A autofluorescência, a emissão natural de luz por estruturas biológicas, é um fenômeno muito comum em células e tecidos. Ela é causada por componentes moleculares endógenos que têm a capacidade de fluorescer. Assim como os fluoróforos artificiais usados em colorações e corantes, as moléculas autofluorescentes normalmente são compostas de hidrocarbonetos policíclicos com elétrons deslocalizados que podem ser excitados pelos fótons recebidos. As moléculas autofluorescentes apresentam resistência ao relaxamento vibracional eficiente após serem estimuladas pela luz recebida. Como resultado, o excesso de energia é emitido como um novo fóton que tem uma energia menor e um comprimento de onda maior do que os do fóton excitante. Embora os mecanismos pareçam familiares, você pode se perguntar porque não se depara com a autofluorescência em seu dia a dia. Afinal de contas, você é uma entidade biológica. Apesar disso, você não fluoresce naturalmente.
Algumas moléculas endógenas, como a quitina, são conhecidas por autofluorescerem de forma vibrante sob estimulação ultravioleta (veja a Figura 1, à esquerda). No entanto, muitos autofluoróforos têm uma menor probabilidade de serem excitados por fótons recebidos em comparação com seus equivalentes artificiais que muitos cientistas estão acostumados a ver no laboratório. A concentração dos agentes de contraste artificiais também pode ser ajustada em um protocolo de coloração de bancada para restringir ou aumentar um sinal de fluorescência, mas a autofluorescência natural é sempre limitada às concentrações biológicas.
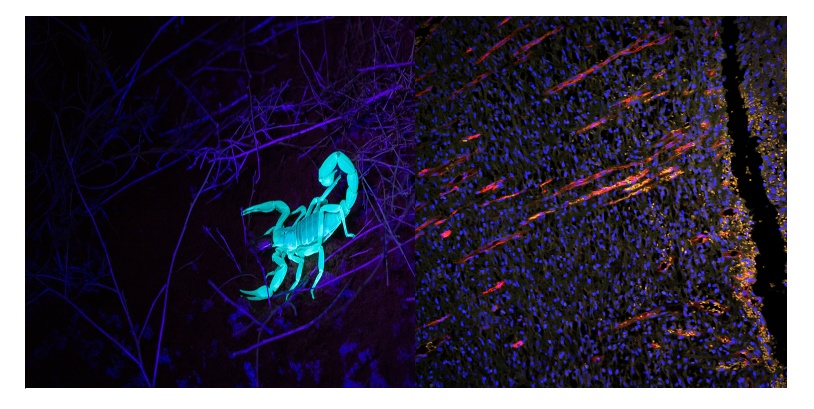
Figura 1. Exemplos de autofluorescência em espécimes vivos. À esquerda: um escorpião autofluoresce sob estimulação ultravioleta (UV). À direita: imagem da recuperação da pele de um rato 10 dias após um trauma, mostrando a neovasculatura com crescimento vertical em direção ao corte da ferida na camada epidérmica. Azul (DAPI): núcleo. Amarelo (autofluorescência): tecido da pele. Vermelho (CD31): vasos sanguíneos. Imagem capturada usando o microscópio de fluorescência de campo amplo BX51 e a câmera DP71 da Olympus. Imagem cortesia de LiShuang Li, Centro de Pesquisa Experimental, Academia Chinesa de Ciências Médicas Chinesas.
As moléculas autofluorescentes também têm janelas de excitação diferentes, embora na maioria das vezes a autofluorescência seja excitável na faixa UV-verde e produza espectros de excitação relativamente amplos. Combinados, esses fatores tornam a autofluorescência muito mais comum de encontrar ao usar sistemas de formação de imagem com fontes de luz estimuladoras de fluorescência dedicadas e detectores de fótons mais sensíveis do que o olho nu (Figura 1, à direita: sinal laranja).
Fontes comuns de autofluorescência na pesquisa de ciências da vida
Para levar em conta adequadamente a presença da autofluorescência em experimentos de formação de imagem de pesquisa, considere os componentes biológicos que compõem a sua amostra. Veja a seguir alguns produtores de fluorescência frequentemente observados que os pesquisadores encontram no laboratório:
1. Nicotinamida adenina dinucleotídeo
A nicotinamida adenina dinucleotídeo, ou NAD(P)H, é um cofator metabólico e um transportador de elétrons encontrado em todo o citoplasma, onde atua como um componente essencial na glicólise e nas vias das pentoses-fosfato. Por ser um componente essencial do metabolismo celular, a autofluorescência da NAD(P)H está presente em quase todas as células vivas. Para realizar suas funções metabólicas, a molécula existe naturalmente em um estado oxidado (NAD+) e reduzido (NAD(P)H). No entanto, somente a NAD(P)H produz fluorescência. O equivalente oxidado, NAD+, não autofluoresce. Excitação: 340 nm; Emissão: 450 nm. (Fontes: Chance et al. 1979; Georgakoudi et al. 2002).
2. Flavinas
Comumente encontrada na forma de flavina adenina dinucleotídeo (FAD), esta coenzima metabólica desempenha funções importantes no ciclo de TCA e na cadeia de transporte de elétrons. Ela está localizada principalmente na mitocôndria, onde os processos metabólicos ativos produzem focos de sinal autofluorescente. Alguns pesquisadores preferem referir-se à autofluorescência das flavinas como "fluorescência de flavoproteínas", pois a FAD é ligada de forma funcional a complexos de proteínas na mitocôndria, como succinato desidrogenase. Ao contrário da NAD(P)H, somente a forma oxidada da FAD produz fluorescência, enquanto a forma reduzida não produz. Excitação: 380–490 nm; Emissão: 520–560 nm. (Fontes: Chance et al. 1979; Deyl et al. 1980).
3. Colágeno
O colágeno é uma proteína mecânica fundamental que pode ser agrupada para criar várias matrizes estruturais de suporte para a maioria dos tecidos. Ele pode ser encontrado na derme da pele, na matriz extracelular de órgãos internos e na vasculatura circundante. Ele também compõe os tendões, ligamentos, cabelo e unhas. Embora o colágeno raramente seja visto em culturas de células, os pesquisadores que usam amostras in vivo ou tecidos inteiros em seus experimentos de formação de imagem provavelmente considerarão o colágeno inevitável. Excitação: 270 nm; Emissão: 390 nm. (Fonte: Georgakoudi et al. 2002).
4. Elastina
Outra importante proteína de matriz extracelular (ECM), a elastina muitas vezes é intercalada com o colágeno para fornecer às matrizes extracelulares uma maior extensibilidade mecânica. A elastina está densamente localizada ao redor da vasculatura que sofre deformações elásticas frequentes para lidar com as mudanças na pressão sanguínea. Ela também é encontrada na pele, onde a maleabilidade é necessária para complementar o movimento dos ossos e músculos subjacentes. Novamente, os pesquisadores que realizam a formação de imagem de amostras in vivo ou de tecidos inteiros devem estar cientes da autofluorescência causada por proteínas estruturais como a elastina. Excitação: 350–450 nm; Emissão: 420–520 nm. (Fonte: Deyl et al. 1980).
5. Lipofuscina
Uma molécula autofluorescente bastante confusa, a lipofuscina pode ser encontrada compondo estruturas pequenas, porém vibrantes, nos espectros de fluorescência de neurônios, células gliais, células musculares esqueléticas e células musculares cardíacas, entre outras. A lipofuscina pode ser observada tanto em culturas de células como em tecidos inteiros. Foi observado que ela se torna progressivamente mais aparente conforme a amostra envelhece biologicamente. Embora o nome possa sugerir que um lipídio ou lipoproteína seja o responsável, o sinal de autofluorescência da lipofuscina foi atribuído a uma amalgamação de proteínas, carboidratos e lipídios. Excitação: 345–490 nm; Emissão: 460–670 nm. (Fonte: Billinton e Knight 2001).
6. Triptofano
Um aminoácido essencial e precursor necessário para moléculas de sinalização, como a serotonina e a melatonina que podem ser encontradas na pesquisa neurológica, o triptofano é um componente indispensável para a biossíntese de proteínas. Sua onipresença não pode ser subestimada, pois os resíduos de triptofano podem ser encontrados na maioria das proteínas enoveladas e seu sinal de autofluorescência subsequentemente permeia tanto as células como os tecidos. Uma vez que a sua química estrutural está ligada às conformações das proteínas, foi observado que o comprimento de onda e a intensidade da autofluorescência do triptofano muda em função das mudanças na estrutura e no status de ligação das proteínas. Excitação: 280 nm; Emissão: 350 nm. (Fonte: Ghisaidoobe e Chung 2014).
7. Melanina
A melanina é um pigmento natural que contribui para a coloração da pele, cabelo e olhos. Produzida pelas células na epiderme basal da pele, a melanina atua como uma molécula fotoprotetora evitando que a luz UV do sol danifique proteínas importantes e o DNA nas células da pele voltadas para o exterior. A não ser que você esteja cultivando melanócitos diretamente, a melanina requer um maior cuidado para experimentos que realizam a formação de imagem através da pele, pois a sua concentração natural e distribuição podem variar mesmo no interior das mesmas amostras. Excitação: 340–400 nm; Emissão: 360–560 nm. (Fonte: Gallas e Eisner 1987).
Fluorescência da preparação da amostra
As fontes acima irradiam fótons naturalmente de tecidos biológicos. Muitos pesquisadores também encontram fluorescência em componentes ou reagentes não biológicos necessários para preparar amostras no laboratório.
Por exemplo, os fundos de plástico em placas de Petri, placas de poços e frascos de culturas de células podem fluorescer de forma brilhante e em um espectro amplo. Recomendamos o uso de recipientes com fundo de vidro ou especificamente de polímeros não fluorescentes sempre que você precisar realizar a formação de imagem de fluorescência de amostras biológicas. O vermelho de fenol, um aditivo comum para meios de cultura de células, também pode aumentar significativamente a fluorescência de fundo ao realizar a formação de imagem de células vivas. Isso pode ser facilmente evitado substituindo o seu meio por uma alternativa sem vermelho de fenol antes de começar quaisquer experimentos de formação de imagem.
Etiquetas ou adesivos de papel também podem causar problemas semelhantes, pois o papel é altamente fluorescente. Ao usar etiquetas de papel em recipientes ou lâminas, mantenha as etiquetas distantes das amostras que planeja realizar a formação de imagem.
Finalmente, os fixadores de aldeído são comumente usados em protocolos de coloração ou tingimento. Reagentes como o glutaraldeído ou formaldeído reagem com as proteínas para criar ligações cruzadas fluorescentes em todas as células e tecidos. Substitua-os por fixadores sem aldeído para evitar um acúmulo de sinal de fluorescência indesejado.
Embora esses exemplos não sejam fontes de autofluorescência naturais, entender a sua origem e impacto pode evitar efeitos indesejados nos dados das imagens.
Como controlar a autofluorescência indesejada em um experimento de formação de imagem
Até aqui, definimos alguns autofluoróforos e onde podemos encontrá-los. Agora surge uma pergunta. Como você pode controlar esses sinais antes de começar um experimento de formação de imagem?
Em tecidos simples ou culturas monocelulares, escolha cuidadosamente os espectros de excitação e emissão dos corantes comerciais e encontre os filtros estreitos correspondentes que evitem grandes picos de autofluorescência. Fazer isso pode melhorar muito a sua relação sinal-ruído.
Se o seu protocolo permitir, escolha corantes com alta eficiência quântica ou experimentos com concentrações maiores de agente de contraste. Isso também pode melhorar o sinal, embora a um custo mais alto. As estratégias modernas usam a luz de excitação de infravermelho próximo (NIR) com etiquetas que podem ser excitadas a mais de 700 nm (por exemplo, Cy7 ou Alexa Fluor 750) para evitar as faixas de excitação e emissão dos autofluoróforos frequentemente encontrados (Figura 2).
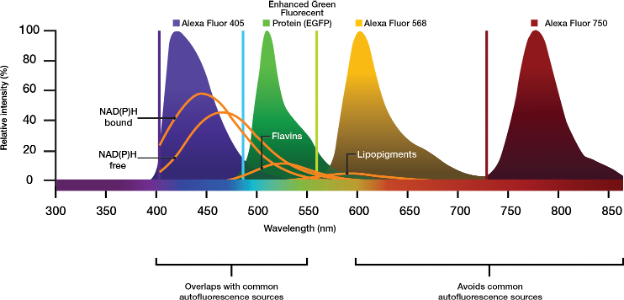
Figura 2. Picos de emissão de fluoróforos comerciais Alexa referentes a moléculas autofluorescentes comuns na formação de imagem biológica. Escolher agentes de contraste que excitam e emitem na faixa de NIR pode evitar emissões indesejadas dos contribuidores autofluorescentes.
Se houver flexibilidade, analise se modalidades de formação de imagem alternativas podem funcionar para os seus experimentos. Para amostras ou tecidos grossos, os sistemas de microscopia confocal ou multifóton podem minimizar a contribuição da autofluorescência em geral. Eles fazem isso eliminando a coleta da luz fora de foco ou limitando a excitação ao plano focal, respectivamente.
Técnicas como a formação de imagem de bioluminescência removem completamente a chance de os autofluoróforos contribuírem com sinal para os seus dados coletados. Os experimentos de luminescência não requerem luz de excitação para as reações quimiluminescentes para produzirem fótons de emissão, deixando os autofluoróforos sem estimulação.
Quando a contribuição do sinal de autofluorescência não pode ser mitigada antes da formação de imagem, técnicas de processamento de imagem pós-aquisição, como o demixing espectral ou a subtração de fundo, podem ser alternativas eficazes. Essas técnicas computacionais requerem que os pesquisadores encontrem os fluoróforos endógenos em suas amostras ou tenham um conhecimento fundamentado sobre os espectros de autofluorescência para remover a contribuição de forma eficaz.
Conteúdo relacionado
Formação de imagem da resposta a medicamentos na avaliação da eficácia de medicamentos


