News
Aplicações de autofagia
Yoshinori Ohsumi, professor honorário no Instituto de Tecnologia de Tóquio, recebeu o Prêmio Nobel de Fisiologia ou Medicina de 2016 pela descoberta da autofagia (autofagocitose). Sua pesquisa sobre autofagia começou com a observação de leveduras usando um microscópio óptico. O interesse na autofagia se expandiu de células de levedura para células de mamíferos, e de outros tipos de animais, através do trabalho de vários pesquisadores; a autofagia é atualmente o foco de muitos grupos de pesquisa em todo o mundo.
A pesquisa sobre a autofagia abrange a pesquisa fundamental, como entender o funcionamento da autofagia em um nível molecular e quais as funções que desempenham em organismos vivos, até aplicações clínicas, como a análise da associação da autofagia na doença de Alzheimer e em outras doenças neurológicas. Os microscópios biológicos da Olympus contribuíram para essa pesquisa de ponta sobre a autofagia.
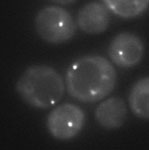
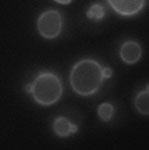
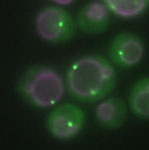
A fluorescência foi usada para observar a proteína Atg17 relacionada à autofagia e membranas de vacúolos em leveduras (Atg17 mutante). Os pesquisadores utilizaram iluminação oblíqua com lentes objetivas TIRF com alta ampliação (150X) e microscópio invertido IX3.
|
|
|

Microscópio TIRF no laboratório do Dr. Ohsumi, no Instituto de Tecnologia de Tóquio
Dados da imagem, cortesia de Hayashi Yamamoto e Yoshinori Ohsumi, Centro de Pesquisa Frontier, Instituto de Tecnologia de Tóquio
Referência:
Yamamoto, H.; Fujioka, Y.; Suzuki, S. W.; Noshiro, D.; Suzuki, H.; Kondo-Kakuta, C.; Kimura, Y.; Hirano, H.; Ando, T.; Noda, N. N.; Ohsumi, Y. A proteína Atg13 intrinsecamente desordenada medeia o complexo supramolecular dos complexos de iniciação autofágica. Dev Cell. 11 de Jul de 2016; 38(1):86–99.
Produto relacionado: objetiva UAPON150XOTIRF
Observação simultânea de três cores com fluorescência de organelas e autofagossomas em células de COS7 com microscópio de escaneamento a laser baseado na série de microscópios invertidos completamente motorizados IX. Esta configuração permite a observação simultânea de três cores com fluorescência.
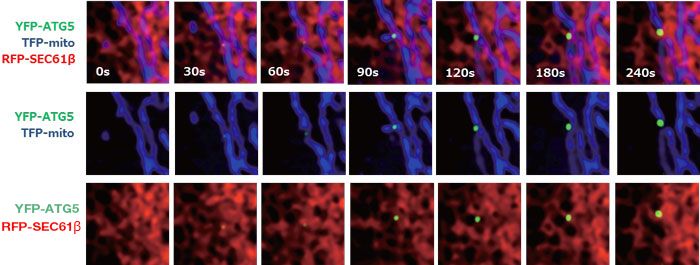
A primeira visualização dinâmica mundial da formação do autofagossoma a partir dos locais de contato da estrutura da mitocôndria (RFP-SEC61β, vermelha) e do retículo endoplasmático (TFP-mito, azul).
 Um sistema convencional de observação de três cores simultâneas com fluorescência. |  Nosso sistema atual de observação de três cores simultâneas com fluorescência |
| Sistema de microscópio de imagem de célula viva no laboratório do Dr. Yoshimori | |
A imagem à esquerda mostra o sistema de imagem de três cores simultâneas com fluorescência usado para capturar imagens que foram publicadas na revista Nature. Este sistema é baseado na versão completamente motorizada de um microscópio invertido IX81. A imagem à direita é a versão atualizada baseada no microscópio completamente motorizado IX83.
Dados da imagem, cortesia de
Maho Hamasaki e Tamotsu Yoshimori, Departmento de Genética da Escola de Pós-graduação em Medicina da Universidade de Osaka
Referência:
Maho Hamasaki, Nobumichi Furuta, Atsushi Matsuda, Akiko Nezu, Akitsugu Yamamoto, Naonobu Fujita, Hiroko Oomori, Takeshi Noda, Tokuko Haraguchi, Yasushi Hiraoka, Atsuo Amano e Tamotsu Yoshimori.
O autofagossoma se forma nos locais de contato da mitocôndria-ER.
Nature. 21 mar 2013; 495(7441): 389-93. doi: 10.1038/nature11910. Epub: 3 de março de 2013.
Produtos relacionados: Microscópio invertido IX83 automático, completamente motorizado
Imagem em tempo real da proteína LS3 relacionada com autofagia em ovos fertilizados de um peixe-zebra transgênico GFP-LC3-RFP-LC3 ΔG. Os pesquisadores usaram uma objetiva de imersão em silicone de 30X (UPLSAPO30XS) e um microscópio confocal de escaneamento a laser.
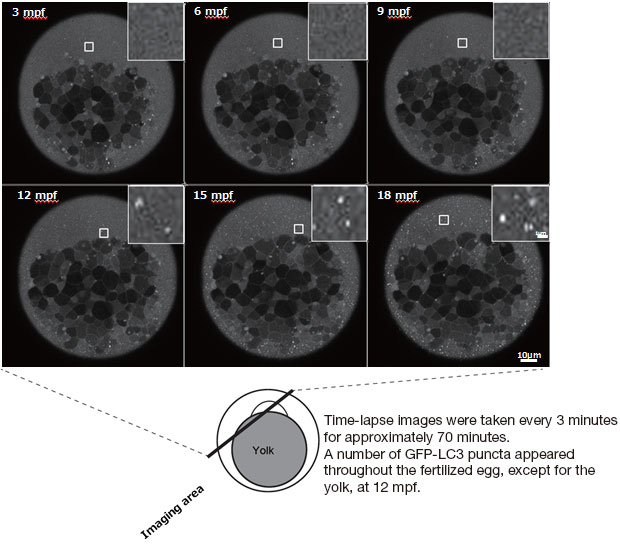
Dados da imagem, cortesia de
Hideaki Morishita e Noboru Mizushima, Departamento de Bioquímica e Biologia Molecular,
Escola de Pós-graduação e Faculdade de Medicina, Universidade de Tóquio
Referência:
Takeshi Kaizuka, Hideaki Morishita, Yutaro Hama, Satoshi Tsukamoto, Takahide Matsui, Yuichiro Toyota, Akihiko Kodama, Tomoaki Ishihara, Tohru Mizushima, Noboru Mizushima
Sonda de fluxo autofágico que lança o controle interno. Mol Cell. 25 out. 2016. pii: S1097-2765(16)30589-5. doi: 10.1016/j.molcel.2016.09.037. [Epub descrito na capa da publicação]
Produtos relacionados: Microscópio confocal de escaneamento a laser FV3000 e objetiva de imersão em silicone UPLSAPO30XS
Análise da localização de um receptor da proteína de ligação N-etilmaleimida-sensível solúvel (SNARE) que causa fusão de membrana em células MEF knockout ATG3 relacionadas à autofagia sob condições de fome (uma hora após passar fome).
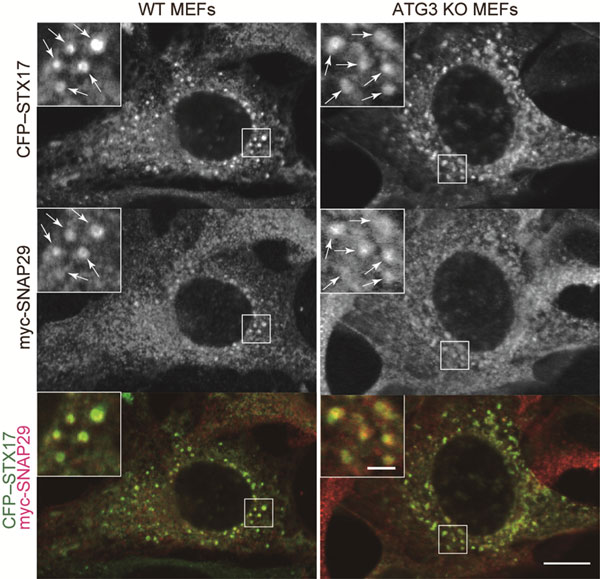
Foi observado colocalização de proteína SNARE SECFP-STX17 e myc-SNAP29 (seta branca).
Tipo wild type MEF (esquerda) e ATG3 extratora de MEF (direita)
Escala gráfica = 10 μm; escala gráfica em uma imagem em primeiro plano dentro do quadro branco = 2 μm

Um microscópio confocal no laboratório do Dr. Mizhshima, na Universidade de Tóquio
Dados da imagem, cortesia de Kotaro Tsuboyama, Ikuko Honda e Noboru Mizushima, Departamento de Bioquímica e Biologia Molecular, Escola de Pós-graduação e Faculdade de Medicina, Universidade de Tóquio
Referência:
Kotaro Tsuboyama, Ikuko Koyama-Honda, Yuriko Sakamaki, Masato Koike, Hideaki Morishita, Noboru Mizushima.
Os sistemas de conjugação ATG são importantes para a degradação da membrana interna do autofagossoma.
Science 20 Oct 2016: DOI: 10.1126/science.aaf6136.
Produtos relacionados: Microscópio confocal de escaneamento a laser FV3000
Os pesquisadores conseguiram uma imagem de superresolução das membranas autofagossomas nos fibroblastos de um camundongo com o sistema de microscópio de superresolução SD-OSR e com uma lente objetiva de imersão em silicone de 100X (UPLSAPO100XS).
SD-OSR (lado esquerdo do filme)
| Confocal (lado direito do filme)
|
Imagens de superresolução de GFP-p62 em fibroblastos de camundongo que foram capturadas durante 35 minutos ininterruptos (esquerda). Os autofagossomas podem ser observados como anéis (direita) mais nítidos do que os produzidos pela imagem confocal convencional.
Dados da imagem, cortesia de Satoshi Waguri,
Departamento de Anatomia e Histologia, Universidade de Medicina de Fukushima
Produtos relacionados: sistema de superresolução com disco giratório SD-OSR
Como o SD-OSR é um produto que precisa ser encomendado especialmente, entre em contato conosco para obter mais informações.
O software FV-OSR fornece imagem de superresolução com o microscópio FV3000. Os pesquisadores usaram este sistema para capturar imagens de proteína WIPI2 que inicia a formação do autofagossoma (Alexa Fluor 488) e a membrana mitocondrial externa da proteína TOM20 (Alexa Fluor 568) em MEF fixado com paraformaldeído (PFA) depois da indução à autofagia (1,5 h de crescimento em cultura sem aminoácido).
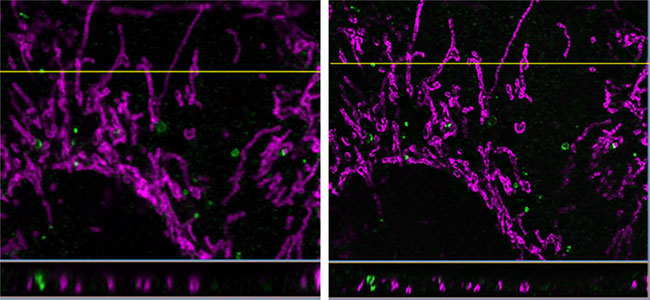
Estas imagens mostram a seção horizontal de uma imagem com acúmulo de fatias em Z. A imagem à direita foi obtida com o software cellSens® Dimension. As imagens XYZ de superresolução foram processadas com as funções de deconvolução 3D do software, resultando em uma resolução Z melhorada.
Dados da imagem, cortesia de Ikuko Honda e Noboru Mizushima, Departamento de Bioquímica e Biologia Molecular, Escola de Pós graduação e Faculdade de Medicina, Universidade de Tóquio
Produto relacionado: Microscópio confocal de escaneamento a laser FV3000 e software FV-OSR Super Resolution
Contribuições à pesquisa de autofagia
Nossos microscópios biológicos têm colaborado com as pesquisas de ponta sobre autofagia que abrangem várias áreas, desde medicina básica até estudos de vírus, de imunidade e de plantas. Todas as citações abaixo realizaram pesquisas com os microscópios da Olympus.
Takeshi Kaizuka, Hideaki Morishita, Yutaro Hama, Satoshi Tsukamoto, Takahide Matsui, Yuichiro Toyota, Akihiko Kodama, Tomoaki Ishihara, Tohru Mizushima, Noboru Mizushima
Uma sonda de fluxo autofágico que libera um controle interno.
Mol Cell. 25 de outubro de 2016. pii: S1097-2765(16)30589-5. doi: 10.1016/j.molcel.2016.09.037. [Epub descrito na capa da publicação]
Produtos relacionados:objetiva de imersão em silicone UPLSAPO30XS
Kotaro Tsuboyama, Ikuko Koyama-Honda, Yuriko Sakamaki, Masato Koike, Hideaki Morishita, Noboru Mizushima.
Os sistemas de conjugação ATG são importantes para a degradação da membrana interna do autofagossoma.
Science, 20 de outubro de 2016: DOI: 10.1126/science.aaf6136.
Produtos relacionados:Microscópio confocal de escaneamento a laser FV3000
Kenta Imai, Feike Hao, Naonobu Fujita, Yasuhiro Tsuji, Yukako Oe, Yasuhiro Araki, Maho Hamasaki, Takeshi Noda, Tamotsu Yoshimori.
J Cell Sci. 2016 Oct 15;129(20):3781-3791. Epub 2016 Sep 1.
Produtos relacionados:Microscópio confocal de escaneamento a laser FV3000
Kosaku Shinoda, Yutaka Hasegawa, Kenji Ikeda, Haemin Hong, Qianqian Kang, Yangyu Yang, Rushika M. Perera, Jayanta Debnath, Shingo Kajimura.
A manutenção do adipócito bege é regulada pela liberação mitocondrial de autofagia induzida Svetlana Altshuler-Keylin. Eu não sei se são os autores..nao fica claro
Cell Metab. 2016 Sep 13;24(3):402-19. doi: 10.1016/j.cmet.2016.08.002. Epub 2016 Aug 25.
Produtos relacionados:MVX10 Macro Zoom Microscope
Junya Hasegawa, Ryo Iwamoto, Takanobu Otomo, Akiko Nezu, Maho Hamasaki, Tamotsu Yoshimori.
A fusão de autofagossoma-lisossoma em neurônios precisa de INPP5E, proteína associada à síndrome de Joubert.
EMBO J. 2016 Sep 1;35(17):1853-67. doi: 10.15252/embj.201593148. Epub 2016 Jun 23.
Produtos relacionados:Microscópio confocal de escaneamento a laser FV3000
Christopher P Webster, Emma F Smith, Claudia S Bauer, Annekathrin Moller, Guillaume M Hautbergue, Laura Ferraiuolo, Monika A Myszczynska, Adrian Higginbottom, Matthew J Walsh, Alexander J Whitworth, Brian K Kaspar, Kathrin Meyer, Pamela J Shaw, Andrew J Grierson, Kurt J De Vos.
A proteína C9orf72 interage com Rab1a e o complexo ULK1 para regular a iniciação da autofagia.
EMBO J. 2016 Aug 1;35(15):1656-76. doi: 10.15252/embj.201694401. Epub 2016 Jun 22.
Produtos relacionados:Microscópio invertido automático IX83, completamente motorizado
Hayashi Yamamoto, Yuko Fujioka, Sho W. Suzuki, Daisuke Noshiro, Hironori Suzuki, Chika Kondo-Kakuta, Yayoi Kimura, Hisashi Hirano, Toshio Ando, Nobuo N. Noda & Yoshinori Ohsumi.
A proteína Atg13 intrinsecamente desordenada media o conjunto supramolecular dos complexos de iniciação autofágica.
Dev Cell. 2016 Jul 11;38(1):86-99.
Produtos relacionados:Objetiva UAPON150XOTIRF
Chantal Sellier, Maria‐Letizia Campanari, Camille Julie Corbier, Angeline Gaucherot, Isabelle Kolb‐Cheynel, Mustapha Oulad‐Abdelghani, Frank Ruffenach, Adeline Page, Sorana Ciura, Edor Kabashi, Nicolas Charlet‐Berguerand.
A perda de C9ORF72 prejudica a autofagia e a sinergia com o poliQ Ataxina-2 que induz à disfunção do neurônio motor e à morte da célula.
EMBO J. 2016 Jun 15;35(12):1276-97. doi: 10.15252/embj.201593350. Epub 2016 Apr 21.
Produtos relacionados:Microscópio invertido automático IX83, completamente motorizado
Jennifer Martinez, Larissa D. Cunha, Sunmin Park, Mao Yang, Qun Lu, Robert Orchard, Quan-Zhen Li, Mei Yan, Laura Janke, Cliff Guy, Andreas Linkermann, Herbert W. Virgin & Douglas R. Green.
A autofagia não canônica inibe a autoinflamação, reposta semelhante a das células agonizantes do lúpus.
Nature. 2016 May 5;533(7601):115-9. doi: 10.1038/nature17950. Epub 2016 Apr 20.
Produtos relacionados:Microscópio de fluorescência semi-motorizado BX53
Shuo Wang, Pengyan Xia, Guanling Huang, Pingping Zhu, Jing Liu, Buqing Ye, Ying Du & Zusen Fan.
Para o desenvolvimento de células NK e imunidade inata necessitam de autofagia mediada por FoxO1.
Nat Commun. 2016 Mar 24;7:11023. doi: 10.1038/ncomms11023.
Produtos relacionados:Microscópio confocal de escaneamento a laser FV3000
Jiwon Jang, Yidi Wang, Matthew A. Lalli, Elmer Guzman, Sirie E. Godshalk, Hongjun Zhou, Kenneth S. Kosik.
A ativação do eixo primário do Cílio-autofagia-Nrf2 (PAN) compromete as células-tronco do embrião humano que formam o neuroectodermo.
Cell. 2016 Apr 7;165(2):410-20. doi: 10.1016/j.cell.2016.02.014. Epub 2016 Mar 24.
Produtos relacionados:Sistema de microscópio invertido IX73 para imagem avançada de células vivas
Takeshi Yamamoto, Yoshitsugu Takabatake, Tomonori Kimura, Atsushi Takahashi, Tomoko Namba, Jun Matsuda, Satoshi Minami, Jun-ya Kaimori, Isao Matsui, Harumi Kitamura, Taiji Matsusaka, Fumio Niimura, Motoko Yanagita, Yoshitaka Isaka & Hiromi Rakugi.
Desregulação dependente do tempo de autofagia: participação no envelhecimento e na homeostase mitocondrial no túbulo proximal do rim.
Autophagia. 2016 May 3;12(5):801-13. doi: 10.1080/15548627.2016.1159376. Epub 2016 Mar 17.
Produtos relacionados:Microscópio confocal de escaneamento a laser FV3000
Chenran Wang, Song Chen, Syn Yeo, Gizem Karsli-Uzunbas, Eileen White, Noboru Mizushima, Herbert W. Virgin, and Jun-Lin Guan.
A p62/SQSTM1 elevada determina a sorte das células-tronco neurais com autofagia deficiente através do aumento do superóxido.
J Cell Biol. 2016 Feb 29;212(5):545-60. doi: 10.1083/jcb.201507023.
Produtos relacionados:DP74 Digital Microscope Camera
Satoshi Hirano, Takefumi Uemura, Hiromichi Annoh, Naonobu Fujita, Satoshi Waguri, Takashi Itoh & Mitsunori Fukuda.
Susceptibilidade diferente à degradação autofágica das proteínas de ligação: SQSTM1/p62 and TBC1D25/OATL1.
Autofagia. 2016;12(2):312-26. doi: 10.1080/15548627.2015.1124223.
Produtos relacionados:Objetiva UAPON100XOTIRF
Qun Lu, Christine C. Yokoyama, Jesse W. Williams, Megan T. Baldridge, Xiaohua Jin, Brittany DesRochers, Traci Bricker, Craig B. Wilen, Juhi Bagaitkar, Ekaterina Loginicheva, Alexey Sergushichev, Darren Kreamalmeyer, Brian C. Keller, Yan Zhao, Amal Kambal, Douglas R. Green, Jennifer Martinez, Mary C. Dinauer, Michael J. Holtzman, Erika C. Crouch, Wandy Beatty, Adrianus C.M. Boon, Hong Zhang, Gwendalyn J. Randolph, Maxim N. Artyomov, Herbert W. Virgin.
Controle homeostático da inflamação congênita do pulmão pelo gene Epg5 da síndrome de Vici e os genes adicionais de autofagia favorecem a patogênese da Influenza.
Cell Host Microbe. 2016 Jan 13;19(1):102-13. doi: 10.1016/j.chom.2015.12.011.
Produtos relacionados:Microscópio de fluorescência semi-motorizado BX53
Yurong Li, Mehdi Kabbage, Wende Liu, and Martin B Dickman.
A protease aspártica mediada pela clivagem de AtBAG6 é necessária para a autofagia e resistência aos fundos nas plantas.
Plant Cell. 2016 Jan;28(1):233-47. doi: 10.1105/tpc.15.00626. Epub 2016 Jan 6.
Produtos relacionados:Microscópio confocal de escaneamento a laser FV3000
Not Available in Your Country
Sorry, this page is not
available in your country.