使用 CM20 培养监测系统更准确、更容易地测定细胞增殖和细胞毒性
简介
细胞增殖/细胞毒性测定是涉及培养细胞的研究中最常用的测试之一。 其是检查用于治疗的药物浓度的基本初步测试,也是确定各种研究领域(如肿瘤学和细胞死亡)药物疗效和安全性的非常重要的测试。
传统上,WST-8 或 ATP 检测(使用代谢活性作为指标)和 BrdU 或胸腺嘧啶核苷检测(使用 DNA 合成水平作为指标)已用于细胞生长特性的定量评估。 尽管这些检测由于其简易性和吞吐量而对我们有益,但这些检测都是间接评估方法,因此结果可能与实际细胞数无关。 在许多情况下,这些检测是终点评估,有时会导致无法捕获时间序列的变化,导致重要发现被忽略。
由于这些局限性,我们认为,直接和时间评估细胞增殖/细胞毒性的方法的发展对于使用培养细胞的研究领域是重要的。
试验大纲
为了验证 OLYMPUS Provi CM20 培养监测系统的细胞增殖/毒性评估能力,我们进行了以下两项检测,以将 CM20 系统与传统检测 (WST-8) 进行比较:
- 抗癌药物 (5-FU) 对人肺腺癌 A549 细胞的细胞死亡检测
- 神经毒素 (6-OHDA) 对人神经母细胞瘤 SH-SY5Y 细胞的细胞死亡检测
试验程序
使用抗癌药物 (5-FU) 进行癌细胞死亡检测
将人肺腺癌 A549 细胞接种到多孔板上,从接种 24 小时后开始使用 5-FU (400 μM) 处理 72 小时,通过 CM20 系统每小时进行成像和细胞数计数。 设置用于药物处理的 5-FU 浓度,使细胞增殖和细胞死亡处于平衡状态,将未经 5-FU 药物处理的组设置为对照组。 传统方法用于通过 WST-8 检测,在药物处理开始后 0、24、48 和 72 小时测量细胞活力。
使用神经毒素 (6-OHDA) 进行细胞死亡检测
将人神经母细胞瘤 SH-SY5Y 细胞接种到多孔板上,从接种 24 小时后开始使用 6-OHDA (60 μM) 处理 24 小时,通过 CM20 系统每小时进行成像和细胞数计数。 设置用于药物处理药物处理的 6-OHDA 浓度,以诱导细胞快速死亡,将未经 6-OHDA 药物处理的组设置为对照组。 传统方法通过 WST-8 检测,在药物处理开始后 0、6、12 和 24 小时分别测量细胞活力。
结果
使用抗癌药物 (5-FU) 和 A549 细胞进行癌细胞死亡检测
图 1. 5-FU 药物处理后 A549 细胞的图像。
上方的行: 5-FU 未药物处理组。 下方的行: 使用 400 μM 5-FU 药物处理的组。
在 5-FU 未药物处理组中,随着培养时间的延长,细胞数量增加,并且观察到细胞在 72 小时药物处理后 100% 融合。 在 5-FU 药物处理组中,死亡细胞的数量随着药物处理时间的延长而增加,24 小时药物处理后细胞密度无明显变化。
|
|
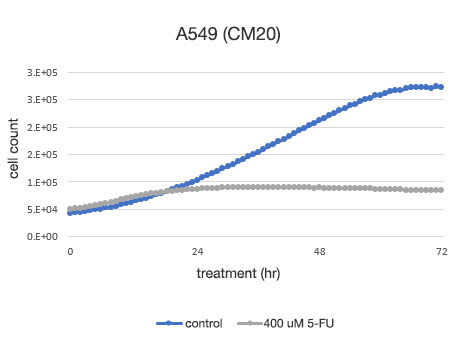
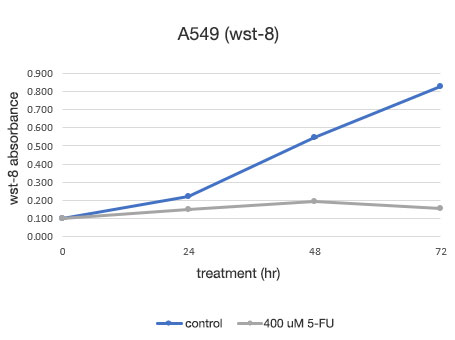
图 2. A549 细胞活力的定量测定。
左: 由 CM20 测定的细胞数。 右: 使用传统检测 (WST-8) 方法测定的细胞数。
使用 CM20 系统进行的分析表明,5-FU 未药物处理组的细胞数呈 S 形曲线增加,而 5-FU 药物处理组的细胞数在 24 小时药物处理后没有显著变化,表明细胞增殖和细胞死亡处于平衡状态。 这些结果与细胞的目测观察结果一致。 其也与通过常规方法(WST-8 检测)获得的结果一致。
使用神经毒素 (6-OHDA) 和 SH-SY5Y 细胞进行癌细胞死亡检测
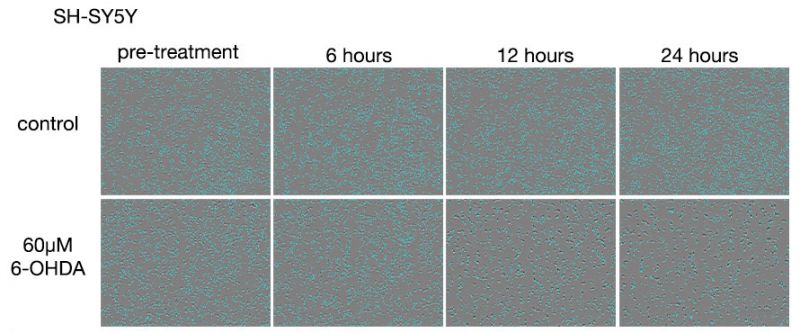
图 3. 6-OHDA 药物处理后的 SH-SY5Y 细胞图像。
上方的行: 6-OHDA 未药物处理组。 下方的行: 使用 60 μM 6-OHDA 药物处理的组。
在 6-OHDA 未药物处理组中,在 24 小时时观察到细胞数略有增加。 在 6-OHDA 药物处理组中,在 6 小时药物处理阶段观察到细胞数减少,在 12 小时药物处理阶段,我们发现大多数细胞死亡。
|
|
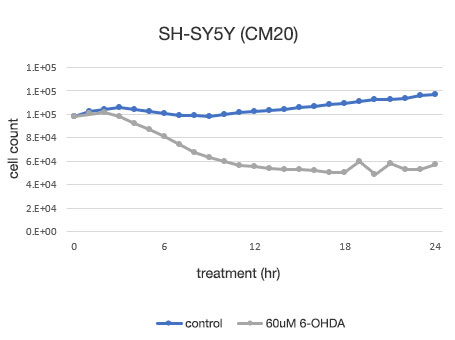
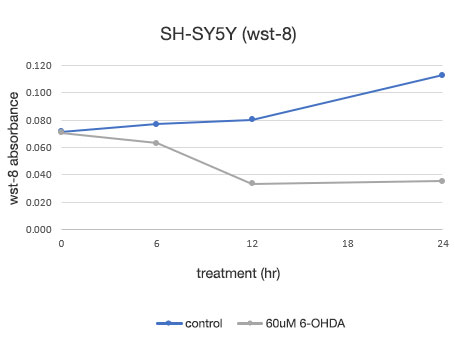
图 4. SH-SY5Y 细胞活力的定量测定。
左: 由 CM20 系统测定的细胞数。 右: 使用传统检测 (WST-8) 方法测定的细胞数。
使用 CM20 系统进行的分析表明,6-OHDA 未药物处理组的细胞数在 24 小时内略有增加,而 6-OHDA 药物处理组的细胞数在药物处理 3 小时后开始减少,此后继续减少。 药物处理 12 小时后,细胞数没有明显变化,表明几乎所有细胞都在药物处理 12 小时内死亡。 这些结果与细胞的目测观察结果一致。 其也与通过常规方法(WST-8 检测)所获得的结果一致。
关于 CM20 系统与传统检测结果的讨论
使用 CM20 监测系统对抗癌药物在癌细胞中的作用,以及另一种药物在神经系统细胞中的神经毒性进行分析,得出的结果与图像观察和传统方法(WST-8 检测)得出的结果几乎相同。
使用 CM20 培养监测系统进行评估的优点
使用 CM20 系统进行评估的优点之一就是较短的采样间隔使用户能够确定时间变化的细节。 例如,使用 SH-SY5Y 细胞的测试表明,几乎所有细胞在 6-OHDA 药物处理后约 12 小时死亡。 同时,端点分析不提供此类信息。
CM20 系统的另一个优点是只用在一块细胞培养板上获得时间进程数据。 传统方法要求为每个测量时间点准备一块细胞培养板,这会根据时间点的数量增加工作量,并减少可分析的细胞培养板数量。 此外,使用传统分析方法时,测量点的增加也增加了数据分析的复杂性,而 CM20 系统可实现自动多点观察和结果图的自动输出。
CM20 系统的另一个优点来自其自动图像采集功能,使用户即使在数据分析阶段开始后也可以查看细胞增殖状态和形态变化。 CM20 系统会在整个分析过程中记录细胞图像,因此可以收集和分析更多潜在的关键信息。 即使在传统方法需要通过分析多个点,然后重新测试来预估药物处理药物处理的适当持续时间的情况下,使用 CM20 系统进行分析也能使用户在单个测试中确定药物处理药物处理的适当持续时间,然后在该持续时间内提取数据。
评论人 Yamaguchi 博士
首先,在使用 CM20 培养监测系统时,细胞计数的准确性给我留下了深刻印象。 CM20 系统识别的细胞会在监视器上逐个单独显示。 我确认,当初始参数设置正确时,该检测可实现高度可重复的定量评估。
与传统的间接细胞数测量方法不同,CM20 系统不需要任何标签。 由于标记会对细胞造成影响,因此避免该过程使 CM20 系统成为评估细胞数量的可靠检测方法。 此外,CM20 系统的吸引力在于,它能够在一块细胞培养板上几乎自动采集多个时间点的数据,这大大减少了工作量,并有助于消除遗漏重要数据的风险。
根据试验中使用的药物的类型和浓度,即使在细胞全部死亡或达到融合度等终点处没有观察到差异的情况下,在药物处理药物处理的中间过程使用CM20也可以观察到一些变化。 我觉得使用 CM20 系统可以大大减少估计此类病例药物处理时间所需的时间和精力,从而提高研究效率和速度。
确认
本应用说明是在以下研究人员的帮助下编制的:
ACEL, Inc. 首席研究员 Takahiro Yamaguchi 博士
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。