FV3000共聚焦显微镜实现DNA修复蛋白可视化
激光诱导DNA损伤后U2OS细胞的活细胞成像
双链DNA断裂是对DNA损伤最有害的形式之一。损伤之后,细胞中的DNA损伤反应(DDR)通路被触发,诱导DDR因子募集到断裂位点,并启动细胞周期检查点信号传导和DNA修复活性的调控。精准的信号转导和断裂位点修复对于细胞的生存和防止致癌突变至关重要。因此,了解DNA修复过程中的相关机制尤为关键。在此应用中,我们使用FV3000共聚焦显微镜,研究了U2OS细胞(人骨肉瘤上皮细胞)DNA修复蛋白在激光诱导损伤处(包括双链DNA断裂位点)的募集过程。采集的图像不仅帮助我们确定募集到断裂位点修复蛋白的动力学信息和聚集水平,还验证了内源转录调节因子和DDR通路因子在DNA断裂位点的共定位。
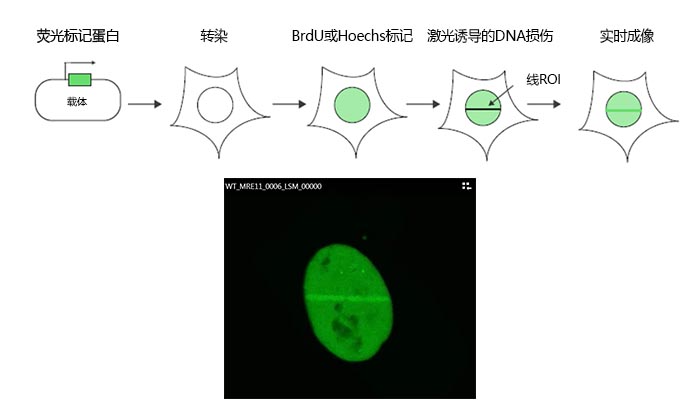
图1:实验方案示意图
将MRE11 cDNA克隆到带有GFP标签的表达载体中,然后将其转染到U2OS细胞。在使用溴脱氧尿嘧啶核苷(BrdU)或Hoechst进行标记后,使用FV3000共聚焦显微镜的405 nm激光对核内目标区域(ROI)进行线扫描诱导DNA损伤。随后使用488 nm激光进行活细胞成像,监测响应激光诱导损伤的MRE11募集的动力学过程。
成像条件
物镜:60倍超级色差校正油浸物镜(PLAPON60XOSC)
显微镜:FLUOVIEW FV3000激光扫描共聚焦显微镜
激光:405 nm(ROI刺激),488 nm(GFP,绿光)
用于定量测量的温和活细胞成像
由于延时成像过程中激光反复照射产生的光漂白和光毒性问题,会影响实验定量测量的准确性。我们的实验需要在强光刺激与温和活细胞成像之间取得平衡,在激光诱导DNA损伤后立即捕获可定量的修复蛋白动力学数据。为此,我们使用了奥林巴斯FV3000共聚焦显微镜,利用FV3000特有的TruSpectral全真光谱检测技术和高灵敏度GaAsP检测器,最大限度降低活细胞连续成像所需的激光强度。此外,我们在整个成像实验过程中一直使用TruFocus来保持对焦。这些技术帮助我们获取准确的时间序列数据,从而能够对DNA断裂位点上DDR因子MRE11的因损伤产生的聚集进行定量分析。
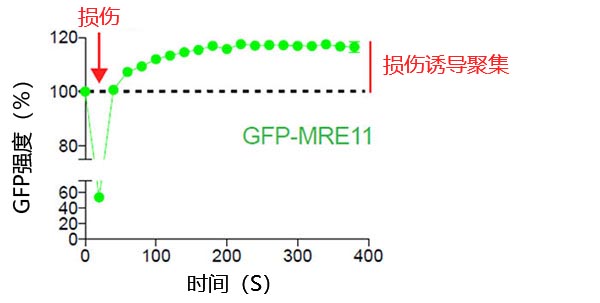 |
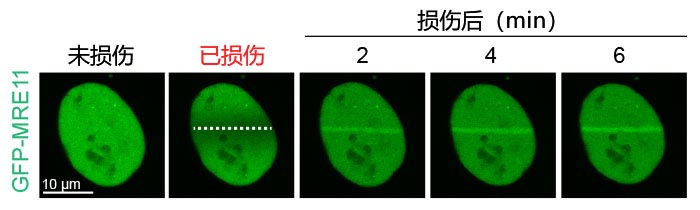
图2:损伤诱导MRE11在DNA断裂位点上聚集
利用405 nm激光对表达GFP-MRE11的U2OS细胞进行激光诱导DNA损伤,然后用488 nm激光对GFP进行时间序列成像。以20秒间隔对细胞成像6分钟,以便对DNA损伤前后MRE11的定位进行可视化和量化。
超级色差校正物镜实现精确的共定位分析
除了研究MRE11募集至链断裂位点的动力学过程之外,我们还检查了γH2AX(γH2AX是一种在DNA双链断裂处被磷酸化并激活DDR通路的组蛋白)和CHD4(一种在表观遗传转录调控中起重要作用的蛋白质)的反应。对于精确的共定位研究而言,关键点在于最大限度减小不同采集通道横向的色差偏移。为了降低横向和轴向色差对共定位研究的影响,我们使用了奥林巴斯超级色差校准物镜PLAPON60XOSC2并获得了精准可靠的共定位图像。这样我们就能够确定CHD4和γH2AX在细胞核DNA损伤位点的共定位。
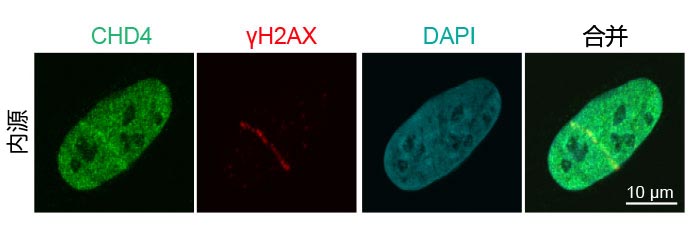
图3:募集内源性DNA损伤修复蛋白至DNA链断裂处
在对U2OS细胞(人骨肉瘤上皮细胞)进行激光诱导DNA损伤后检测内源性CHD4(绿色,Alexa Fluor 488)和γH2AX(红色,Alexa Fluor 594)。通道合并图像显示CDH4和γH2AX的共定位。
FV3000共聚焦显微镜如何助力我们的实验
全光谱检测系统实现高灵敏活细胞成像
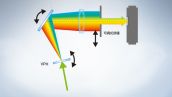
FV3000共聚焦显微镜采用奥林巴斯全真光谱TruSpectral检测技术,通过体相位全息透射光栅提高检测效率术。与采用反射型光栅的传统光谱检测单元相比,该技术可实现更高的光通量。FV3000显微镜的双通道高灵敏度光谱检测器(HSD)采用TruSpectral全真光谱检测技术和带有Peltier固体制冷的GaAsP检测器,能够实现45%的高量子效率和高信噪比。这种检测技术组合可实现出色的高灵敏度检测,并可最大限度减少活组织观察所需的激光功率。
PLAPON60XOSC2超级色差校正物镜提高了共定位分析的准确度
该油浸物镜可最大限度减小405-650 nm光谱中的横向和轴向色差,有助于采集到可靠的共定位图像,并进行超高定位精度的测量。该物镜在850 nm近红外光区也做了出色的色差校正,更适合定量分析。

低色差物镜
放大倍率:60X
NA:1.4(油浸)
工作距离:0.12 mm
色差补偿范围:405-650 nm
利用奥林巴斯的TruFocus系统保持对焦
TruFocus模块利用光毒性最小的红外光(1级激光)来识别样品焦平面位置。一键式自动聚焦(AF)模式可以让用户对更厚的样品设置多个聚焦位置,从而在多点实验中实现高效的Z-stack采集。
Dr. Kyle Miller的点评
Dr. Kyle Miller |
Dr. JaeJin Kim | 荧光成像技术广泛用于DNA损伤信号传导和修复研究,以及分析DNA损伤反应因子在DNA损伤部位的定位和动力学过程。获取这些信息对于在单细胞水平确定此类因子如何检测和修复DNA损伤至关重要。FV3000共聚焦显微镜让我们能够利用激光照射产生DNA损伤,并研究固定细胞和活细胞中DNA损伤反应因子的行为。FV3000共聚焦显微镜配有高灵敏检测器、自动聚焦功能和超级色差校正物镜,是进行肿瘤细胞DNA损伤反应通路研究的有效工具。 |
致谢
本应用指南的编写得到以下研究人员的协助:
The University of Texas at Austin, NMS, Dr. Kyle Miller and Dr. JaeJin Kim
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。

