Vergleich humaner iPS-Zelllinien mit dem Inkubations¸berwachungssystem CM20: Unterschiede in der Effizienz der Differenzierung zu Leberorganoiden bei verschiedenen iPS-Zelllinien
Einleitung
Induzierte pluripotente Stammzellen (iPS-Zellen) werden in der embryologischen Grundlagenforschung, z. B. zur Zelldifferenzierung und Organbildung, in der Arzneimittelforschung und zur Entwicklung diagnostischer Verfahren für Krankheiten häufig eingesetzt. Die Technologie zur Herstellung von aus humanen iPS-Zellen gewonnenen Mini-Geweben/-Organen – so genannten Organoiden – ist inzwischen so weit fortgeschritten, dass dreidimensionale Gewebe als Avatar für menschliche Organe verwendet werden können. Bis heute können viele iPS-Zelllinien, die sowohl von gesunden Probanden als auch von Patienten auf der ganzen Welt stammen, für Organoidstudien verwendet werden, um den genomischen Hintergrund von Krankheiten und die Prädisposition für Krankheiten bei jedem Patienten zu klären, indem die funktionellen und individuellen Unterschiede der erzeugten Organoide bewertet werden. Die Entstehung von Organoiden der Zielorgane dauert jedoch in der Regel mehr als einen Monat und ist teuer. Aufgrund der unterschiedlichen Differenzierungsfähigkeit und Proliferationsrate der verwendeten iPS-Zelllinien stellen die Stabilität und Reproduzierbarkeit der Organoidherstellung nach wie vor eine große Herausforderung dar. Dies ist eines der Hindernisse für Fortschritte in der Organoid-Forschung, die auf dem Vergleich mehrerer Proben von verschiedenen iPS-Zellen basiert.
Zur Lösung dieses Problems haben wir iPS-Zellen über einen langen Zeitraum quantitativ beobachtet, um Unterschiede im undifferenzierten Zustand und deren Zusammenhang mit zelllinienabhängigen Variationen in der Differenzierung zu Organoiden besser zu untersuchen.
Unter den humanen iPS-Zelllinien, die von 12 Spendern stammten, gelang es bestimmten Linien häufig nicht, sich zu Leberorganoiden zu differenzieren, obwohl für alle getesteten Zelllinien das gleiche Differenzierungsprotokoll angewandt wurde. Für diesen Anwendungshinweis haben wir ein Experiment durchgeführt, um den Zusammenhang zwischen den Eigenschaften von iPS-Zelllinien im undifferenzierten Zustand vor der Differenzierungsinduktion und dem Potential der Differenzierung zu Leberorganoiden besser zu verstehen.
Verwendung von iPS-Zellüberwachungsdaten aus dem CM20-System zur Bewertung der Differenzierung zu Organoiden
Mit dem CM20-Inkubationsüberwachungssystem von Olympus konnten wir den Kulturstatus quantitativ messen und Messdaten erfassen, die leicht mit früheren Ergebnissen verglichen werden konnten. Die Daten zur Koloniezahl und Dichte der iPS-Zellen können für eine detailliertere Analyse einfach in eine CSV-Datei exportiert werden.
In dieser Studie haben wir das Wachstum humaner iPS-Zelllinien von 12 Spendern während der Anzucht überwacht und dann zeitabhängige Daten zur Koloniezahl und Dichte für jede Zelllinie exportiert. Anschließend wandten wir das kürzlich von uns entwickelte Differenzierungsprotokoll an (*1), um Leberorganoide zu erhalten. Nach etwa einem Monat zählten wir die Anzahl der erzeugten Organoide und bestimmten den Grad der Albuminsezernierung als Funktion der vorhandenen der Leberorganoide. Wir verglichen auch die Wachstumsdaten der iPS-Zellen vor der Differenzierung mit den Daten der entsprechenden Leberorganoide für jede Zelllinie.
Kulturprotokoll und Datenanalyse
Es wurden Kulturen von zwölf humanen iPS-Zelllinien in einer 6-Well-Platte unter feederfreien Bedingungen angesetzt. Ungefähr eine Woche nach der Passage wurden die Zellen mit Accutase in einzelne Zellen dissoziiert und dann in eine neue Platte ausgesät. Sie wurden mit Activin A und BMP4 stimuliert, um sich aus einem undifferenzierten Zustand zu definitiven Endodermen zu differenzieren. Anschließend behandelten wir sie mit FGF4 und einem Wnt-Agonisten, um Sphäroide des hinteren Darmrohres zu erhalten. Für den Übergang zu einer dreidimensionalen Kultur betteten wir diese Sphäroide in Matrigel (Basalmembran-Matrix), gefolgt von einem Impuls mit Retinsäure (RA) in der frühen Phase der Organoidbildung. Die Zellen wurden bis zu einem Monat lang in einem Leberdifferenzierungsmedium weiter kultiviert, was zur Bildung von Leberorganoiden führte (Abb. 1A).
Anschließend zählten wir die Anzahl der Organoide und bestimmten die Albuminsezernierung mit einem ELISA abgenommener Mediumproben. Wir integrierten die undifferenzierten iPS-Zellproliferationsdaten, die mit dem CM20-Monitor gewonnen wurden, und analysierten die Korrelation zwischen den Merkmalen während der Erhaltungskultur und der Effizienz der Differenzierung zu Organoiden jeder iPS-Zelllinie (Abb. 1B).
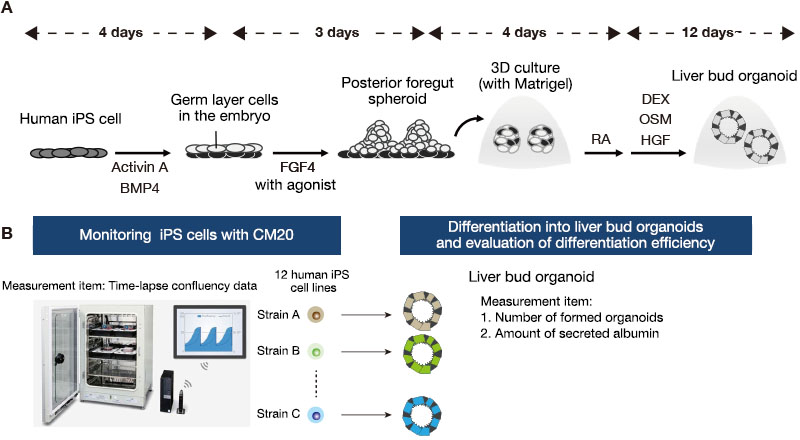
Abb. 1: Überwachung humaner iPS-Zellen während der Erhaltungskultur und Bewertung der Effizienz der Differenzierung zu Leberorganoiden.
(A) Kulturprotokoll zur Differenzierung humaner iPS-Zellen zu Leberorganoiden.
(B) Zusammenfassung der Vergleichsanalyse von Merkmalen während der iPS-Zellerhaltung und der Effizienz der Differenzierung zu Leberorganoiden bei 12 iPS-Zelllinien von verschiedenen Spendern.
In mehreren Versuchen, 12 humane iPS-Zelllinien zur Differenzierung zu Leberorganoiden zu induzieren, konnten wir aus den meisten Zelllinien Organoide gewinnen. Die iPS-Zelllinien I und J differenzierten sich jedoch häufig nicht (Abb. 2A). Obwohl die Albuminsezernierung (die Sezernierungsmenge je Organoid) in Abhängigkeit von der differenzierten Induktionscharge variierte, wiesen die aus den iPS-Zelllinien I und J abgeleiteten Leberorganoide – die eine extrem niedrige Effizienz bei der Organoidbildung aufweisen – außerdem eine niedrige Albuminsezernierung auf (Abb. 2B). Bei den iPS-Zelllinien mit hoher Effizienz bei der Organoidbildung fiel auf, dass die Albuminsezernierung bei einigen, z. B. Linie C, relativ niedrig war. Zur weiteren Validierung der Differenzierung wiesen wir nach, dass Leberorganoide, die aus anderen iPS-Zelllinien als I und J stammen, hepatozytenspezifische Marker exprimierten (Daten nicht gezeigt). Diese Daten deuten darauf hin, dass von den 12 getesteten Zelllinien die iPS-Zelllinien I und J nur eine eingeschränkte Fähigkeit zur Differenzierung in die Leberlinie aufweisen.
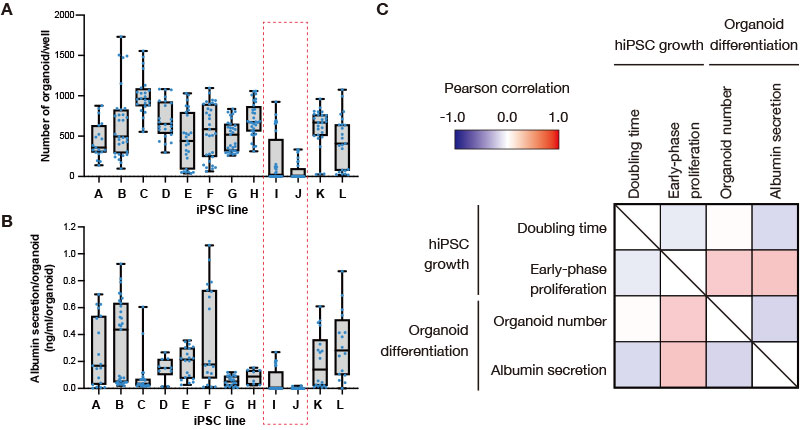
Abb. 2: Korrelationsanalyse der Zellproliferation vor der Differenzierungsinduktion und der Effizienz der Differenzierung zu Leberorganoiden bei verschiedenen humanen iPS-Zelllinien.
(A, B) Die Anzahl der während der Versuchsreihe zur Differenzierungsinduktion gebildeten Leberorganoide (A) und die Albuminsezernierung (B) wurden für jede iPS-Zelllinie in einem Boxplot dargestellt. Die blauen Punkte entsprechen der Anzahl der Wells, die in mehreren unabhängigen Experimenten gemessen wurden.
(C) Die Korrelationskarte zeigt die Wachstumsparameter humaner iPS-Zellen während der Kultur (Verdopplungszeit und Proliferation in der frühen Phase) und der Differenzierung zu Leberorganoiden (Organoidzahl und Albuminsezernierung).
Um zu untersuchen, ob der Zustand der iPS-Zellen vor dem Schritt der Differenzierungsinduktion die Effizienz der Differenzierung zu Leberorganoiden beeinflusst, haben wir die Korrelation zwischen den vom CM20-Monitor erfassten Proliferationsparametern, der Anzahl der gebildeten Organoide und der Albuminsezernierung bei jedem Differenzierungsinduktionsexperiment analysiert. Wir berechneten Korrelationskoeffizienten zwischen der Verdopplungszeit der iPS-Zellen vor der Differenzierungsinduktion (berechnet anhand der Konfluenzdaten des CM20-Monitors), der Wachstumseffizienz im Anfangsstadium der Proliferation (berechnet anhand einer von Dr. Takebe definierten Formel), der Anzahl der erzeugten Leberorganoide und der Albuminsezernierung für jedes Experiment. Wir berücksichtigten chargenabhängige Schwankungen, indem wir den Datensatz jedes Experiments analysierten (Abb. 2C). Die Anzahl der erzeugten Leberorganoide und die Albuminsezernierung wiesen zwar fast keine Korrelation mit der Verdopplungszeit der iPS-Zellen auf, auf, korrelierten aber positiv mit den Parametern der Proliferationseffizienz in der frühen Phase der iPS-Zellproliferation. Das bedeutet, dass einfache Unterschiede in der Verdopplungszeit zwischen den iPS-Zelllinien zwar nicht verwendet werden können um festzustellen, ob die erzeugten Leberorganoide eine gute oder eine schlechte Qualität aufweisen, es aber möglich ist, dass einige zwischen den Zelllinien beobachteten Unterschiede in den frühen Stadien der iPS-Zellproliferation die Effizienz der nachfolgenden Differenzierung zu Leberorganoiden beeinflussen.
Schlussfolgerung
Dank der quantitativen Daten des CM20-Monitors konnten wir Informationen aus früheren Zellkulturen bis hin zur Differenzierung in Organoide und sogar danach für unsere Untersuchung verwenden. Die Bilder und Daten lassen sich leicht exportieren und ermöglichen eine Vielzahl von Analysen, die zu neuen Erkenntnissen während des Kulturprozesses führen können.
In dieser Studie haben wir herausgefunden, dass die unterschiedliche Effizienz der Differenzierung zu Leberorganoiden bei verschiedenen iPS-Zelllinien erheblich von der Wachstumseffizienz der iPS-Zellen während der Anzucht beeinflusst werden kann, insbesondere in der frühen Wachstumsphase. Dies deutet darauf hin, dass es zur Erzeugung stabilerer und hochwertigerer Leberorganoide wichtig ist, den Zustand der iPS-Zellen unmittelbar nach der Passage zu überwachen, um zu wissen, ob sie für die Differenzierungsinduktion bereit sind. Auf der Grundlage dieser Korrelation kann durch Überwachung des Proliferationszustands der iPS-Zelllinien vorhergesagt werden, wann eine Zelllinie eine gute oder schlechte Differenzierungseffizienz aufweisen wird.
Olympus wird die Forschung mit dem CM20-Monitor fortsetzen, um Methoden für eine effiziente Qualitätskontrolle und Datenverwaltung zu entwickeln.
Kommentare von Dr. Takebe und Dr. Yoneyama
Dr. Takanori Takebe (links) | Bei der Verwendung mehrerer iPS-Zelllinien, die von verschiedenen Spendern stammen, und bei der Bewertung der Unterschiede zwischen den Spendern mithilfe von aus iPS-Zellen entstandenen Organoiden stoßen wir häufig auf das Problem, dass die Differenzierungseffizienz zwischen den iPS-Zelllinien variiert. Die Vorteile des CM20-Monitors, einschließlich der stabilen Überwachung von Proliferationszuständen und der Möglichkeit, die Daten zu exportieren, waren für uns sehr hilfreich, um eine Korrelationsanalyse zwischen der Proliferation von iPS-Zelllinien und der Differenzierungseffizienz der erzeugten Organoide bei 12 gleichzeitig getesteten Zelllinien durchzuführen. |
Literaturnachweis:
*1) Ouchi R, Togo S, Kimura M, Shinozawa T, Koido M, Koike H, Thompson W, Karns RA, Mayhew CN, McGrath PS, McCauley HA, Zhang RR, Lewis K, Hakozaki S, Ferguson A, Saiki N, Yoneyama Y, Takeuchi I, Mabuchi Y, Akazawa C, Yoshikawa HY, Wells JM, Takebe T. Modeling Steatohepatitis in Humans with Pluripotent Stem Cell-Derived Organoids. Cell Metabolism, 30(2): 374–384 (2019)
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
