Multiplexaje con el microscopio confocal FV3000
Caracterización de la morfología del córtex prefrontal medial del ratón
Estudiar mecanismos de deterioro cognitivo requiere la capacidad para asociar cambios morfológicos con respuestas fisiológicas. Por lo tanto, para comprender cómo los estados y tratamientos de las enfermedades se relaciona con la morfología del cerebro y la afectan, es importante poder identificar múltiples estructuras morfológicas dentro de una misma muestra. En el estudio que se expone, se utilizó el microscopio confocal FV3000 con los detectores TruSpectral para obtener imágenes a partir de seis diferentes estructuras del córtex prefrontal medial de un ratón (mPFC): astrocitos, neuronas piramidales, neuronas inhibidoras, membranas neuronales, segmentos iniciales de axón y núcleos.
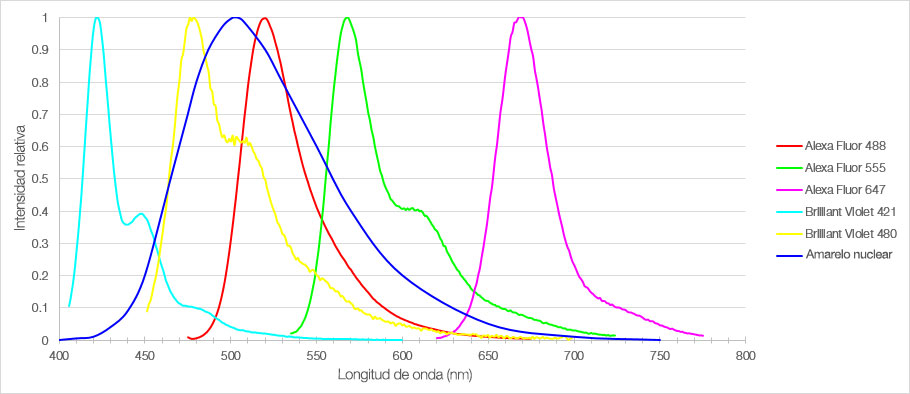
Figura 1: Espectro de emisión de los seis fluorocromos usados para etiquetar las secciones de la córtex prefrontal medial del ratón.
Tecnología TruSpectral que permite identificar seis diferentes estructuras
En este experimento, se marcó una sección fija de 30 µm de espesor del córtex prefrontal medial de un ratón con seis diferentes fluorocromos. Imágenes fluorescentes 3D del tejido cerebral multiplexado fueron adquiridas mediante un microscopio confocal FV3000 de Olympus dotado de un objetivo UPLSAPO20X. Se configuraron de forma individual los parámetros de adquisición y detección usando la detección TruSpectral para cada fluorocromo a fin de optimizar la detección de las señales y prevenir las interferencias entre los espectros. La imagen resultante muestra señales intensas de cada fluorocromo con distintos perfiles de emisión, lo que permite una detección precisa de múltiples estructuras en la misma muestra.
![Figura 2: Ratón mPFC etiquetado con proteína glial fibrilar acídica (GFAP; marcador de astrocitos [glial]; amarillo), proteína quinasa II dependiente de calmodulina (CaMKII; marcador de neuronas piramidales; rojo), precursor de la proteína 1 inducida por anfoterina (AMIGO-1; marcador de la membrana neuronal; cian), parvalbúmina (PV; marcador de la neurona inhibidora; púrpura), ankyrina-G (AnkG; marcador del segmento inicial del axón; verde) y amarillo nuclear (marcador de los núcleos; azul).](https://static4.olympus-lifescience.com/data/Image/Application/multiplexing-with-FV3000/appnote_multiplexing-with-fv3000_02.jpg?rev=351A)
Figura 2: Ratón mPFC etiquetado con proteína glial fibrilar acídica (GFAP; marcador de astrocitos [glial]; amarillo), proteína quinasa II dependiente de calmodulina (CaMKII; marcador de neuronas piramidales; rojo), precursor de la proteína 1 inducida por anfoterina (AMIGO-1; marcador de la membrana neuronal; cian), parvalbúmina (PV; marcador de la neurona inhibidora; púrpura), ankyrina-G (AnkG; marcador del segmento inicial del axón; verde) y amarillo nuclear (marcador de los núcleos; azul).
Condiciones de procesamiento de imágenes
Microscopio: Microscopio confocal de escaneo láser FLUOVIEW FV3000
Objetivo: Objetivo de aire de 20X (UPLSAPO20X)
Láseres: 405 nm (BV421, amarillo nuclear), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) y 640 nm (AF647)
Objetivo de aceite de silicona 100X que permite una imagen de alta resolución de las distintas estructuras morfológicas
Para obtener imágenes del ratón mPFC con mayor resolución, se utilizó el objetivo de aceite de silicona de 100X con los detectores de alta sensibilidad TruSpectral para obtener imágenes brillantes y detalladas de una región del córtex que muestra los seis marcadores. Esta combinación permitió a los investigadores observar claramente la morfología de las diferentes poblaciones de neuronas dentro del córtex prefrontal medial.
(A) | (B) |
Figura 3: Ratón mPFC etiquetado con proteína glial fibrilar acídica (GFAP; marcador de astrocitos [glial]; amarillo), proteína quinasa II dependiente de calmodulina (CaMKII; marcador de neuronas piramidales; rojo), precursor de la proteína 1 inducida por anfoterina (AMIGO-1; marcador de la membrana neuronal; cian), parvalbúmina (PV; marcador de la neurona inhibidora; púrpura), ankyrina-G (AnkG; marcador del segmento inicial del axón; verde) y amarillo nuclear (marcador de los núcleos; azul). A) Canales individuales de los seis fluorocromos (B) Imagen superpuesta
Condiciones de procesamiento de imágenes
Microscopio: Microscopio confocal de escaneo láser FLUOVIEW FV3000
Objetivo: Objetivo de aceite de silicona de 100 % (UPLSAPO100XS)
Láseres: 405 nm (BV421, amarillo nuclear), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) y 640 nm (AF647)
¿Cómo el microscopio confocal FV3000 favoreció a nuestro experimento?
Completo sistema espectral con detectores GaAsP de alta eficiencia que proporciona alta sensibilidad en el procesamiento multiplexado de imágenes
| Integrada en todos los microscopios confocales FV3000, la tecnología de detección TruSpectral permite un mayor rendimiento lumínico en comparación con las unidades de detección espectral convencionales. El holograma de fase y volumen difracta la luz con una eficiencia de transmisión hasta tres veces mayor en comparación con las redes de reflexión. Gracias al detector espectral de alta sensibilidad (HSD) del microscopio FV3000, es posible separar de forma óptima tanto las señales brillantes como las tenues, ajustando de forma independiente la sensibilidad de cada detector TruSpectral. Por otra parte, el algoritmo de deconvolución espectral del sistema FV3000 permite separar los espectros superpuestos en función de la información espectral obtenida a partir de las imágenes apiladas por configuración lambda. La interferencia de la fluorescencia entre los canales puede eliminarse mediante el algoritmo de separación espectral tanto durante la adquisición de imágenes en vivo como durante el post-procesamiento, lo que permite una separación nítida de hasta dieciséis fluorocromos. | Videos asociados |
Objetivo de inmersión en aceite de silicona UPLSAPO100XS para procesar imágenes brillantes del tejido grueso
Los objetivos superapocromáticos UPLSAPO compensan las aberraciones esféricas y cromáticas y se dotan de una alta transmisión desde la región visible hasta la infrarroja cercana. El índice de refracción del aceite de silicona (ne≈1,40) es muy similar al del tejido vivo (ne≈1,38), lo que permite realizar observaciones de alta resolución en profundidad dentro del tejido vivo, minimizando la aberración esférica y proporcionando una morfología precisa en 3D.
|
Magnificación: 100X
A. N.: 1.35 (inmersión en aceite de silicona) D. T.: 0,2 mm Nivel de corrección de aberración cromática: Super Apochromat (SAPO) [superacromático] |
Uso del microscopio FV3000 para investigar los impactos del dolor neuropático en el cerebro a nivel molecular
Observaciones de Stephanie Shiers
 | Nuestro trabajo se enfoca en el deterioro cognitivo con respecto a la dependencia funcional del córtex prefrontal medial (mPFC) a nivel del dolor neuropático. Investigamos la plasticidad estructural en el mPFC para dilucidar los tipos de células que intervienen en la disfunción cortical y comprender los cambios funcionales de dichas células. Se ha observado una reducción de la longitud de los segmentos iniciales de los axones (AIS) en el mPFC de ratones machos con dolor neuropático que se correlaciona con un rendimiento deficiente en una tarea cognitiva (Shiers, et al. J Neurosci 2018, Shiers, et al. Neuropsychopharmacology, 2019). Comprender la morfología de estos tipos de células nos proporciona pistas sobre lo que subyace en la disfunción cognitiva con respecto al dolor, y cómo debe ser tratado. El procesamiento de imágenes con alta resolución mediante el microscopio FV3000 ha sido esencial para nuestros análisis de nivel microarquitectural en el mPFC. |
Observaciones del Dr. Theodore Price
 | Un objetivo principal de nuestra investigación es entender cómo el dolor neuropático afecta las estructuras cerebrales que están íntimamente involucradas en el proceso cognitivo. Se sabe que los problemas cognitivos son una comorbilidad importante para el dolor neuropático; sin embargo, poco se sabe sobre los fundamentos moleculares. Sin embargo, el trabajo que efectuamos en el córtex prefrontal del ratón ha revelado cambios sutiles en el AIS que son causados por el dolor neuropático. Así pues, la capacidad para obtener imágenes de la más alta calidad de la ultraestructura del córtex prefrontal gracias al microscopio FV3000 nos ha abierto nuevos caminos para entender este importante aspecto del dolor neuropático. |
Reconocimientos
Esta nota de aplicación has sido preparada con la ayuda de los siguientes investigadores.
Stephanie Shiers, estudiante de doctorado, Laboratorio Price, Universidad de Texas, Dallas.
Theodore J. Price, doctor (Ph.D.), Laboratorio Price; Eugene McDermott, profesor y director del
Centro de investigación y estudios avanzados del dolor, Departamento de neurobiología, Escuela de ciencias del comportamiento y neurología, Universidad de Texas, Dallas.
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
![Figura 3: Ratón mPFC etiquetado con proteína glial fibrilar acídica (GFAP; marcador de astrocitos [glial]; amarillo), proteína quinasa II dependiente de calmodulina (CaMKII; marcador de neuronas piramidales; rojo), precursor de la proteína 1 inducida por anfoterina (AMIGO-1; marcador de la membrana neuronal; cian), parvalbúmina (PV; marcador de la neurona inhibidora; púrpura), ankyrina-G (AnkG; marcador del segmento inicial del axón; verde) y amarillo nuclear (marcador de los núcleos; azul). A) Canales individuales de los seis fluorocromos (B) Imagen superpuesta](https://static3.olympus-lifescience.com/data/Image/Application/multiplexing-with-FV3000/appnote_multiplexing-with-fv3000_03.jpg?rev=351A)
![Figura 3: Ratón mPFC etiquetado con proteína glial fibrilar acídica (GFAP; marcador de astrocitos [glial]; amarillo), proteína quinasa II dependiente de calmodulina (CaMKII; marcador de neuronas piramidales; rojo), precursor de la proteína 1 inducida por anfoterina (AMIGO-1; marcador de la membrana neuronal; cian), parvalbúmina (PV; marcador de la neurona inhibidora; púrpura), ankyrina-G (AnkG; marcador del segmento inicial del axón; verde) y amarillo nuclear (marcador de los núcleos; azul). A) Canales individuales de los seis fluorocromos (B) Imagen superpuesta](https://static2.olympus-lifescience.com/data/Image/Application/multiplexing-with-FV3000/appnote_multiplexing-with-fv3000_04.jpg?rev=55DD)
