Conor L. Evans, PhD, est un professeur, chercheur et expert en microscopie qui applique ses connaissances et ses compétences en résolution de problèmes pour concevoir de nouveaux outils optiques et d’imagerie destinés aux soins aux patients. Nous avons rencontré le Dr Evans pour discuter de son parcours en tant que chercheur clinique, de l’importance de la microscopie dans son travail et de la manière dont il utilise les systèmes pour relever les défis de la médecine et de la biologie. Apprenez-en plus sur le Dr Evans et lisez l’interview ci-dessous.
À propos de Conor L. Evans
Le Dr Conor Evans est titulaire d’un baccalauréat en physicochimie de la Brown University et d’un doctorat en chimie de la Harvard University. Il est professeur associé à la Harvard Medical School, membre affilié du corps professoral du programme de biophysique de la Harvard University et membre du corps professoral du Laser Biomedical Research Center.
Le Dr Evans dirige le laboratoire Evans au Wellman Center for Photomedicine du Massachusetts General Hospital (MGH). Le laboratoire conçoit et utilise une gamme d’outils et de méthodes de microscopie pour détecter, mesurer et quantifier des informations cachées afin de répondre aux besoins non satisfaits en matière de soins aux patients. La recherche et les innovations de son laboratoire lui ont valu de nombreux prix et brevets alors qu’il s’efforce d’appliquer ses technologies à la pratique clinique.
Q. : Vous avez une formation universitaire en physicochimie et en chimie. Comment votre parcours vous a-t-il amené à vous concentrer sur la recherche sur les soins aux patients ? Et comment avez-vous appris autant sur la microscopie ?
Dr Evans : J’ai toujours été intéressé par la biomédecine et j’envisageais de poursuivre des études en neurosciences avant de tomber amoureux de la chimie et de la physicochimie. Lorsque j’ai commencé mon doctorat, je voulais travailler dans la recherche appliquée et interdisciplinaire, où la physicochimie pourrait être un pont vers la résolution de problèmes plus importants.
J’ai rejoint le laboratoire de Sunney Xie à Harvard, où j’ai eu l’incroyable chance de travailler au sein de son équipe pour développer la diffusion Raman anti-Stokes cohérente (DRASC) en une technique de microscopie robuste pour la biomédecine. Dans le laboratoire de Sunney, j’ai eu la chance de travailler en étroite collaboration avec Eric Potma alors qu’il faisait son postdoctorat. Il m’a appris à peu près tout ce que je sais sur la microscopie. J’ai dû construire, démonter et reconstruire environ 15 microscopes avec Eric sur une période de trois ans !
J’aurais peut-être continué à mener des recherches plus académiques en chimie si ce n’était pour deux choses. Premièrement, Sunney a constaté mon intérêt envers la recherche appliquée et m’a encouragé à explorer les applications médicales de la microscopie DRASC. Une fois que j’ai commencé à voir toutes les possibilités, je suis devenu passionné ! Deuxièmement, j’ai été inspiré par mon frère, qui est devenu urgentologue. Sa passion pour les soins aux patients m’a amené à faire le saut vers un postdoctorat au Massachusetts General Hospital (MGH), où j’ai eu la chance de travailler pour la première fois dans la recherche axée sur le patient.
Q. : Pouvez-vous nous parler des domaines d’intérêt de votre laboratoire ? Qu’espérez-vous accomplir grâce à chaque programme de recherche ?
1. Capteurs d’oxygène
Dr Evans : Les travaux de mon laboratoire sur les capteurs d’oxygène se concentrent sur le développement de nouvelles boîtes à outils pour mesurer quantitativement la concentration d’oxygène dans les tissus, mieux connue sous le nom de pO2. Alors que ce programme de recherche a commencé pour répondre aux défis des traitements contre le cancer, notre objectif a changé après que j’ai eu l’occasion de visiter le Center for the Intrepid du San Antonio Medical Center.
Rencontrer des militaires blessés et apprendre la myriade de défis associés à leurs soins nous a amenés, mon équipe et moi, à lancer un programme de recherche pour développer des capteurs d’oxygène moléculaire pouvant être utilisés directement dans les soins aux patients. Aux côtés de Manolis Rousakis, un instructeur de mon équipe, nous avons créé une famille de capteurs d’oxygène à porphyrine ultralumineux et appris à intégrer et à conjuguer ces capteurs dans une large gamme de matériaux et de facteurs de forme pour voir directement et quantifier l’oxygène des tissus.
Nous avons créé des films, des bandages pouvant être peints et pulvérisés, des matériaux de bandage d’hydrogel, des capteurs portables et, plus récemment, des capteurs installés sur des aiguilles et des cathéters, chacun ciblant différents besoins en matière de soins médicaux des patients et des militaires. Nous travaillons maintenant avec des partenaires commerciaux pour traduire ces technologies en produits réels afin d’améliorer la santé des patients.
2. Outils pour visualiser et mesurer l’absorption des médicaments et les effets thérapeutiques in vivo
Dr Evans : L’un des enjeux majeurs du développement des médicaments est de s’assurer qu’ils atteignent bien leurs cibles cellulaires et subcellulaires. Alors que les grosses molécules, comme les médicaments biologiques, peuvent être facilement marquées, cela peut représenter un défi pour les petites molécules thérapeutiques, car les marqueurs traditionnels peuvent être plus grands que la molécule elle-même et modifier complètement sa pharmacocinétique. Des approches telles que le marquage radiographique et les méthodes spectrales de masse offrent un aperçu de l’absorption des médicaments, mais elles ne sont pas compatibles avec la recherche clinique ou nécessitent une biopsie.
Nous nous intéressons aux approches qui permettent l’imagerie et la quantification des médicaments en fonction des propriétés intrinsèques de la molécule, telles que les paramètres de fluorescence et les vibrations chimiques. Nous mettons au point des approches d’imagerie qui utilisent la durée de vie de la fluorescence et des approches d’imagerie de diffusion Raman cohérente avec des applications actuelles dans la quantification des agents cutanés topiques. En étroite collaboration avec des partenaires commerciaux et la Food and Drug Administration (FDA) des États-Unis, nous créons de nouvelles approches d’imagerie de diffusion Raman cohérente pour mesurer la biodisponibilité et la bioéquivalence des médicaments, cette dernière pouvant être un outil important pour le développement de médicaments topiques génériques.
Pour transférer ces outils du laboratoire expérimental à une utilisation clinique, nous avons conçu un système d’imagerie de diffusion Raman cohérente sur chariot qui devrait être utilisé dans le cadre des premières études cliniques chez l’homme dans les prochains mois. Notre objectif est de coupler l’observation de l’absorption des médicaments avec les effets thérapeutiques en aval pour obtenir une compréhension complète de la réponse au traitement pharmacologique au niveau cellulaire à tissulaire. Nous considérons cette approche d’imagerie clinique comme la première étape dans l’évaluation directe de l’absorption des médicaments chez les personnes en bonne santé et les patients malades afin de mettre en place de meilleures thérapies et interventions.
3. Analyse d’images par apprentissage profond
Dr Evans : L’apprentissage profond a été un outil fantastique pour surmonter certains de nos plus grands défis en matière d’analyse d’images et de signaux. Nos microscopes et nos capteurs génèrent une énorme quantité de données, parfois des centaines de gigaoctets par jour, qui nécessitent une analyse automatisée.
Il est tout simplement impossible qu’une seule personne, ou même une équipe de scientifiques, puisse trier manuellement autant de données d’image. C’était frustrant de travailler avec des méthodes d’analyse visuelle et informatique qui, bien qu’efficaces, pouvaient échouer ou introduire des biais dans l’analyse, surtout quand je pouvais simplement regarder une image et savoir instantanément ce qui fonctionnait ou non.
L’apprentissage profond nous a permis de tirer parti de notre expérience et de notre intuition et de transférer ces connaissances sur un ordinateur, ce qui a permis une automatisation complète de nos tâches analytiques complexes. Nous avons pu appliquer l’apprentissage profond à notre travail en pharmacocinétique ainsi que dans de nouveaux domaines, comme nos capteurs d’oxygène portables. Nous sommes ravis de poursuivre les progrès de l’informatique de pointe, où les modèles d’apprentissage profond peuvent être utilisés directement sur des appareils dans des applications allant du développement de médicaments aux capteurs portables en médecine.
Q. : Quel sujet de recherche vous revigore, ou quelle question principale aimeriez-vous résoudre ?
Dr Evans : Je dirais qu’un thème récurrent dans mes recherches a été de rendre visible et quantifiable « l’invisible ». J’ai toujours été intéressé par l’obtention d’informations normalement cachées ou hors de portée, c’est une curiosité professionnelle. Mon équipe et moi avons travaillé à la création de méthodes, d’outils et de capteurs pour mettre à jour ces paramètres et les rendre quantifiables, qu’il s’agisse de la concentration d’oxygène dans les tissus, de la quantité de médicaments qui atteint une cible ou de l’état d’une cellule soumise à un traitement.
Q. : Qu’est-ce qui vous a poussé à chercher des informations cachées ou « invisibles » ?
Dr Evans : Pendant mon doctorat, j’ai travaillé sur un problème difficile en imagerie de diffusion Raman cohérente, qui était la suppression de la contribution non résonnante en microscopie CARS. L’imagerie CARS souffre de cette contribution chimiquement non spécifique qui constituait un obstacle majeur aux applications en biologie et en médecine.
Nous avons supposé que ce bruit de fond pouvait être identifié et éliminé par phase : la contribution non résonnante était mathématiquement « réelle », tandis que la contribution résonnante chimiquement spécifique avait à la fois des contributions mathématiquement « réelles » et « imaginaires ». Nous avons trouvé un moyen d’isoler ces deux composantes, en particulier la composante d’imagerie du champ CARS, et de supprimer la contribution non résonnante grâce à l’interférométrie. Brian Saar, alors étudiant au laboratoire de Sunney, a plaisanté en disant que j’avais « rendu l’imaginaire réel », ce que j’aimais et que j’ai pris à cœur tout au long de ma carrière.
Q. : Que cherchez-vous à apprendre dans le cadre de vos recherches ? Comment la microscopie s’intègre-t-elle ?
Dr Evans : Il y a tellement de choses que j’espère apprendre ! L’un des aspects passionnants et ardus de travailler si près des cliniciens au quotidien est que vous êtes sans cesse confronté à vos limites au vu de ce qui n’est tout simplement pas connu ou compris en médecine et en biologie. Il existe un puits sans fond de problèmes à résoudre. J’espère continuer à me consacrer à la résolution de problèmes de santé humaine et de médecine en tirant parti à la fois de la photochimie et de la photonique, deux boîtes à outils complémentaires parfaitement transposables.
La microscopie se situe à l’intersection de la photochimie et de la photonique. La photochimie procure un contraste moléculaire. La photonique donne les moyens de voir, de détecter et de quantifier. Pour moi, la microscopie est le pilier de mes recherches, car elle nous offre la possibilité de comprendre directement les processus spatio-temporels, qu’ils soient dans les tissus ou les cellules.
Bon nombre de nos objectifs de recherche à court et à long terme sont conditionnés par les progrès continus des techniques microscopiques, tels que nos travaux en pharmacologie et en biologie du cancer. Ces progrès se répercutent au-delà des microscopes dans notre travail sur les bandages et les capteurs portables. Nous nous tournons souvent vers l’imagerie et la microscopie pour comprendre les méthodes de fabrication, les propriétés des matériaux, etc. Cela fait de la microscopie une ressource centrale dans nos efforts de recherche axés sur les problèmes.
Q. : Comment utilisez-vous l’imagerie multiphotonique et confocale dans votre travail ?
Dr Evans : Je dirais que l’imagerie multiphotonique a été l’aspect principal de mes recherches, l’imagerie confocale jouant un rôle de soutien important. L’imagerie de diffusion Raman cohérente, un outil central de notre travail, est une technique multiphotonique qui procure de nombreux avantages clés de l’imagerie à deux et trois photons : excitation lumineuse dans le proche infrarouge, imagerie des tissus profonds et sectionnement focal automatique en profondeur. Nous avons développé une imagerie de diffusion Raman cohérente, à la fois CARS et de diffusion Raman stimulée (SRS), en tant qu’outils de recherche biomédicale qui sont maintenant sur le point d’être utilisés dans des applications cliniques humaines directes.
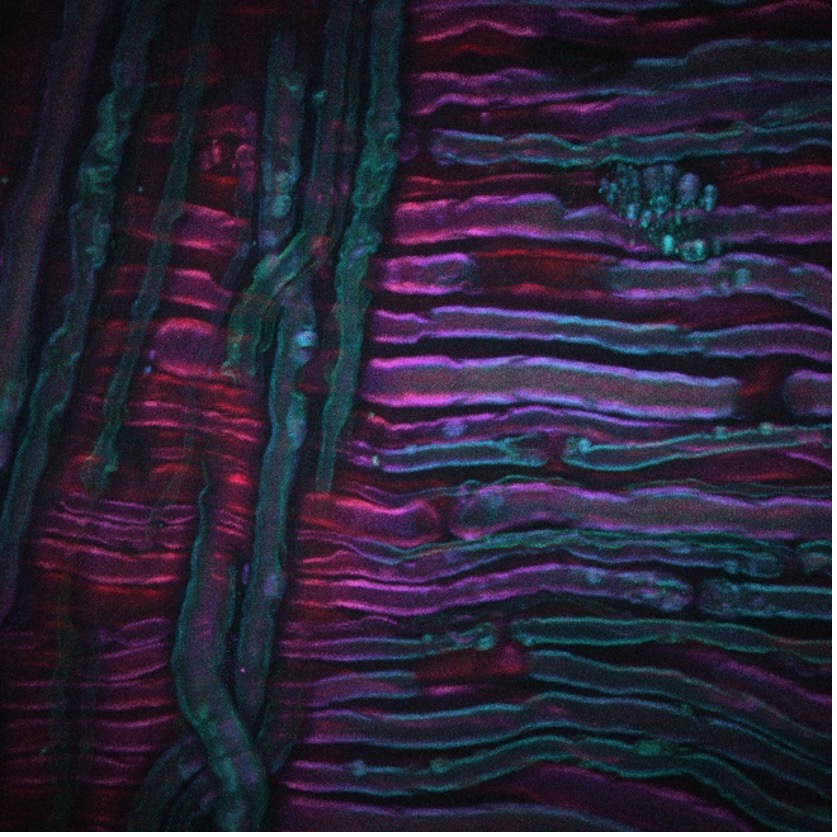
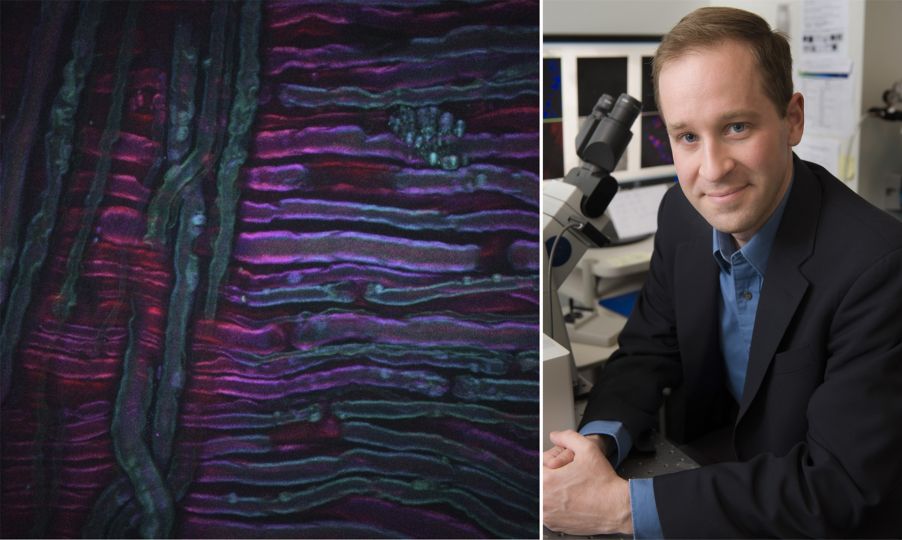
À titre d’exemple, l’image ci-dessus montre une image DRASC d’un nerf sciatique de rat ayant subi une traitement par le froid, une nouvelle technique de traitement de la douleur développée par nos collaborateurs Lilit Garibyan et Rox Anderson ici, au MGH. Le système d’imagerie CARS a été focalisé sur le tronçon symétrique CH2 des lipides non saturés, révélant la distribution de la myéline. L’image a été prise par Isaac Pence, PhD, chercheur faisant partie mon équipe, et n’aurait pas été possible sans Sara Moradi Tuchayi, MD.
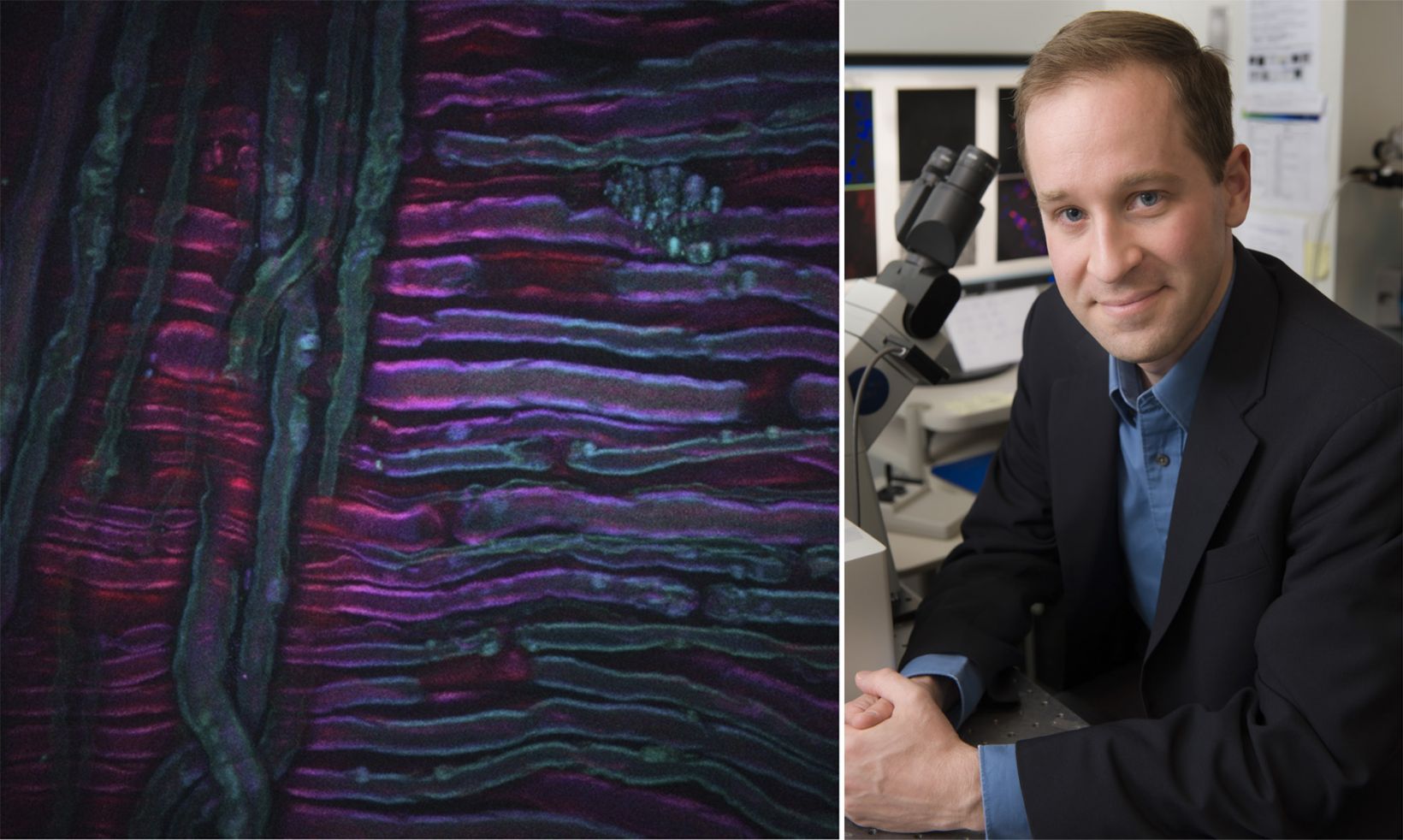
Ce deuxième exemple, illustré ci-dessus, est une image SRS du ruxolitinib, un médicament, (vert, SRS focalisé sur la bande de vibration du nitrile) administré dans de l’éthanol à la surface de la peau d’une souris. Ici, le médicament peut être vu accumulé dans les parties riches en lipides de la couche cornée de la souris par imagerie SRS focalisée sur la vibration de valence symétrique CH2 (rouge). L’image a été prise par Amin Feizpour, PhD, qui était chercheur dans mon équipe.
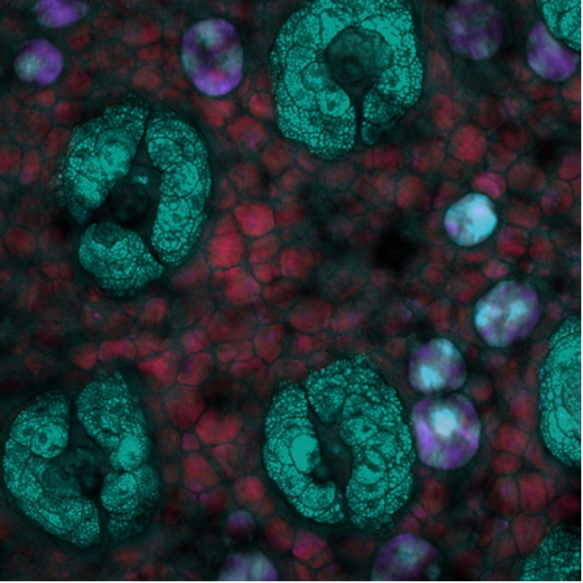
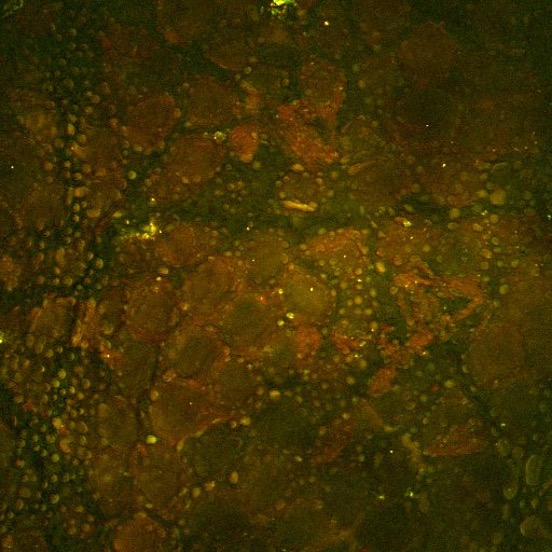
Enfin, cette image SRS en profondeur a été prise à l’intérieur de la peau d’une souris, les profondeurs étant codées par couleurs. Ici, des structures riches en lipides isolées à l’intérieur de la peau de la souris peuvent être vues à différentes profondeurs avec le système focalisé sur la vibration de valence symétrique CH2. Image prise par Isaac Pence, PhD.
Q. : Pouvez-vous nous indiquer certains des jalons notables de vos recherches ?
Dr Evans : Cette année marquera quelques étapes importantes pour notre équipe, tant en ce qui a trait à nos programmes de microscopie qu’à nos études de détection. Nous avons publié notre première étude sur l’utilisation chez l’homme de notre boîte à outils de détection de l’oxygène dans Science Advances et menons actuellement trois études supplémentaires de cette nouvelle plateforme de détection chez l’homme. Nous avons entamé une nouvelle collaboration avec 3M pour pour développer des produits commerciaux à partir de nos outils expérimentaux.
Du côté de la microscopie, nous sommes ravis de publier notre nouvelle approche appelée S4RS (sparse spectral sampling stimulated Raman scattering, diffusion Raman stimulée par échantillonnage spectral discontinu), qui surmonte tant d’obstacles auxquels nous avons été confrontés dans l’imagerie de diffusion Raman cohérente au cours des dernières années. Cette approche utilise un laser à fibre rapidement focalisable pour passer à des bandes Raman précises à travers le spectre Raman, plutôt que d’être focalisé sur toute l’étendue du spectre. Cela permet une acquisition spectrale rapide et chimiquement précise à travers le spectre Raman et ouvre la porte à l’imagerie et à la quantification d’un large éventail d’espèces moléculaires telles que les médicaments et les métabolites. En parallèle, nous avons utilisé ce système laser pour construire un système clinique d’imagerie de diffusion Raman cohérente, qui sera mis en service cette année dans le cadre de premières études humaines.
Malgré les défis entraînés par la COVID-19, mon équipe a accompli un travail formidable pour transférer nos technologies. Je ne pourrais pas être plus fier de ce qu’ils ont accompli.
Q. : Selon vous, quelle sera la prochaine révolution en microscopie ?
Dr Evans : De mon point de vue, un gros problème en microscopie est le déluge de données auquel nous devons tous faire face. Les microscopes multicanaux automatisés sont fantastiques pour collecter d’énormes quantités de données. Nous avons développé des protocoles d’imagerie qui permettent de collecter rapidement et efficacement plusieurs colorants, fluorophores, canaux spectraux et autres points de données.
Cela entraîne cependant le défi d’extraire des informations réelles des énormes ensembles de données que nous obtenons. Les données de microscopie sont riches en informations. La collecte d’ensembles de données à cinq dimensions est relativement simple, et ces données sont spatiales, spectrales et temporelles. Bien qu’il soit parfois possible de trier ces données manuellement, des informations approfondies et une rigueur statistique nécessitent une analyse informatique de ces données multidimensionnelles complexes.
Je crois que la prochaine révolution en microscopie surmontera ces problèmes de données volumineuses et qu’elle est déjà en marche. Les progrès de la visualisation des données, des algorithmes d’analyse d’images et de l’apprentissage automatique jouent tous un rôle important dans la résolution des problèmes de données de microscopie de moyenne et grande envergure. Je vois le travail des neuroscientifiques ouvrir la voie, avec des projets de connectome et d’atlas du cerveau montrant ce qui peut être fait.
Ces programmes, cependant, représentent d’énormes efforts avec une multitude de chercheurs interdisciplinaires, de scientifiques des données et de programmeurs qui soutiennent et stimulent les avancées. À l’heure actuelle, cependant, ces ressources ne sont pas disponibles pour les petits laboratoires. Cette situation est amplifiée par le fait que le parcours de formation traditionnel des chercheurs en microscopie n’enseigne pas encore universellement les compétences nécessaires pour traiter des ensembles de données d’imagerie volumineux et complexes. Bien que cette révolution soit déjà en cours, il va falloir jeter un nouveau regard sur la façon dont nous formons nos étudiants et confrères, ainsi que sur la façon dont nous abordons les données de microscopie pour communiquer ces avancées à tous ceux qui travaillent en microscopie.
Cette révolution est particulièrement importante pour l’avenir translationnel de la microscopie, où l’imagerie à l’échelle microscopique jouera un rôle de plus en plus important dans tout, du diagnostic des maladies aux traitements personnalisés. Nous avons déjà les « pilules de microscopie » de Gary Tearney qui peuvent être avalées pour fournir des diagnostics in situ, une analyse par cytométrie en flux et imagerie des cellules dérivées du patient et le criblage thérapeutique des cellules CAR-T à haut débit.
Au fur et à mesure que ces plateformes fondées sur la microscopie s’étendent à des applications encore plus axées sur les patients, le déluge de données ne fera que croître et la nécessité maîtriser ces ensembles de données et d’exceller à les analyser ne fera que devenir plus importante.