Comprendre le lien entre les données d’images numériques et les échantillons biologiques
Le présent article technique traite du lien entre les signaux détectés dans les échantillons biologiques et les données numériques provenant des caméras de microscope. Bien comprendre ce lien peut vous aider à établir les conditions d’acquisition d’images idéales qui vous permettront d’obtenir des images et des données de qualité optimale.
Principes de base de l’imagerie numérique
Une caméra monochrome pour microscope est un appareil qui détecte et visualise la lumière émise par les échantillons biologiques. Le microscope capte la fluorescence émise par les fluorochromes ou les protéines fluorescentes, puis la caméra détecte cette lumière et la convertit en photoélectrons qui seront détectés en tant que signal numérique.
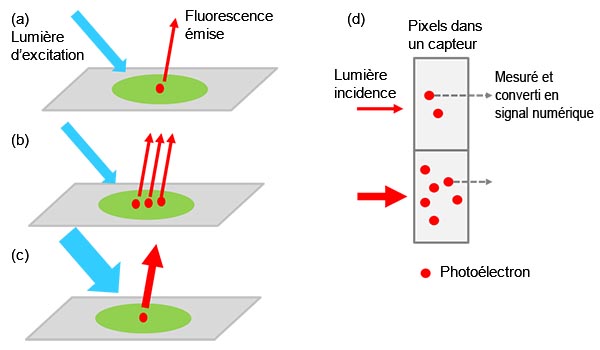
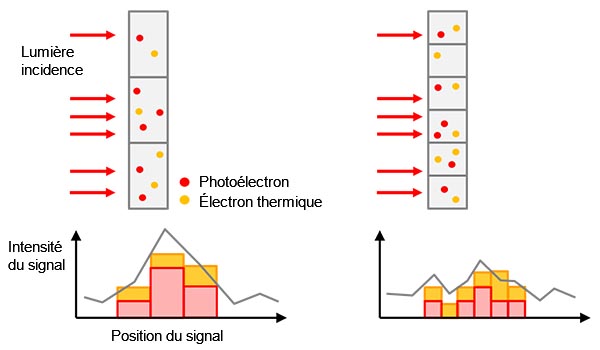
L’intensité du signal détecté est le résultat d’une équation complexe dans laquelle sont pris en compte le nombre de cibles marquées (p. ex. protéines cibles), l’intensité de la lumière d’excitation, l’efficacité de l’excitation et de l’émission/la détection de la fluorescence, ainsi que l’efficacité de conversion de la lumière en signal numérique par la caméra (figure 1).
Lorsque vous utilisez le même système et les mêmes paramètres d’acquisition d’image pour différents échantillons dans une même expérience, tous les composants, à l’exception de la quantité de cibles, deviennent des valeurs constantes, ce qui rend la valeur du signal détecté proportionnelle à la quantité de cibles. Cela signifie, par exemple, que vous pouvez comparer quantitativement un échantillon génétiquement modifié avec son équivalent sauvage.
Figure 1 – De l’échantillon au signal numérique : (a) Une molécule cible marquée excitée émet de la lumière fluorescente. |
Anatomie du signal et du bruit de fond
Cette section explique les principaux facteurs qui contribuent à la qualité de l’image et souligne l’importance du soin accordé à l’acquisition d’image pendant une expérience.
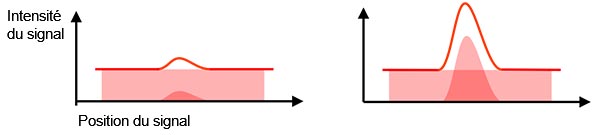
Signal réel et signal de fond : Le signal détecté contient le signal réel et le signal de fond (bruit de fond). Pour détecter votre cible en la différenciant des signaux de fond, le rapport entre l’intensité du signal réel et l’intensité du signal de fond doit être suffisant (figure 2). Ce rapport se nomme « rapport signal sur bruit ». En visant un rapport signal sur bruit plus élevé, vous obtenez une meilleure qualité d’image et des analyses quantitatives plus précises.
En général, la maximisation du signal réel (p. ex. avec un objectif ayant une ouverture numérique supérieure) et la réduction au minimum des signaux de fond (p. ex. avec une chambre noire, un refroidissement plus important ou une caméra à efficacité quantique élevée) sont des méthodes couramment utilisées pour améliorer le rapport signal sur bruit.
Il est à noter que le réglage du gain, qui définit le facteur d’amplification du signal dans une caméra, n’améliore pas le rapport signal sur bruit puisqu’il a une incidence à la fois sur le signal réel et sur le signal de fond.
Figure 2 – À gauche : Faible rapport signal sur bruit : le bruit de fond rend difficile la détection du signal réel. |
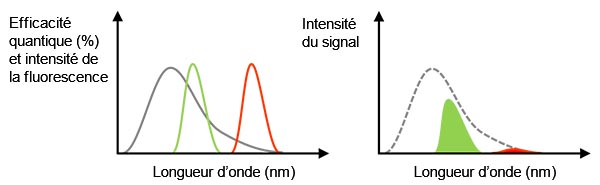
Signal réel :Comme nous l’avons mentionné précédemment, l’utilisation d’un objectif à ouverture numérique élevée peut améliorer le rapport signal sur bruit. Un autre facteur important dans l’obtention d’un meilleur signal est l’efficacité quantique élevée. L’efficacité quantique indique l’efficacité de conversion de la lumière incidente en photoélectrons. Il ne faut pas oublier que la caméra ne détecte pas la lumière si son efficacité quantique est de 0 % pour la longueur d’onde désirée. Par exemple, il faut choisir une caméra qui capte les longueurs d’onde supérieures à 720 nm pour utiliser des colorants fluorescents dans le proche infrarouge comme le Cy7 pour une fenêtre proche infrarouge dans les tissus biologiques ou pour empêcher les interférences en cas de marquages multiples.
Figure 3 – À gauche : La ligne grise représente l’efficacité quantique d’une caméra. Les lignes verte et rouge indiquent le spectre de l’émission de fluorescence. À droite : La valeur du signal détecté équivaut à l’aire du pic, qui est le produit du spectre d’efficacité quantique et du spectre de fluorescence sur la figure de gauche.Dans ce cas, même si l’intensité de la lumière de fluorescence est suffisante, le signal détecté sera faible en raison d’une faible efficacité quantique à cette longueur d’onde. |
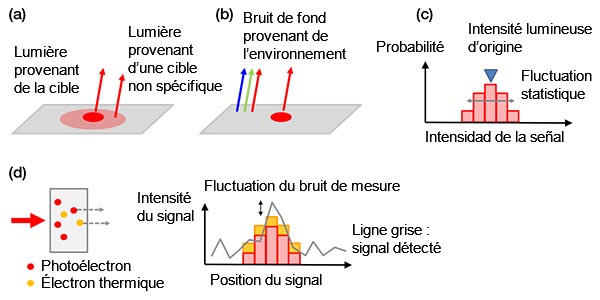
Bruit de fond : Les signaux de fond peuvent être divisés en différentes catégories :
a) signaux de fond biologiques ;
b) signaux de fond non biologiques ;
c) fluctuations aléatoires des photoélectrons (bruit de grenaille);
d) bruit de la caméra.
Le bruit de grenaille est unique et son importance peut être comparée à un tirage à pile ou face. Tout comme la probabilité de 50 % d’obtenir « face » peut diminuer si on effectue le tirage deux fois – car on pourrait obtenir « pile » l’une des deux fois –, toute tentative avec un nombre de tirages N amène une fluctuation statistique de ±√(N). Le nombre de photoélectrons détectés suit la même règle.
Tous les exemples de bruit de fond sont illustrés sur la figure 4 ci-dessous.
Figure 4 – Exemples de bruits de fond : (a) bruit de fond biologique provenant d’une coloration non spécifique ou de l’autofluorescence, (b) lumière ambiante de la pièce se réfléchissant sur une lame, (c) bruit de grenaille, (d) bruits d’une caméra qui contient des électrons thermiques générés dans un capteur (à gauche) et bruit de mesure (à droite). Les électrons thermiques peuvent être réduits par le refroidissement du capteur. |
Résolution : Une grande taille de pixels ou une acquisition d’images par regroupement de pixels (« binning ») permettent la détection d’une plus grande quantité de lumière et offrent un rapport signal sur bruit supérieur, mais plus la taille des pixels est grande, plus faible est la résolution (figure 5). Optez pour la taille de pixels optimale pour la résolution optique.
Figure 5 – À gauche : Une taille de pixels supérieure augmente la sensibilité, mais diminue la résolution. |
Meilleures pratiques pour l’utilisation de caméras pour microscopes
Bien que les paramètres d’acquisition d’images idéaux varient en fonction de l’application et de l’échantillon, il y a deux paramètres importants à prendre en considération, soit l’intensité de la lumière d’excitation et le temps d’exposition. Un temps d’exposition plus long ou une lumière d’excitation plus forte permettent une fluorescence plus élevée, menant à un rapport signal sur bruit supérieur. La phototoxicité est toutefois augmentée dans ces cas. Cela nous amène à une question importante : comment peut-on optimiser les paramètres d’acquisition d’images pour des expériences d’imagerie prolongées sur des cellules vivantes tout en réduisant l’effet toxique de la lumière d’excitation sur les cellules?
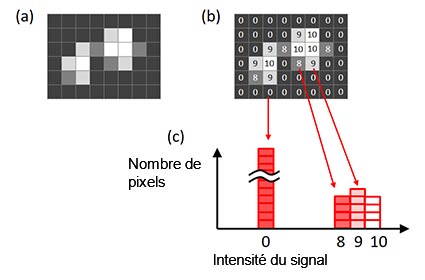
Pour déterminer le temps d’exposition idéal, utilisez un histogramme d’image. L’axe X de l’histogramme représente l’intensité du signal. La hauteur de l’histogramme pour chaque valeur X (intensité du signal) montre le nombre de pixels associés à cette valeur (figure 6).
Figure 6 – Histogramme d’une image. (a) Image d’origine, (b) intensité du signal pour chaque pixel affiché dans l’image d’origine, |
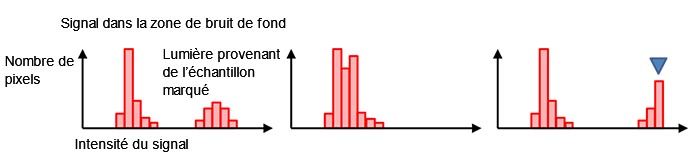
Habituellement, la valeur de signal numérique des pixels avec un arrière-plan noir n’est pas égale à zéro, même s’il n’y a pas de lumière de fond (figure 7, à gauche). Cela contribue à éviter les signaux de valeur négative causés par les fluctuations du bruit de mesure mentionnées à la figure 4 (d). La forme et la distribution de l’histogramme nous indiquent si le temps d’exposition utilisé est approprié. Si l’histogramme est trop regroupé sur une plage d’intensités de signal faible, cela signifie que le temps d’exposition est trop court (figure 7, au centre). S’il y a une baisse abrupte après le maximum d’intensité du signal, cela signifie que la valeur de signal est saturée (figure 7, à droite). Dans ce cas, vous pouvez réduire l’intensité d’excitation ou raccourcir le temps d’exposition.
Figure 7 – Un histogramme créé avec une image normalement exposée (à gauche), sous-exposée (au centre), |
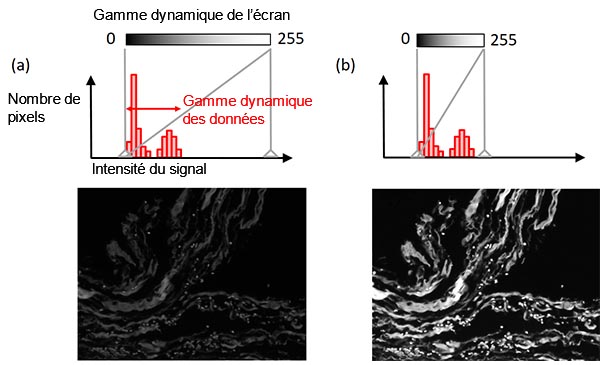
Certains logiciels d’acquisition d’images ont une fonction de réglage automatique de l’affichage qui procure une meilleure visibilité tout en conservant les données de l’image d’origine. Dans la plupart des cas, la gamme dynamique d’une caméra monochrome (p. ex. 16 bits = 65 536 niveaux) est plus grande que la gamme dynamique d’un écran, qui est habituellement de 8 bits (256 niveaux).
La fonction de réglage de l’affichage définit le lien entre l’intensité du signal et la luminosité de l’affichage. Habituellement, l’intensité du signal le plus lumineux de votre échantillon est beaucoup plus faible que l’intensité maximale que la caméra peut capter. Dans ce cas, la mise en correspondance de la gamme dynamique de l’écran avec la gamme dynamique des données (la plage entre le niveau de bruit de fond et le signal le plus intense) permet une meilleure visualisation tout en gardant les données de l’image d’origine (figure 8). Un histogramme aide à illustrer cet réglage.
Figure 8 – Réglage de l’affichage : (en haut) histogramme montrant un indicateur de réglage de l’affichage sous forme de ligne verticale pleine, (au centre) illustration du lien entre la luminosité de l’affichage et l’intensité du signal, (en bas) image utilisée comme exemple. Image de gauche : réglage initial de l’affichage. Image de droite : réglage modifié de l’affichage (sans modification des données de l’image d’origine). |
Six étapes à suivre pour régler les paramètres d’acquisition d’une caméra pour microscope
En bref, voici six étapes générales à suivre pour configurer adéquatement une caméra pour microscope en vue d’une expérience. Veuillez noter que la meilleure procédure dépend de votre application et de vos échantillons.
- Déterminez le grossissement à utiliser pour l’observation.
- Réglez la mise au point sur votre échantillon, et trouvez la cible de votre observation. Envisagez d’utiliser un gain plus élevé ou le mode de regroupement des pixels sur la caméra pour raccourcir le processus et réduire au minimum la phototoxicité. Nous vous recommandons également d’utiliser un réglage d’affichage automatique ou manuel pour trouver les meilleures conditions d’observation du signal et de fermer l’obturateur de lumière d’excitation dès que vous arrêtez d’observer l’image.
- Réglez à nouveau le gain et le mode de regroupement des pixels pour l’acquisition d’images.
- Essayez la plus faible intensité de lumière d’excitation, et voyez si vous pouvez observer le signal dans un temps d’exposition raisonnable. Si vous ne pouvez pas détecter le signal, ou si le rapport signal sur bruit est trop faible, essayez un temps d’exposition plus long.
- Si le temps d’exposition est exagérément long ou plus long que le temps d’exposition maximum possible pour la vitesse d’acquisition d’images, essayez une intensité d’excitation plus élevée en l’augmentant progressivement.
- Vérifiez l’histogramme pour vous assurer qu’il n’y a pas de saturation.
Conclusion
Bien que de nombreux facteurs complexes contribuent à la qualité des images et des données de microscopie, la connaissance de ces astuces et notions de base en matière d’imagerie numérique peut vous aider à déterminer le meilleur réglage d’acquisition à utiliser pour chaque expérience. La maximisation du signal, la réduction au minimum du bruit de fond et l’optimisation de l’état de l’échantillon sont des éléments essentiels améliorant la qualité des données pour toute application et expérience.
Auteur
 |
Takeo Ogama
Division des solutions scientifiques OLYMPUS CORPORATION OF THE AMERICAS |
Sorry, this page is not
available in your country.