使用 CM20 培养检测系统比较人源 iPS 细胞系,第 3 部分:降低 iPS 细胞系间肝脏类器官分化效率的差异性
简介
类器官是由人类诱导性多能干细胞 (iPS) 在体外培养形成的三维组织。虽然来自不同患者的类器官可用于功能和个体差异的研究,但 iPS 不同细胞系之间的差异限制了其应用。本研究的目的是采用 CM20 细胞培养监测系统去发掘形态学方面的特征,以定义类器官形成效率的供体和克隆依赖性。
分析由CM20 细胞培养监测系统采集的各个人源 iPS 细胞系增殖的数据
在我们的初步研究中,将来自不同人类个体的 12 个 iPS 细胞系保持未分化的状态,并用奥林巴斯 CM20 系统进行监测。通过长期的量化的细胞状态监测,我们发现,不同的 iPS 细胞系在生长过程以及代际之间生长速度的不稳定性等方面存在差异。
在接下来的研究中,我们让 12 种人源 iPS 细胞系分化为肝类器官,并研究这些 iPS 细胞系在类器官形成和分化效率上是否存在差异。我们发现,在未分化状态培养期间,后续分化为类器官的效率,在很大程度上受未分化状态培养期间早期增殖阶段差异的影响,但 iPS 细胞系间倍增时间的差异,让我们无法判断所形成肝脏类器官质量的好坏。
为了进一步深入了解以改进肝脏类器官的分化方法,我们使用了在本研究的第一阶段,用CM20细胞培养监测系统采集的未分化培养期间的细胞生长数据。我们重点研究了两个分化为肝脏类器官效率较低的特定 iPS 细胞系,以探索其与其他细胞系存在分化差异的原因。我们研究能否通过改变 iPS 细胞未分化状态时的培养条件来提高抗分化 iPS 细胞系的分化效率。
结果
在接受测试的 12 个 iPS 细胞系中,我们发现细胞系 I 和 J 对于分化为肝脏细胞系有抗性。为了更好地理解其原因,我们使用早期CM20 细胞培养监控系统在 iPS 细胞未分化培养阶段采集的一系列图像,并将细胞系 I 和 J 的行为与可有效分化为肝脏细胞系的其他 iPS 细胞系相比较,以期了解其在行为方面的差异。
值得注意的是,在能够分化的 iPS 细胞系(例如细胞系 L)中,大多数单细胞在增殖早期传代后粘附形成集落。另一方面,我们观察到在细胞系 I 和 J 中粘附后出现更高的细胞死亡率,导致集落形成效率显著降低(图 1)。这一趋势可在多次传代时重复观察到。根据这些观察结果,我们假设在 iPS 未分化培养的早期阶段,抗分化 iPS 细胞系的细胞死亡率较高,导致 iPS 细胞集落数量较少,最终导致其较低的肝脏类器官分化效率。
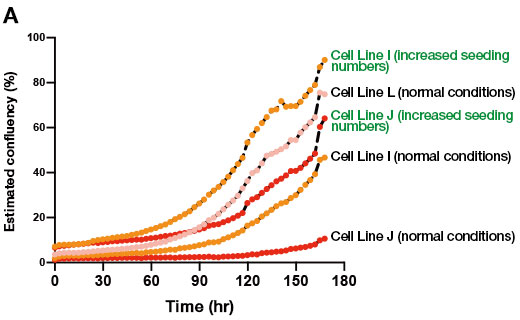
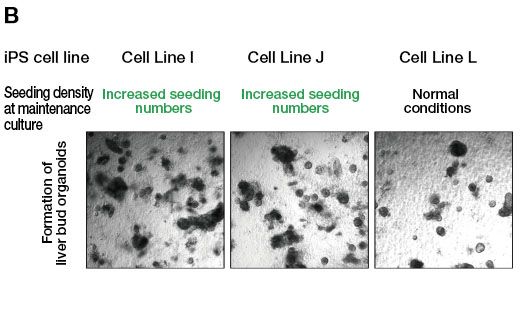
为了检验这一假设,我们在传代时增加了种植细胞的数量,使得最终的集落数量与可分化 iPS 细胞系相当。然后,我们尝试从此次培养中诱导分化出肝脏类器官。结果表明,与标准方案相比,将传代时种植细胞的数量增加约 5-10 倍后,未分化状态培养阶段中抗分化 iPS 细胞系形成的集落数量有所增加(图 2A)。此外,在以上条件下从细胞系 I 和 J 生成肝脏类器官时,能获得足够数量的类器官,而在之前的条件下,仅形成了少量类器官(图 2B)。我们也发现,这些肝脏类器官表达了多个肝细胞标志物。以上这些结果充分说明,在改善抗分化 iPS 细胞系的初始未分化状态培养阶段及随后到肝脏类器官的分化阶段,CM20 细胞培养监测数据具有较强的实用性。
细胞系 I | 细胞系 J | 细胞系 L |
图 1.未分化状态培养阶段早期人源 iPS 细胞系的行为
|
图 2.iPS 细胞系的未分化状态培养中种植细胞密度对类器官形成的影响。
(A) 正常未分化状态培养条件下以及增加种植细胞数后 3 个人源 iPS 细胞系生长过程的 CM20 监测结果。
(B) 抗分化细胞系 I 和 J 在增加种植细胞数的未分化状态培养条件下诱导分化后的类器官形成。为了进行比较,也显示了细胞系 L(可分化 iPS 细胞系)在正常未分化状态培养条件下诱导分化后形成的类器官。
结论
类器官研究者通常将大部分精力放在优化 iPS 细胞系的类器官分化方案上。在比较多个 iPS 细胞系形成的类器官时,大多数研究者很少注意它们的未分化状态培养阶段。本研究的结果表明,未分化状态培养过程中 iPS 细胞系的初始增殖状态对随后的分化诱导效率有着极大的影响。因此,在为类器官分化阶段开发更优方案之外,优化单个 iPS 细胞系的未分化状态培养阶段的方案对于可重复地生成多份类器官样本来说至关重要。使用能够存储和定量分析纵向时间序列培养数据的 CM20 细胞培养监测系统后,我们就能够获得新的发现,从而进一步改进试验方案。
Takebe 和 Yoneyama 博士的评语
Takanori Takebe 博士(左) | CM20 监测系统有一个很有用的功能,那就是我们可以立即将刚采集的类器官结果与过去采集的类器官图像数据进行比对,从而评估 iPS 细胞的状态。能够了解 iPS 细胞在培养期间的状态,并确定提高分化效率的关键因素,对于我们的实验室来说是一项巨大的优势。 |
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。