Evaluación de la eficacia de medicamentos en esferoides tumorales 3D usando un flujo de trabajo que parte del procesamiento de imágenes
En la evaluación de medicamentos que requiere organismos individuales como los animales experimentales y los humanos, los valores de medición se ven afectados por diversos factores como la edad o el entorno de crecimiento; estos dificultan el análisis estadístico de datos provenientes de diversas muestras.
Los modelos de cultivo celular 3D, como los orgánulos y los esferoides, pueden simular la estructura in vivo y el funcionamiento de un órgano o un tejido, además de facilitar su cultivo in vitro en grandes cantidades. Por tanto, son altamente reproducibles para los análisis de datos estadísticos. Dado que los modelos de cultivo celular 3D pueden replicar la heterogeneidad celular observada en los tumores, el procesamiento de imágenes de los ensayos con células 3D resulta muy útil para llevar adelante las evaluaciones de fármacos/medicamentos.
El flujo de trabajo para evaluar la eficacia de los medicamentos usando ensayos basados en células 3D puede dividirse en los siguientes tres procesos (Figura 1):
- Preparar, cultivar y tratar el modelo del cultivo celular 3D
- Adquirir imágenes de las células
- Realizar los análisis estadísticos
Esta nota de aplicación, se presenta un flujo de trabajo basado en el procesamiento de imágenes para cada proceso. Para demostrar el flujo de trabajo paso a paso, se ha usado un ensayo que permite evaluar cuantitativamente los daños inducidos por los compuestos en los esferoides tumorales 3D a nivel celular.
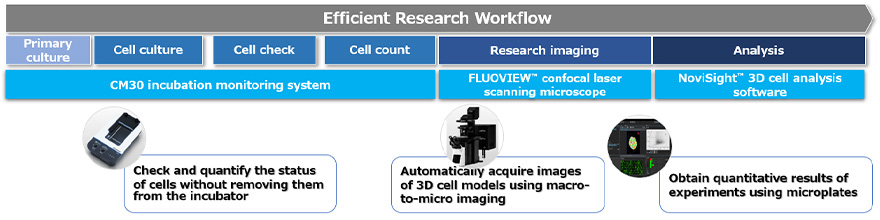
Figura 1. Flujo de trabajo a partir del procesamiento de imágenes para modelos de cultivo celular 3D usando las tecnologías de Evident.
1. Preparación de los esferoides tumorales 3D (pre-cultivo)
Los esferoides tumorales pueden simular el microentorno celular que se observa en muchos tumores in vivo, por lo tanto suelen ser usados en ensayos de cribado de fármacos/medicamentos anticancerosos. Por lo general, se forman a partir de cultivos de células cancerígenas colocados en recipientes hemisféricos de baja adherencia.
Para evaluar la eficacia del medicamento, hemos preparado esferoides tumorales de 600 µm o más. Para este proceso, hemos usado el sistema de monitorización de incubación CM30. Este dispositivo permite monitorizar las células a largo plazo y hacer un seguimiento del estado de los cultivos celulares sin sacarlos de la incubadora.
Para preparar los esferoides tumorales, se cultivaron células MCF-7 derivadas de cáncer de mama en recipientes de 96 pocillos en forma de U y de baja adherencia con una densidad de 2000 células/pocillo. Inmediatamente después del reparto, se colocó la microplaca en el sistema CM30 y ubicó el sistema en una incubadora de CO2. La utilización del sistema CM30 nos permitió monitorizar la formación de las células MCF-7 que forman esferoides y su
aumento de tamaño con el paso del tiempo (Figura 2).
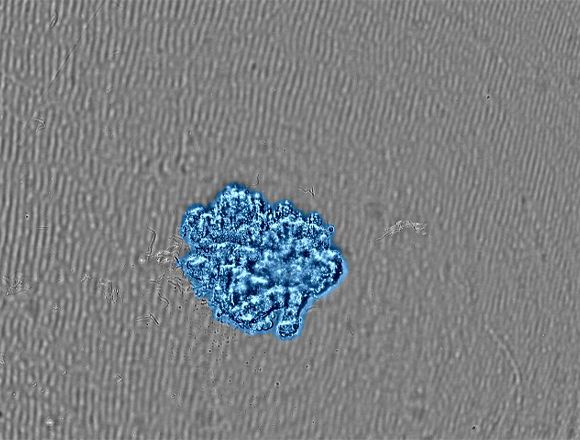
Videos asociadosFigura 2. (a) Imágenes de la formación de esferoides en intervalos de tiempo. |
(b) Imagen del esferoide cultivado en el tamaño diana. Una máscara de confluencia muestra las células detectadas de color azul. |
El sistema CM30 reconoció automáticamente el área del esferoide al aplicar la función de medición de confluencia. Con la función de medición de confluencia, la confluencia es calculada como una relación del área ocupada por las células en función del área de toda la imagen. La Figura 3 muestra los cambios en el área del esferoide MCF-7 a lo largo de siete días.
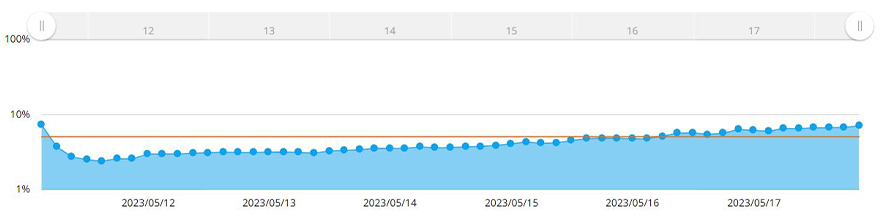
Figura 3. Gráfico que ilustra los cambios de tamaño de los esferoides durante siete días. La línea amarilla es el objetivo de confluencia configurado en el sistema.
Cuando la confluencia alcanzaba el 5 % del área de la imagen adquirida, el software medía el área del esferoide. Aquí, se determinó que el diámetro del esferoide supera los 600 µm cuando la confluencia alcanza el 5 %. El sistema CM30 permitió definir una confluencia diana del 5 % en el software. Se definió una alarma para informar si las células alcanzaban o superaban esa confluencia.
Para confirmar el correcto funcionamiento de la alarma, se medió el tamaño del esferoide a partir de 12 pocillos un día después de la definición de la alarma y se confirmó la obtención de esferoides tumorales con un diámetro de 600 µm o más en todos los pocillos (Figura 4).
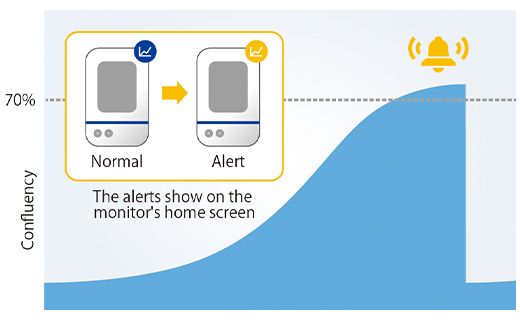 | 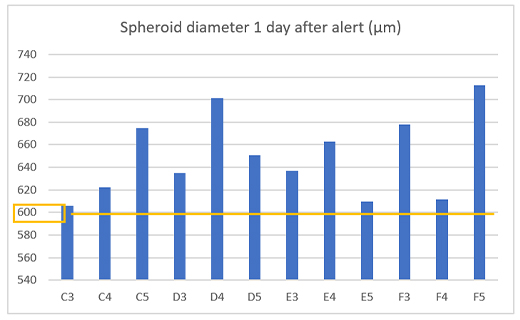 |
Figura 4. Tamaño del esferoide preparado un día después de la alarma.
(a) Ejemplo de una alarma en el sistema CM30 (b) Diámetro de los esferoides preparados (n= 12).
Preparar los esferoides usando el sistema CM30 permitió monitorizar el estado de crecimiento sin tener que sacar ni meter el recipiente de la incubadora y sin requerir la intervención del investigador. Además, el software de análisis pudo cuantificar el tamaño del esferoide y emitir la alarma cuando se alcanzaba el tamaño diana del esferoide. Al tener implementado el sistema CM30 en su flujo de trabajo, los investigadores tienen la libertar de completar otras tareas en el tiempo que antes dedicaban a monitorizar el cultivo celular.
Los esferoides tumorales que superaban un tamaño específico eran tratados con uno de los tres medicamentos anticancerosos (Cisplatino, Paclitaxel o 5-FU) en distintas dosis o control. Se agregó Hoechst 33342, yoduro de propidio (PI) y calceína AM a todos los pocillos 24 horas más tarde. Los colorantes Hoechst 33342, yoduro de propidio (PI) y calceína AM pueden teñir los núcleos de todas las células, los núcleos de las células muertas y las
células viables en los esferoides, respectivamente. Después de la tinción, se adquirieron los datos de imagen de los esferoides tumorales usando la microscopía de escaneo láser.
2. Adquisición de imagen de las células en los esferoides tumorales 3D
Se usó el microscopio confocal de escaneo láser FLUOVIEW™ FV3000 para adquirir imágenes en alta resolución de los esferoides tumorales más gruesos a nivel de cada célula. El módulo de procesamiento de imágenes de macro a micro del microscopio FV3000 permitió adquirir imágenes sin tener que buscar la muestra.
La Figura 5 muestra un diagrama esquemático del proceso automático de adquisición de imágenes usando el módulo de procesamiento de imágenes de macro a micro. Los esferoides tumorales flotan en posiciones inconsistentes dentro del pocillo en forma de U. Para solucionar este problema, el módulo de procesamiento de imágenes de macro a micro registra la posición del esferoide de interés procesando todo el pocillo con una magnificación baja (macroimagen). Posteriormente, el módulo puede adquirir de forma automática y exclusiva la región del esferoide en alta magnificación (microimagen). Este proceso reduce el tamaño de archivo de la imagen adquirida. Además, permite reducir la carga en la memoria del sistema.
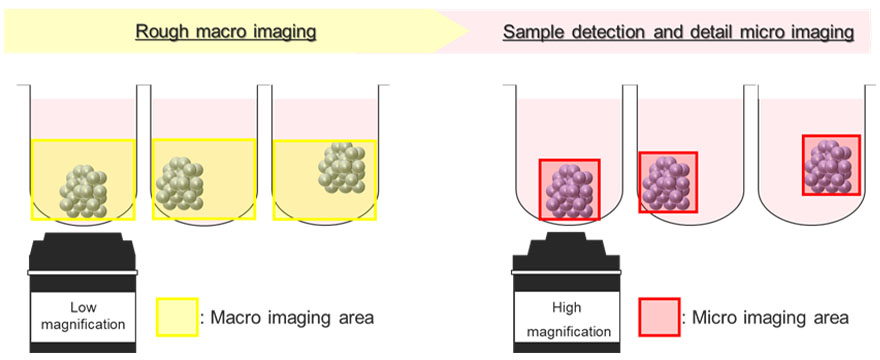
Figura 5. Diagrama esquemático del módulo de procesamiento de imágenes de macro a micro en el microscopio confocal de escaneo láser FV3000.
El microscopio adquirió de forma consecutiva imágenes de sección Z de los esferoides tumorales a partir de 60 pocillos.
Tal y como puede verse en la Figura 6, se adquirió una imagen de alta resolución a partir de cada célula del esferoide tumoral. En el grupo tratado con Cisplatino pudo observarse un gran número de células positivas a PI en relación con el control y los dos otros medicamentos anticancerosos, lo que sugiere que este medicamento provocó la muerte de estas células.

Figura 6. Las imágenes para determinar la vida y la muerte celular son capturadas automáticamente por el módulo de procesamiento de imágenes de macro a micro.
3. Análisis estadístico de las células en los esferoides tumorales 3D
Para determinar la viabilidad de cada célula en el esferoide, se analizaron las imágenes de sección Z continuas obtenidas a partir de los diversos pocillos usando el software de análisis celular 3D NoviSight™. Las señales de fluorescencia, derivadas de la tinción Hoechst 33342, fueron usadas para reconocer todos los núcleos celulares. Por medio del proceso de puerta de fase basado en el diagrama de dispersión, las células pudieron ser definidas como células muertas debido a la baja intensidad de la señal de fluorescencia derivada de la calceína AM y la alta intensidad de la señal derivada del yoduro de propidio. En cambio, las células con un alto contenido de calceína AM y un bajo contenido de PI se definieron como células viables (Figura 7). Posteriormente, se pudo verificar la validez de nuestra clasificación usando la función de galería (Gallery). Con ello se demostró que, al usar el software NoviSight, fue posible clasificar un gran número de células reconocidas automáticamente en función de la intensidad de la señal fluorescente.
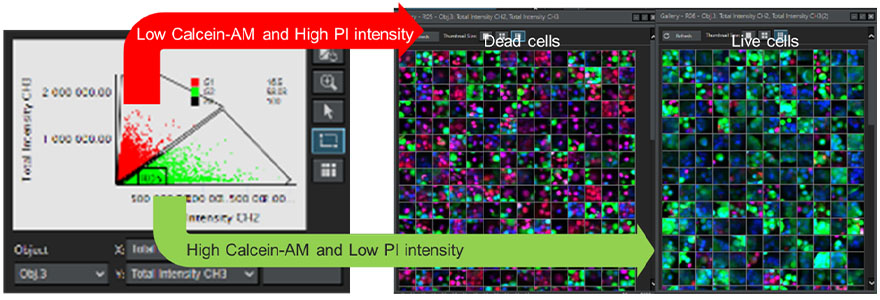
Figura 7. Determinación de la viabilidad de todas las células usando el software NoviSight. Izquierda: Gráfico de la intensidad de la señal de fluorescencia del canal de calceína AM y el canal PI a partir de cada célula. Derecha: Imágenes de la galería para células vivas y muertas.
Tal y como puede verse en la Figura 8, se calculó el porcentaje de células viables en los esferoides tratados con medicamentos anticancerosos. Al añadir el Paclitaxel y 5-FU en distintas concentraciones, se pudieron observar células viables sin cambios significativos en la relación. Sin embargo, se confirmó una reducción en la relación de células viables a medida que la concentración añadida del Cisplatino aumentaba. El software NoviSight facilita el análisis basado en el procesamiento de imágenes a partir de ensayos celulares con modelos de cultivo celular 3D; esto con el fin de evaluar simultáneamente la eficacia de múltiples medicamentos candidatos.
Consideraciones dedicadas a evaluar los efectos de los medicamentos anticancerosos en esferoides tumorales
A través de este estudio, se confirmó que las soluciones basadas en el procesamiento de imágenes pueden facilitar cada etapa del proceso dedicado a entender los efectos de los fármacos/medicamentos anticancerosos en los esferoides tumorales a nivel celular.
Los esferoides tumorales son preparados siguiendo un proceso de cultivo celular muy laborioso. Para confirmar cuantitativamente los efectos de los medicamentos anticancerosos, los esferoides deben presentar condiciones homogéneas (p. ej., el tamaño del esferoide en este estudio). Gracias a las funciones de monitorización remota del sistema CM30, fue posible comprobar cómo proliferaban las células hasta que el esferoide alcanzaba un tamaño predeterminado, sin tener que sacar el cultivo de la incubadora. Además, la función de alarma del sistema CM30 permitió definir con precisión los plazos del tratamiento con los medicamentos anticancerosos.
La microscopía confocal de escaneo láser es una opción adecuada para observar la respuesta de los esferoides tumorales a los medicamentos contra el cáncer (oncológicos) a nivel celular. Se piensa que los esferoides tumorales cultivados en los pocillos en forma de U existen cerca del centro de la pared. En realidad, suelen estar situados ligeramente fuera del centro. Al procesar en imagen todo el pocillo con el fin de capturar el área de los esferoides tumorales se requiere una gran cantidad de datos de almacenamiento y mucho tiempo. El módulo de procesamiento de imágenes de macro a micro del microscopio FV3000 simplifica dicho proceso. El módulo adquiere una imagen en baja magnificación (macroimagen) de todo el pocillo y determina automáticamente la óptima posición para el procesamiento de imágenes en alta magnificación (microimagen). Al procesar exclusivamente la muestra (esferoides de cáncer) en imagen a alta magnificación, el módulo reduce el tamaño de archivo de la imagen y el tiempo dedicado al procesamiento de imágenes.
Las imágenes adquiridas con el microscopio FV3000 pueden analizarse fácilmente gracias al software de análisis celular 3D NoviSight. El procesamiento estadístico de las señales de viabilidad a nivel celular demostró que la incorporación del Cisplatino aumentaba el número de células muertas en función de la dosis. El software NoviSight puede ser usado con parámetros analíticos, como la intensidad de señal y la información de posición de la célula, para llevar a cabo análisis avanzados. Analizar el comportamiento de cada célula heterogénea en un esferoide 3D, viabiliza la evaluación del fármaco/medicamento en un entorno que simula de forma cercana el entorno celular in vivo.
Este flujo de trabajo emplea tecnologías de Evident que automatizan, acortan y ahorran tiempo y esfuerzos en procesos difíciles o complicados para los usuarios que analizan modelos de cultivos celulares 3D. La combinación de estas soluciones proporciona un flujo de trabajo de investigación más agilizado de principio a fin.
Más información sobre el procesamiento de imágenes confocal y el análisis de imágenes.
Referencias
1)Elena M. Tosca et al., Replacement, Reduction, and Refinement of Animal Experiments in Anticancer Drug Development: The Contribution of 3D In Vitro Cancer Models in the Drug Efficacy Assessment. Revista Biomedicines 2023, 11, 1058.
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.