Optimisation de l’acquisition des images en vue d’une analyse 3D à haut débit de sphéroïdes tumoraux
Résumé
Dans cette note d’application, nous décrivons comment nous avons optimisé les conditions d’acquisition des images d’un microscope confocal de sorte à réaliser de l’imagerie à haut débit avec la qualité requise pour l’analyse 3D de sphéroïdes tumoraux. L’évaluation à haut débit de l’efficacité des médicaments a été réalisée à l’aide d’une plaque de microtissus 3D InSight™ de la technologie InSphero.
・Processus d’évaluation d’un médicament
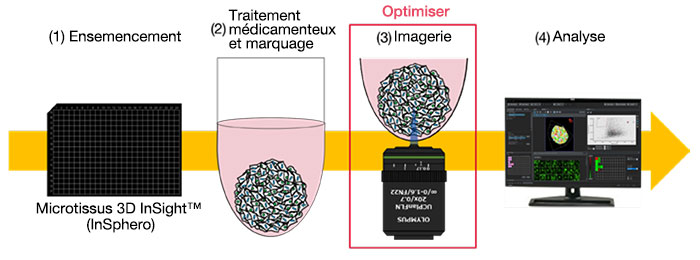
・Optimisation des conditions d’imagerie
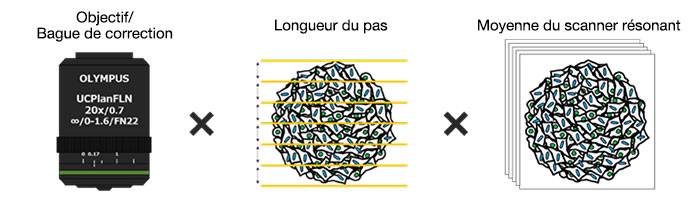
Avantages
- Optimisation des conditions d’acquisition des images du microscope FV3000RS pour réaliser de l’imagerie à haut débit avec la qualité requise pour l’analyse 3D NoviSight™.
- Le logiciel NoviSight permet d’analyser des objets à partir d’images de faible qualité, car il utilise les informations du signal de l’objet identifié en se basant sur le signal du noyau dont le rapport signal sur bruit est élevé.
Introduction
L’évaluation de l’efficacité des médicaments sur des sphéroïdes tumoraux tridimensionnels est d’une grande importance, car ceux-ci ont la capacité de restituer in vitro le microenvironnement complexe des tumeurs cancéreuses in vivo. Les sphéroïdes permettent donc aux chercheurs d’évaluer l’efficacité d’un médicament dans des conditions les plus proches possible de celles de l’environnement naturel d’une tumeur.
Néanmoins, l’acquisition de coupes optiques d’un grand nombre d’échantillons peut s’avérer extrêmement chronophage. Pour accélérer ce processus, nous avons optimisé les conditions d’acquisition des images du microscope confocal FLUOVIEW™ FV3000RS afin d’âtre en mesure de réaliser de l’imagerie à haut débit avec la qualité requise pour l’analyse 3D NoviSight™.
Grâce à l’optimisation des conditions d’acquisition, notamment le réglage la bague de correction de l’objectif, la longueur du pas entre les plans Z et les durées moyennes, nous avons capturer des coupes optiques de 252 échantillons de microtissus 3D InSight™ dans une microplaque à 384 puits Akura™ (InSphero) en 56 minutes et 23 secondes. Le logiciel NoviSight nous a permis d’analyser de manière précise les nombreuses
images d’échantillons acquises en haut débit avec le microscope confocal FV3000RS
Méthodes
Préparation des échantillons
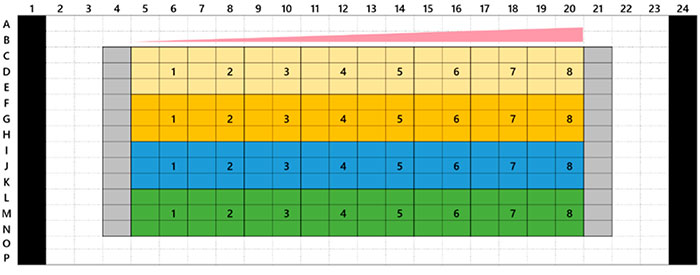
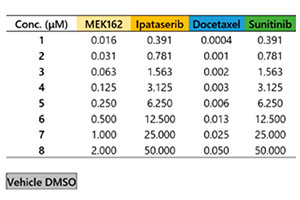
Les microtissus tumoraux 3D InSight™ placés dans une microplaque à 384 puits Akura™ ont été fournis par InSphero. Des cellules de la lignée HCT-116 (carcinome colorectal humain) exprimant la protéine fluorescente verte ont été agrégées avec des fibroblastes NIH3T3-RFP. Pour chaque composé de référence, un traitement de 7 jours (avec une première application au jour 0 et une seconde au jour 4) a été réalisé. Le plan de la microplaque ainsi que la liste des composés testés sont présentés à la figure 1. Une fois le traitement médicamenteux terminé, nous avons rincé les échantillons trois fois dans un tampon phosphate salin 1x (PBS) et les avons fixés à 4 °C (39,2 °F) au paraformaldéhyde à 4 % pendant une nuit. Ensuite, nous avons rincé les échantillons avec du PBS 1x, les avons marqués avec 1 µM de TO-PRO-3 (Thermo Fisher Scientific) dans une solution renfermant 0,1 % de TritonX-100 et les avons incubés à 37 °C (98,6 °F) avec le réactif de clarification SCALEVIEW-S4 pendant une nuit.
|
|
Fig. 1 Plan de la microplaque et liste des composés testés
Imagerie et analyse
Pour éviter que toute interférence entre la RFP et le TO-PRO-3 au cours de cette expérience, les images ont été acquises en mode séquence (qui est deux fois plus long).
Lors de l’analyse, les signaux fluorescents de toutes les cellules (TO-PRO-3) nous ont permis d’identifier les noyaux. Grâce aux signaux des protéines fluorescentes rouge (RFP) et verte (GFP), toutes les cellules ont été classées en deux catégories : cellule HCT-116 ou cellule NJH3T3.
Résultats
Optimisation du réglage de la bague de correction de l’objectif
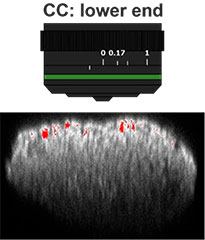
Dans un premier temps, nous avons optimisé le réglage de la bague de correction de l’objectif a afin d’obtenir des images en 3D avec une excellente résolution et un contraste élevé. Nous avons utilisé un objectif UCPLFLN20X avec une grande distance de travail et une grande ouverture numérique (ON) pour l’imagerie. La position de la bague de correction assurant le meilleur contraste a été recherchée en faisant tourner la bague petit à petit en commençant par la position minimale. Nous avons ainsi déterminé que le réglage optimal de la bague de correction est lorsqu’elle est positionnée sur 0,17 (fig. 2). Nous avons donc décidé d’utiliser un objectif UCPLFLN20X avec la bague de correction réglée sur 0,17 pour observer la microplaque à 384 puits Akura™.
|
|
|
|
Fig. 2 Optimisation du réglage de la bague de correction de l’objectif (échelle = 100 μm)
Optimisation de la longueur du pas de déplacement sur l’axe Z
Ensuite, nous avons examiné l’effet de la longueur du pas de déplacement sur l’axe Z sur l’identification et l’analyse des objets à l’aide du logiciel NoviSight™. Les résultats indiquent que la précision de l’identification décroît de manière proportionnelle à la longueur du pas de déplacement (fig. 3). La longueur minimale du pas de déplacement (1,28 µm), qui est égale à la moitié de la résolution, a été utilisée comme longueur de référence. Une fois la classification réalisée, aucune différence entre les nombres de cellules obtenus avec la longueur minimale du pas (1,28 µm) et une longueur de 3 µm (test de Student) n’a été observée. La taille d’un noyau étant d’environ 10 µm, l’utilisation de ce pas 3 µm permet de prendre environ trois images de chaque noyau.
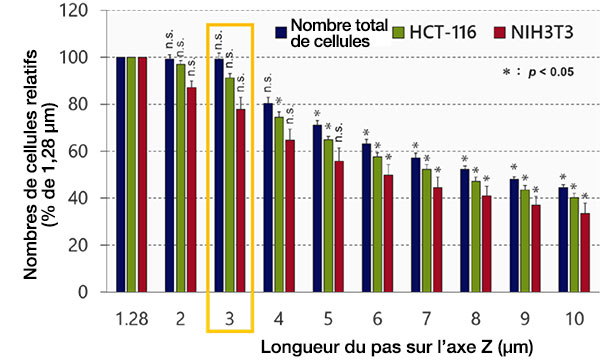
Fig. 3 Optimisation de la longueur du pas de déplacement
Optimisation des temps moyens (mode scanner résonant)
La qualité d’image du scanner résonant du microscope FV3000RS dépend du temps moyen. Nous avons optimisé les temps moyens afin d’obtenir la qualité d’image requise pour l’analyse avec le logiciel NoviSight. Le logiciel NoviSight utilise le signal fluorescent pour identifier l’objet pour l’analyse. Il n’est donc pas nécessaire d’utiliser une image à haute résolution. Lors de cette expérience, les noyaux ayant un rapport signal sur bruit élevé sont utilisés pour l’identification des objets, de sorte qu’il est seulement nécessaire d’obtenir les informations relatives à l’intensité sur les autres canaux (GFP/RFP). Lorsque nous avons comparé la précision de l’identification du scanner galvanométrique avec l’image moyenne du scanner résonant, la précision de l’identification était quasiment identique à celle du témoin, et ce, même lorsque la moyenne n’était pas réalisée (test de Student) (fig. 4). Lors de cette expérience, nous avons prouvé que, sans moyenne, la qualité d’image était suffisante pour réaliser l’analyse NoviSight.
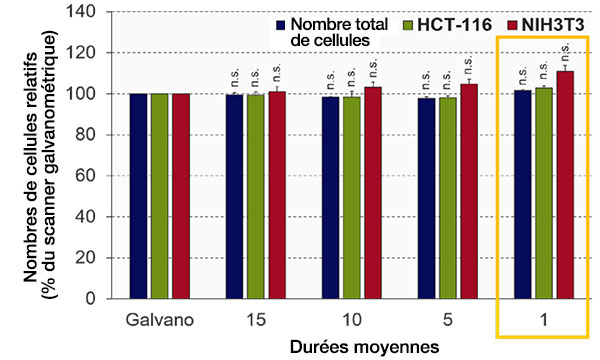
Fig. 4 Optimisation des temps moyens
Imagerie dans des conditions optimales
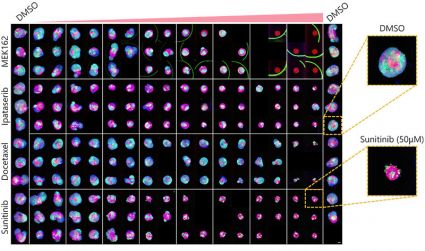
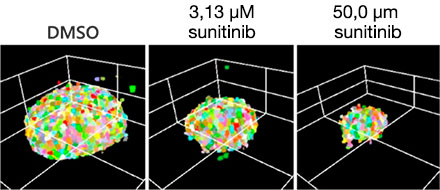
L’optimisation des conditions susmentionnées (fig. 5A) nous a permis d’acquérir les images de 252 échantillons de microtissus 3D InSight™ à partir de la microplaque à 384 puits Akura™ (InSphero) en 56 min et 23 s (fig. 5B). Les résultats indiquent que chaque médicament inhibe, de manière plus ou moins importante en fonction de la dose appliquée, la croissance des sphéroïdes. En outre, l’application de fortes concentrations de sunitinib, un traitement moléculaire ciblé capable d’inhiber le facteur de croissance de l’endothélium vasculaire (VEGF), a permis de réduire de manière significative l’intensité de la protéine fluorescente verte (GFP), ce qui indique que ce traitement n’agit que sur les cellules cancéreuses (HCT-116 exprimant la GFP).
(A)
| (B) Fig. 5 Conditions optimales et résultats d’imagerie (échelle = 100 μm) |
Analyse
Une fois les cellules détectées (fig. 6A), il est facile de vérifier le nombre total de cellules contenues dans chaque sphéroïde à l’aide de la carte de densité du logiciel NoviSight™ (fig. 6B). Une fois la classification effectuée, les pourcentages des nombres de cellules relatifs ont été calculés et représentés graphiquement (fig. 6C). Les résultats de l’analyse montrent que le sunitinib inhibe la croissance des cellules cancéreuses (HCT-116, IC50 = 1,46 μM). Grâce à l’optimisation des conditions d’acquisition des images du système FV3000RS, il a été possible de réaliser une évaluation 3D d’un médicament à l’aide de l’imagerie à grande vitesse.
(A)
| (B)
|
(C)
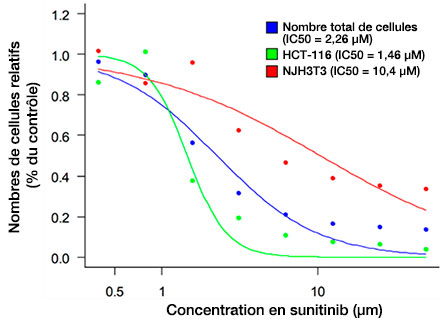
Fig. 6 Three-dimensional efficacy drug evaluation
Conclusion
Des images de 252 échantillons de microtissus 3D InSight™ dans une microplaque à 384 puits Akura™ (InSphero) ont été acquises à l’aide d’un microscope confocal FV3000RS utilisé dans des conditions optimales pour réaliser une imagerie à haut débit. Cette étude montre que l’imagerie peut être effectuée en moins d’une heure et que les images générées peuvent être analysées avec
le logiciel d’analyse 3D NoviSight. L’ajustement de la combinaison de fluorophores et de la taille des échantillons permettra peut-être de réduire encore un peu plus la durée du processus.
Auteur
Hiroya Ishihara, Biological Evaluation Technology 2, Research and Development
Takashi Sugiyama, Biological Evaluation Technology 2, Research and Development
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.