超高開口数対物レンズを用いた生細胞における1分子蛍光イメージング
1分子蛍光イメージング法を用いた生細胞膜上における相互作用解析
細胞調整法や顕微鏡光学系の手法・技術の進歩に伴い、現在では生きた細胞で生体分子1個を1分子レベルで蛍光イメージングすることが可能になりました。例えば、生理活性物質リガンドが細胞へ結合する様子や情報伝達分子の二量体化、複合体形成の相互作用を生細胞において1分子レベルで定量的に解析した事例などが論文等で報告されています。ここでは生理学研究所 神経機能素子研究部門 中條 浩一博士(現: 大阪医科大学 医学部 生命科学講座 生理学教室 准教授)らがオリンパスの“超高開口数対物レンズ”を用いて細胞膜上のイオンチャネルで起こるサブユニットとの相互作用を1分子レベルで解析した事例をご紹介します。
超高開口数対物レンズを用いた1分子蛍光イメージング アプリケーション
1分子蛍光イメージングによるサブユニットカウンティング
1)Kv4.2 - DPP10 チャネル複合体の1分子イメージングによる量体数比(ストイキオメトリー)の決定
中條 浩一博士らは、2015年7月に米国生化学誌「The Journal of Biological Chemistry」で特殊な1分子蛍光イメージング法を用いて細胞膜上のイオンチャネルで起こるサブユニットとの相互作用を解析した研究論文を報告しました。その特殊な1分子蛍光イメージング法とは、イオンチャネル(Kv4.2)の各サブユニットに蛍光タンパク質を融合させたものをアフリカツメガエルの卵母細胞に発現させ、全反射蛍光顕微鏡を用いて1分子レベルで細胞膜上イオンチャネル‐サブユニット相互作用を解析する手法ですFig1左図。この手法の特徴としては、蛍光標識された分子複合体へ励起レーザーを照射し続けることで蛍光褪色させ、その蛍光褪色していく過程の蛍光シグナル量の変化を計測します。1分子レベルの場合、蛍光分子の数に応じて段階的に蛍光褪色していくため、この階段状の褪色イベントを数えることで各サブユニットの分子数を決定することができます(Fig2 左)。
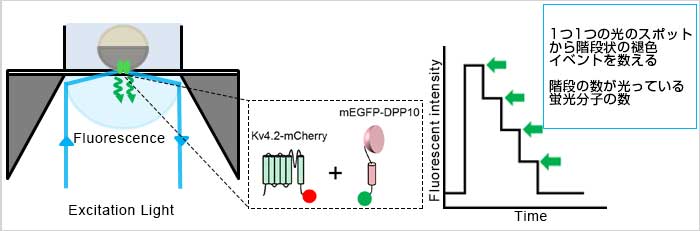
Fig1. 1分子蛍光イメージングによるサブユニットカウンティング概念図
中條博士らは、この手法を用いてアフリカツメガエル卵母細胞の細胞膜に発現させたイオンチャンネルKv4.2-mCherry(Fig2 左、赤)とユニットタンパク質mEGFP-DPP10(Fig2 中央、緑)の相互作用を1分子蛍光イメージングで画像取得をしました。そして得られた画像を解析することでmEGFPが4段階で褪色していることがわかり(Fig3 緑矢印)、このKv4.2イオンチャネル複合体中には、最大4分子のmEGFP-DPP10が結合していることを解明しました。
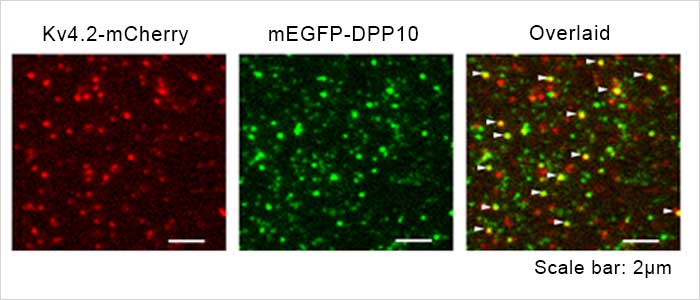
Fig2. Kv4.2 - DPP10 チャネル複合体の1分子蛍光イメージング画像
Kv4.2-mCherry(Fig2 左、赤)、mEGFP-DPP10(Fig2 中央、緑)の1分子蛍光画像とそれぞれを重ねた合わせた画像(Fig2 右)。重ね合わせ画像で二種類の蛍光分子が共局在しているスポットを白矢尻で示す。
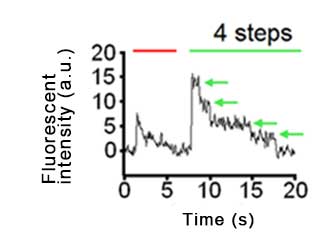 | |
| Kv4.2-mCherry-mEGFP-DPP10チャネル複合体の1分子蛍光イメージング動画 最初5秒間mCherryを励起し、その後mEGFPを励起している。 | Fig3. Kv4.2 - DPP10 チャネル複合体の量体数比の蛍光褪色ステップ数 Fig2右画像の二種類の蛍光分子が共局在(白矢印)している蛍光スポットから得られた蛍光強度変化のグラフ。最初5秒間mCherryを励起し(赤線)、その後mEGFPを励起している(緑線)。mEGFPが4段階で褪色しているため(Fig3 緑矢印)、このKv4.2イオンチャネル複合体中には、4分子のmEGFP-DPP10が結合していることがわかる。 |
全反射蛍光顕微鏡システム;
倒立型リサーチ顕微鏡: IXシリーズ
対物レンズ: 高開口数100倍対物レンズApo 100XOHR (100X, N.A.1.65)
励起: 488nm (Solid laser, Spectra-Physics) , 588nm (Solid laser, Coherent)
CCD カメラ: iXon3 EMCCD camera (Andor)
カバーガラス: High refractive index coverslip (n = 1.78)
画像、動画データのご提供;
北沢 和寛先生、久保 義弘先生、中條 浩一先生* 生理学研究所 神経機能素子研究部門
*現: 大阪医科大学 医学部 生命科学講座 生理学教室
2)超高開口数100倍対物レンズを用いた1分子蛍光イメージングによるサブユニットカウンティング
中條博士らが本手法を研究に導入したきっかけは、2007年に米国研究者Maximilian H Ulbrich博士、Ehud Y Isacoff博士らが米国科学誌「Nature Methods」で報告した論文(タイトル: “Subunit counting in membrane-bound proteins.”)を知ったことが始まりでした。その論文には、中條博士らが構築した1分子蛍光イメージングによるサブユニットカウンティングのベースとなる手法が報告されています。中條博士らは、それを参考に全反射蛍光顕微鏡システムを自作しましたが、そのシステム構築の中で重要なコンポーネントの1つだったのが、その論文中で “high refractive index coverslip and imaged with a high numerical aperture objective (Olympus 100x NA1.65)”と紹介されていたオリンパスの超高開口100倍対物レンズでした。オリンパスはその論文が2007年に発表される以前から、対物レンズ改良による微弱な蛍光シグナルの正確な定量化を目指し徹底的に開口数向上に取り組みました。そして世界に先駆けて開口数1.65を有した“超高開口数100倍対物レンズ”を開発してきました。開口数1.65を有した超高開口数100倍対物レンズを1分子蛍光イメージングに用いることで、ガラス面上でのバックグランドがこれまでよりも極端に抑えられ、非常に高いS/N比像取得を可能にしました。またその後も開口数をさらに向上させ、現在では開口数1.7を有した超高口数100倍対物レンズをラインナップしています。中條博士らはオリンパスの倒立顕微鏡IXシリーズに超高開口数対物レンズ取り付けた全反射蛍光顕微鏡を構築しました。そして1分子蛍光イメージングによるサブユニットカウンティングの実験を開始し、2010年に米国総合科学誌「PNAS」、2014年に米国生化学誌「The Journal of Biological Chemistry」、上述した2015年に「The Journal of Biological Chemistry」へ本手法を用いた研究論文を報告しました。
参照論文;
J Biol Chem. 2015 Sep 11;290(37):22724-33. doi: 10.1074/jbc.M115.646794.
J Biol Chem. 2014 Jun 20;289(25):17597-609. doi: 10.1074/jbc.M114.563452.
Proc Natl Acad Sci U S A. 2010 Nov 2;107(44):18862-7. doi: 10.1073/pnas.1010354107.
Nat Methods. 2007 Apr;4(4):319-21. doi:10.1038/nmeth1024.
1分子蛍光観察アプリケーション用に光学設計された超高開口数対物レンズ
エバネッセント照明専用高開口数対物レンズを用いることで、エバネッセント場の形成がしやすく染み出しも浅くなるため、微弱な蛍光であっても非常にコントラスのよい画像が得られます。1分子蛍光イメージングによるサブユニットカウンティングでは、1分子レベルの蛍光褪色による微小な蛍光強度変化を定量的に計測することが求められますが、超高開口数対物レンズやその対物レンズ専用カバーガラス、専用イマージョンオイルを用いて観察することで、蛍光褪色による微弱な蛍光シグナル変化を定量的に計測することができ、卵細胞膜イオンチャンネルとサブユニットの相互作用を定量的に計測することができました。
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。