TruResolution Objectives Maximize Resolution in Deep Imaging
심층 관측을 위한 자동 구면수차 보정 시스템이 탑재된 TruResolution 대물렌즈
Olympus FVMPE-RS 다광자 레이저 스캐닝 현미경과 함께 사용하도록 설계된 TruResolution 대물렌즈는 컴퓨터 제어형 보정환 시스템이 탑재되었으며 두꺼운 샘플을 심층 관측하는 동안 자동으로 조정되어 구면수차를 보정할 수 있습니다. 다광자 현미경으로 샘플 내에서 심층 이미징을 실시하면 구면수차로 인해 형광 강도와 해상도가 낮아집니다. 대물렌즈 보정환은 이런 문제를 완화하는데 도움이 될 수 있습니다. 그러나 수동 보정환은 조작하기가 번거로울 수 있습니다. TruResolution 시스템에서는 전용 소프트웨어가 Olympus의 독특한 알고리즘을 사용하여 각각의 깊이에서 최적의 보정환 환경을 빠르고 정확하게 판단하면서 전동 보정환을 움직입니다. 특히, 깊은 Z-stack 이미지 획득 시 샘플 안으로 점점 더 깊이 들어가며 관찰할 때 보정환이 자동으로 조절됩니다. 결과적으로, 모든 깊이에서 TruResolution 대물렌즈의 성능을 최대화하여 밝고 높은 해상도의 이미지를 획득할 수 있습니다.
구면수차와 보정환의 역할
현미경 대물렌즈가 세포나 세포기관 내부의 미세 구조를 분석하는 데 필요한 높은 수준의 광학 성능에 도달하기 위해서는 정밀한 설계와 엄격한 제조 공정이 필수적입니다. 구면렌즈 하나가 예리한 점 하나에 빛을 집중시키는 능력에는 물리적인 한계가 있습니다. 따라서 대물렌즈는 이미지를 왜곡하거나 흐릿하게 만드는 개별적인 광학 수차를 정밀하게 균형 잡을 수 있도록 여러 개의 렌즈 요소를 세심하게 선별하고 배치하여 설계합니다. 그러나 잠입 매개물질, 커버 글라스 또는 샘플 자체로 인한 굴절률의 변화가 이러한 균형을 무너뜨릴 수 있습니다. 대물렌즈 조리개의 주변부에서 나오는 광선은 큰 각도로 초점에 도달하며, 대물렌즈 중앙에서 나오는 광선에 비해 접점에서 더욱 큰 굴절을 경험하게 됩니다. 이는 중앙 광선과 주변부 광선 사이에서 초점 위치의 깊이가 달라지는 구면수차로 이어지고, 현미경에서 낮은 해상도와 형광 강도로 나타납니다.
대물렌즈는 구면수차를 보정하도록 설계할 수 있습니다. 그러나 적절한 보정량은 관측 조건에 따라 달라집니다. 조절형 보정환은 다양한 조건에서 이미징 성능을 유지하는 데 필요한 유연성을 제공합니다. 예를 들어, 현미경 초점이 물속에서 잡힐 때는 보정환이 장착된 워터 이멀젼 대물렌즈가 0으로 설정되고 굴절률에 변화가 없습니다(그림. 1(a)). 그러나 커버 글라스를 통해 조직 샘플의 표면을 관찰할 때는 유리로 인해 초점을 저하하는 구면수차가 발생하면서 굴절률이 변합니다(그림. 1(b)). 이러한 구면수차는 광선의 초점에 맞추어 보정환을 재배열함으로써 보정할 수 있습니다(그림. 1(c)). 초점면이 샘플 안으로 더 깊이 이동하면 더 많은 구면수차가 발생하며, 이전의 보정환 설정으로는 예리한 초점을 유지할 수 없게 됩니다(그림. 1(d)). 설정을 추가로 조정해야 합니다. 다광자 현미경을 사용할 경우 관측 깊이가 수백 마이크로미터에서 몇 밀리미터까지 도달할 수 있으며, 높은 이미지 해상도와 대비를 유지하기 위해서 구면수차 보정이 훨씬 더 중요해집니다.
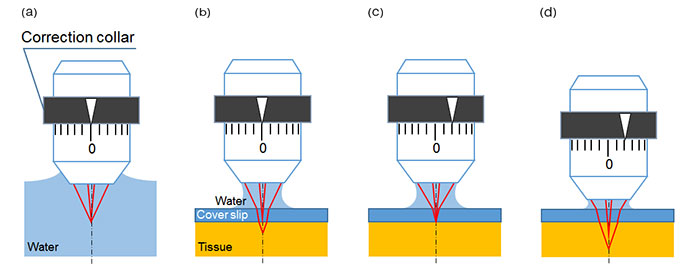
그림 1: 커버 글라스나 조직에 의해 발생한 구면수차와 보정환 조정을 효과를 보여주는 도해
(a) 이상적인 초점 - 물속 물체를 관찰하기 위해 워터 이멀젼 대물렌즈를 사용할 때는 축광과 축외광이 같은 지점에서 초점이 잡힙니다. 구면수차의 영향이 전혀 없습니다.
(b) 구면수차가 있을 때의 초점 - 물에 잠긴 조직의 표면을 커버 글라스를 통해 관찰할 때는 커버 글라스의 양쪽 표면에서 굴절이 발생하여 구면수차가 유발됩니다.
(c) 보정환을 조정하여 구면수차를 보상합니다.
(d) 보정환이 그림. 1(c)와 같은 조정 위치에 설정되어 있는 동안 초점 위치가 샘플 내에서 더욱 깊은 위치로 이동되면 구면수차가 다시 발생합니다.
TruResolution 시스템을 통한 구면수차 자동 보정
다광자 레이저 스캐닝 현미경 검사에서는 이미지 해상도와 이미지 대비가 초점의 크기에 의해 크게 좌우됩니다. 초점이 작고 좁으면 해상도가 높아지지만 동시에 광 밀도와 다중광자흡수 효율성도 높아집니다. 따라서 동일한 레이저 출력 총량에 대해 더 높은 형광 강도가 전달됩니다. 대물렌즈 보정환을 적절히 조정하면 구면수차를 최소화하여 예리한 초점을 유지하는데 도움이 됩니다. 그러나 보정환의 최적 위치는 샘플의 굴절률, 커버 글라스의 두께, 관찰면의 깊이에 따라 달라집니다. 이미지를 획득하는 동안 보정환을 여러 차례 조정해야 할 때도 있습니다.
이미지를 획득하는 동안 수동 보정환을 설정하는 것은 문제가 될 수 있습니다. 조정할 때마다 초점면이 약간 움직이기 때문입니다(그림. 2(a)). 그뿐만 아니라, 다광자 현미경 검사는 종종 암실 환경에서 진행되기 때문에 수작업으로 보정환을 조작하는 것이 더욱 어려워집니다. 이러한 문제들은 용적 이미지를 획득하는 동안 보정환 설정을 최적화하는 것을 특히 어렵게 만듭니다. 대부분의 다광자 현미경은 Z-stack의 평면 하나에 대해서는 적절하지만 대부분의 다른 평면에 대해서는 최적에 미치지 못하는 중간의 보정환 위치에 만족해야 합니다.
Olympus TruResolution 대물렌즈는 컴퓨터 제어형 전동 보정환 시스템으로 이러한 문제들을 해결합니다. 현미경 초점 모터로 보정환 작동을 자동으로 조율하면서 대물렌즈의 Z 위치를 조정하여 보정환을 회전할 때조차도 초점면을 일정하게 유지합니다(그림. 2(a)). 소프트웨어를 통한 원격 제어는 직접적인 사용자 조작을 간소화할 뿐 아니라 Z-stack 획득 시 모든 평면에서 보정환 조정을 자동화할 수도 있습니다. 더욱 우수한 해상도와 대비로 3차원 이미지를 획득할 수 있으며, 이는 심층 관측에서 특히 유용합니다.
TruResolution 시스템은 다양한 보정환 설정에서 획득한 이미지에서 얻은 대비 곡선을 토대로 보정환의 최적 위치를 결정하는 사용자 지정 알고리즘을 사용합니다(그림 2(b)). 사용자는 전용 소프트웨어에서 클릭 한 번만으로 이러한 검색을 자동으로 수행할 수 있습니다. 더 나아가, TruResolution 시스템은 각 평면에서 보정환의 최적 위치를 찾아 저장함으로써 용적 스캔을 진행하는 내내 보정환을 자동으로 구동할 수 있습니다. 이러한 혁신적인 기능은 모든 심도에서 일관된 밝기와 고해상도를 가진 이미지를 간단하게 획득할 수 있게 해줍니다.
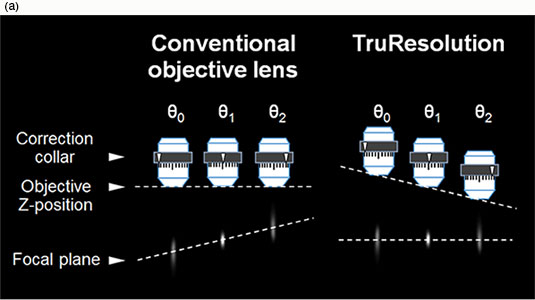
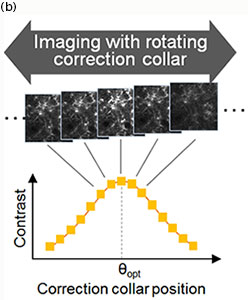
그림 2
(a) 일반 대물렌즈 보정환을 회전시키면 초점면도 변합니다(왼쪽). TruResolution 대물렌즈는 회전각에 따라 대물렌즈의 Z 위치를 자동 변경함으로써 초점면을 유지합니다(오른쪽).
(b) 보정환의 최적 각도 θopt 찾기: 다양한 보정환 각도에서 획득한 각각의 이미지에서 대비값을 계산하여 대비 곡선이 결정됩니다. 그리고 이 대비 곡선의 정점을 판단하여 보정환의 최적 위치가 계산됩니다.
심층 이미징 애플리케이션
그림 3은 살아있는 생쥐의 뇌와 비슷한 굴절률과 광산란계수를 가진 젤에 박힌 형광 비드를 사용하여 TruResolution 대물렌즈의 강력한 심층 이미징 성능을 보여줍니다. 이미지 하단부는 보정환을 조절하지 않으면서 관찰구역이 샘플 상단에서 800mm 깊이로 이동될 때 초점이 점진적으로 약화되는 것을 보여줍니다. z축을 따라 나타나는 번짐 현상과 심도에 따라 감소하는 피크 강도가 눈에 띕니다. 그에 반해서, TruResolution 시스템으로 보정환을 자동 조정하면 각기 다른 심도에서 조밀한 초점이 일관되게 유지됩니다. 이미지의 상단부는 심층 이미징 과정에서 TruResolution이 이미지의 밝기와 해상도를 얼마나 개선하는지를 분명하게 보여줍니다.
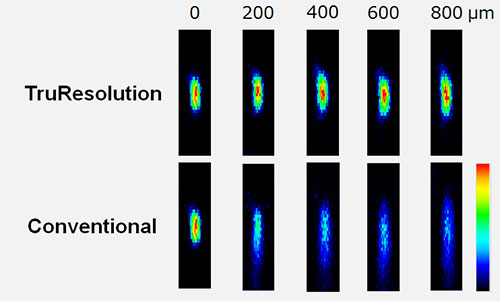
그림 3
살아있는 생쥐 뇌의 광학 특성(굴절률: 1.36, 광산란계수: 43cm-1)을 시뮬레이션한 젤 속의 형광 마이크로비드(직경 = 200nm). 960nm로 여기. 모든 이미지에 일정한 레이저 출력 사용.
(윗줄) TruResolution 자동 구면수차 보정을 적용하여 각기 다른 심도에서 획득한 마이크로비드 XZ 이미지.
(아랫줄) 최적의 이미징을 위해 젤 표면에서 조정해둔 고정형 보정환을 사용하여 각기 다른 심도에서 획득한 마이크로비드 XZ 이미지.
이미지 밝기 척도는 각각의 심도에서 정상화됩니다. 모든 이미지는 FV30-AC25W 대물렌즈로 획득했습니다.
그림 4는 살아있는 생쥐 뇌의 신경세포 수상돌기에 대한 체내(in vivo) 관찰을 위해 TruResolution을 활용하는 것을 보여줍니다. FV30-AC25W TruResolution 대물렌즈(배율 25x, 개구수 1.05, 작동거리 2mm)로 뇌 표면으로부터 400µm 아래에서 획득한 이미지입니다. TruResolution 구면수차 보정 방식은 고정형 보정환을 사용할 때보다 훨씬 더 밝은 이미지를 제공했습니다. 더 중요한 것은 TruResolution을 사용하면 수상돌기 가시의 머리 및 목과 같은 서브미크론 특색의 구조 형태학을 훨씬 더 분명하게 캡처할 수 있다는 것입니다.
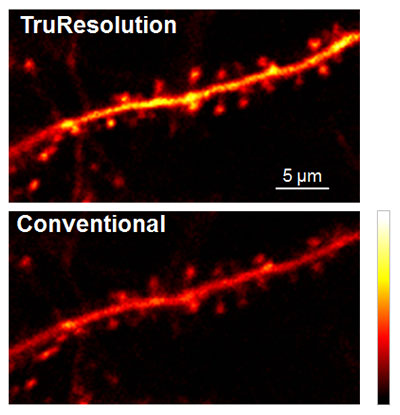
그림 4: 심도 400µm, 여기광 960nm에서 획득한 살아있는 생쥐 뇌(Thy1-YFP-H 생쥐, 감각 피질)의 신경세포 수상돌기에 대한 체내 관찰.
(상단 이미지) FV30-AC25W TruResolution 대물렌즈로 구면수차를 자동 보정하여 얻은 선명하고 높은 대비의 수상돌기 가시 이미지.
(하단 이미지) 기존의 보정환처럼 샘플 표면에 최적화된 보정환으로 캡처한 동일한 관측 시야 비교 이미지.
TruResolution 시스템은 투명하게 처리한 조직 샘플에도 효과적입니다. 굴절률은 조직투명화 기법에 따라 큰 차이가 있으며 같은 기법을 적용할 때도 다를 수 있습니다. 투명화한 조직에서 일반적으로 캡처되는 넓은 용적 전체에서 일관되게 고품질 이미지를 캡처하기 위해서는 반드시 보정환의 위치에 주의를 기울여야 합니다. FV30-AC10SV TruResolution 대물렌즈(배율 10x, 개구수 0.6, 작동거리 8mm)는 1.33 ~ 1.52의 굴절률을 수용할 수 있도록 설계되었으며 다양한 조직투명화 기법을 지원합니다. 그림 5는 ScaleA2로 투명하게 만든 생쥐의 뇌에서 획득한 이미지를 보여줍니다. TruResolution은 보정환의 최적 설정을 자동으로 판단하기 위해 사용되었으며, 임의의 보정환 위치를 사용하여 캡처한 이미지와 특히 비교되는 밝은 대비를 가진 선명한 이미지를 전체 용적에서 만들어냈습니다. 그림 5(b)는 TruResolution으로 구면수차를 최소화했을 때 달성 가능한 이미지 해상도 및 밝기 개선 효과가 상당함을 보여주는 예시입니다.
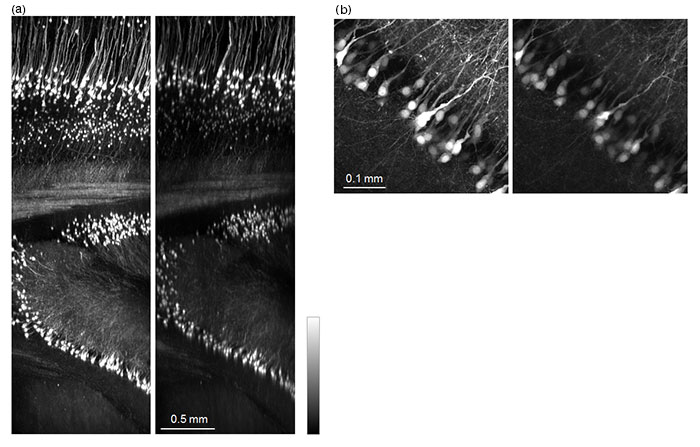
그림 5: ScaleA2로 투명하게 처리한 생쥐의 뇌(Thy1-YFP-H 생쥐).
(a) 4mm Z-stack의 XZ 이미지: 왼쪽 이미지는 TruResolution 시스템으로, 오른쪽 이미지는 임의의 보정환 위치를 사용하여 획득했습니다.
(b) 두께 100µm, 심도 2.7mm에서 XY 이미지의 최대 투사:
왼쪽 이미지는 TruResolution 시스템으로, 오른쪽 이미지는 임의의 보정환 위치를 사용하여 획득했습니다.
모든 이미지는 960nm의 여기광과 동일한 레이저 출력을 사용하여 FV30-AC10SV 대물렌즈로 획득했습니다.
요약
심층 이미징 결과는 전동 보정환을 컴퓨터로 자동 제어함으로써 많은 까다로운 관찰 조건에서 다광자 이미징을 개선할 수 있음을 보여줍니다. TruResolution 대물렌즈는 다광자 현미경에서 구면수차를 최소화함으로써 밝고 높은 해상도의 3D 이미지를 캡처할 수 있게 해줍니다.
저자
Atsushi Doi
R&D 그룹
광학 기술 연구개발팀
광학계 개발부
Olympus Corporation
감사의 말
애플리케이션 이미지는 RIKEN BSI-Olympus 협업센터의 Dr. Hiromu Monai, Dr. Hajime Hirase, Dr. Atsushi Miyawaki가 제공해주셨습니다.
참고문헌
본 백서에서 언급한 연구에 관한 자세한 내용은 다음 기사를 참조하시기 바랍니다.
“A spherical aberration-free microscopy system for live brain imaging.” Biochemical and Biophysical Research Communications (BBRC), April 2018
Yoshihiro Uea, b, Hiromu Monaia, c, Kaori Higuchia, b, Daisuke Nishiwakia, b, Tetsuya Tajimaa, b, Kenya Okazakia, b, Hiroshi Hamac, Hajime Hirasec, Atsushi Miyawakia, c, d,
a BSI-Olympus Collaboration Center, RIKEN, Hirosawa, Wako-City, 351-0198 Saitama, Japan
b OLYMPUS Corporation, Hachioji-City, 192-0033 Tokyo, Japan
c Brain Science Institute, Center for Brain Science, RIKEN, Hirosawa, Wako-City, 351-0198 Saitama, Japan
d Center for Advanced Photonics, RIKEN, Hirosawa, Wako-City, 351-0198 Saitama, Japan.
Sorry, this page is not
available in your country.