Conor L. Evans, PhD, ist Professor, Forscher und Mikroskopieexperte, der sich mit der Entwicklung neuer optischer und bildgebender Hilfsmittel für die Versorgung von Patienten beschäftigt. Wir sprachen mit Dr. Evans über seinen Weg als klinischer Forscher, die Bedeutung der Mikroskopie für seine Arbeit und wie er sie einsetzt, um Herausforderungen in Medizin und Biologie zu lösen. Mehr über Dr. Evans erfahren Sie im folgenden Interview.
Über Conor L. Evans
Dr. Conor Evans besitzt einen Bachelor-Abschluss in chemischer Physik von der Brown University und einen Doktortitel in Chemie von der Harvard University. Er ist außerordentlicher Professor an der Harvard Medical School, Mitglied der Fakultät des Biophysik-Programms der Harvard University und Mitglied der Fakultät des Laser Biomedical Research Center.
Dr. Evans leitet das Evans Lab im Wellman Center for Photomedicine am Massachusetts General Hospital (MGH). Das Labor entwickelt und nutzt diverse Mikroskopie-Tools und -Methoden, um versteckte Informationen zu erkennen, zu messen und zu quantifizieren und Bedarfslücken in der Patientenversorgung zu schließen. Für seine Forschungen und Innovationen im Labor erhielt er zahlreiche Auszeichnungen und Patente für die Umsetzung seiner Technologien in die klinische Praxis.
F: Sie kommen eigentlich aus der chemischen Physik und Chemie. Wie kamen Sie dazu, sich auf die Forschung im Bereich der Patientenversorgung zu konzentrieren? Wie haben Sie so viel über Mikroskopie gelernt?
Dr. Evans: Ich habe mich schon immer für Biomedizin interessiert und wollte zuerst einen Abschluss in Neurowissenschaften machen, bevor ich mich in die Chemie und physikalische Chemie verliebte. Als ich meine Promotion begann, wollte ich in der angewandten, interdisziplinären Forschung arbeiten, in der die physikalische Chemie eine Brücke zur Lösung größerer Probleme sein könnte.
Ich kam in das Labor von Sunney Xie in Harvard, wo ich die großartige Gelegenheit hatte, in seinem Team mitzuarbeiten und die kohärente Anti-Stokes-Raman-Streuung (CARS) zu einer robusten Mikroskopietechnik für die Biomedizin zu entwickeln. In Sunneys Labor hatte ich das Glück, eng mit Eric Potma, damals Postdoc, zusammenzuarbeiten. Er hat mir so ziemlich alles beigebracht, was ich über Mikroskopie weiß. Ich muss mit Eric in drei Jahren etwa 15 Mikroskope gebaut, zerlegt und wieder zusammengebaut haben!
Ich wäre vielleicht weiter in der akademischen Chemieforschung geblieben, wenn es nicht zwei Dinge gegeben hätte. Erstens erkannte Sunney Xie mein Interesse an angewandter Forschung und ermutigte mich, mit der medizinischen Anwendung der CARS-Mikroskopie zu beschäftigen. Als ich die vielen Möglichkeiten erkannte, war ich sofort Feuer und Flamme! Zweitens wurde ich von meinem Bruder inspiriert, der Notfallmediziner wurde. Seine Leidenschaft für die Versorgung von Patienten bewegten mich zu einem Sinneswandel und zu einem Postdoc-Aufenthalt am Massachusetts General Hospital (MGH), wo ich zum ersten Mal Gelegenheit hatte, in der patientenorientierten Forschung zu arbeiten.
F: Können Sie uns etwas über die Schwerpunktbereiche Ihres Labors erzählen? Was wollen Sie mit den einzelnen Forschungsprogrammen erreichen?
1. Sauerstoffsensoren
Dr. Evans: Die Arbeit meines Labors auf dem Gebiet der Sauerstoffsensoren konzentriert sich auf die Entwicklung neuer Geräte zur quantitativen Messung der Sauerstoffkonzentration im Gewebe, besser bekannt als pO2. Dieses Forschungsprogramm begann als Reaktion auf die Herausforderungen in der Krebstherapie. Unser Schwerpunkt änderte sich jedoch, nachdem ich die Gelegenheit hatte, das Center for the Intrepid am San Antonio Medical Center zu besuchen.
Die Begegnung mit verwundeten Soldaten und das Wissen um die unzähligen Herausforderungen bei ihrer Versorgung veranlassten mein Team und mich, ein Forschungsprogramm zur Entwicklung molekularer Sauerstoffsensoren zu starten, die direkt in der Patientenversorgung eingesetzt werden können. Zusammen mit Manolis Rousakis, einem Ausbilder in meinem Team, entwickelten wir eine Serie ultraheller Porphyrin-Sauerstoffsensoren und lernten, diese Sensoren in eine Vielzahl von Materialien in verschiedenen Größen einzubetten, um den Sauerstoff im Gewebe direkt nachzuweisen und zu quantifizieren.
Wir entwickelten Folien, lackier- und sprühbare Verbände, Hydrogel-Verbandsmaterialien, tragbare Sensoren und kürzlich auch Nadel- und Kathetersensoren für die unterschiedlichen Bedürfnisse von Patienten und des Militärs in der medizinischen Versorgung. Wir arbeiten jetzt mit kommerziellen Partnern zusammen, um diese Technologien zur Verbesserung der Patientengesundheit produktreif zu machen.
2. Instrumente zur Visualisierung und Messung der Aufnahme von Arzneimitteln und ihrer therapeutischen Wirkung in vivo
Dr. Evans: Eine der größten Herausforderungen bei der Entwicklung von Arzneimitteln besteht darin sicherzustellen, dass sie ihre zellulären und subzellulären Ziele auch tatsächlich erreichen. Während größere Moleküle, beispielsweise Biologika, problemlos markiert werden können, kann dies bei niedermolekularen Wirkstoffen eine Herausforderung sein, da herkömmliche Marker größer sein können als das Molekül selbst und dessen Pharmakokinetik völlig verändern. Konzepte wie die Röntgenmarkierung und Methoden der Massenspektrographie ermöglichen Einblicke in die Wirkstoffaufnahme, sind aber entweder nicht mit der klinischen Forschung vereinbar oder erfordern eine Biopsie.
Wir sind an Konzepten interessiert, welche die Darstellung und Quantifizierung von Arzneistoffen anhand der intrinsischen Eigenschaften des Moleküls ermöglichen, beispielsweise der Fluoreszenzparameter und chemischer Schwingungen. Wir entwickeln Bildgebungskonzepte unter Nutzung der Fluoreszenzhalbwertszeit und der kohärenten Raman-Bildgebung mit aktuellen Anwendungen zur Quantifizierung der topischen Haut. In enger Zusammenarbeit mit kommerziellen Partnern und der US-amerikanischen Food and Drug Administration (FDA) entwickeln wir neue Konzepte unter Nutzung der kohärenten Raman-Bildgebung zur Messung der Bioverfügbarkeit und Bioäquivalenz von Arzneistoffen. Letztere könnte ein wichtiges Instrument für die Entwicklung generischer topischer Arzneimittel werden.
Um diese Tools vom Labor in die Klinik zu bringen, bauten wir ein kohärentes Raman-System auf einem Wagen, das in den kommenden Monaten erstmals für klinische Studien am Menschen genutzt werden soll. Wir wollen die Beobachtung der Wirkstoffaufnahme mit den späteren therapeutischen Effekten verknüpfen, um so ein umfassendes Verständnis der Reaktion auf eine pharmakologische Behandlung auf der Ebene der Zellen und Gewebe zu erhalten. Wir sehen diesen Ansatz der klinischen Bildgebung als ersten Schritt, um die Wirkstoffaufnahme sowohl bei gesunden Personen als auch bei Kranken direkt zu bewerten und dann bessere Therapien und Maßnahmen zu entwickeln.
3. Deep-Learning-Bildanalyse
Dr. Evans: Deep Learning ist ein fantastisches Werkzeug, um einige unserer größten Herausforderungen in der Bild- und Signalanalyse zu meistern. Unsere Mikroskope und Sensoren erzeugen enorme Datenmengen (manchmal Hunderte von Gigabyte pro Tag), die automatisiert analysiert werden müssen.
Für eine Person oder ein Team von Wissenschaftlern ist es einfach unmöglich, eine solche Menge an Bilddaten manuell zu sortieren. Es war frustrierend, mit maschineller Bildgebung und computergestützten Analysemethoden zu arbeiten, die zwar effektiv sind, aber bei der Analyse versagen oder diese verzerren können, vor allem, wenn eigentlich nur ein Blick auf das Bild ausreicht, um sofort zu wissen, was richtig oder falsch ist.
Mit Deep Learning können wir unsere Erfahrung und Intuition nutzen, dieses Wissen auf einen Computer übertragen und unsere komplexen Analyseaufgaben vollständig automatisieren. Wir konnten Deep Learning für unsere Arbeit in der Pharmakokinetik sowie in neuen Bereichen, zum Beispiel bei unseren tragbaren Sauerstoffsensoren, nutzen. Wir sind begeistert von den Fortschritten im Bereich des Edge Computing, wo Deep-Learning-Modelle direkt auf Geräten eingesetzt werden können, beispielsweise in Anwendungen zur Arzneimittelentwicklung oder für tragbare Sensoren in der Medizin.
F: Welches Forschungsthema interessiert Sie besonders, oder welche zentrale Frage würden Sie gerne beantworten können?
Dr. Evans: Ich denke, ein wiederkehrendes Thema in meiner Forschung ist es, das „Unsichtbare“ sichtbar und quantifizierbar zu machen. Ich war schon immer daran interessiert, Informationen zu erfassen, die normalerweise versteckt oder unerreichbar sind – das ist so etwas wie eine berufsbedingte Neugierde. Mein Team und ich arbeiten an der Entwicklung von Methoden, Werkzeugen und Sensoren, um solche Parameter herauszufiltern und zu quantifizieren, sei es die Sauerstoffkonzentration im Gewebe, die Menge des Medikaments, die ihr Ziel erreicht, oder der Status einer Zelle, die einer Therapie unterzogen wird.
F: Was hat Sie inspiriert, nach versteckten oder „unsichtbaren“ Informationen zu suchen?
Dr. Evans: Während meiner Promotion habe ich an einem schwierigen Problem der kohärenten Raman-Bildgebung gearbeitet, und zwar an der Unterdrückung des nicht-resonanten Anteils in der CARS-Mikroskopie. Diese chemisch unspezifische Wirkung war ein Nachteil der CARS-Bildgebung und ein großes Hindernis für Anwendungen in Biologie und Medizin.
Wir vermuteten, dass dieser Einfluss durch die Phase identifiziert und eliminiert werden könnte: Der nicht-resonante Anteil war mathematisch „real“, der chemisch spezifische resonante Anteil dagegen enthielt sowohl mathematisch „reale“ als auch „imaginäre“ Anteile. Wir haben einen Weg gefunden, diese beiden Komponenten zu isolieren – insbesondere die imaginäre Komponente des CARS-Feldes – und den nicht-resonanten Anteil durch Interferometrie zu unterdrücken. Brian Saar, damals Student in Sunneys Xie’s Labor, scherzte, dass ich „das Imaginäre real gemacht habe“. Mir gefiel dieses Motto, dem ich im Laufe meiner Karriere treu geblieben bin.
F: Was wollen Sie durch Ihre Forschung lernen? Was hat die Mikroskopie damit zu tun?
Dr. Evans: Es gibt so viel, was ich hoffentlich noch lernen werde! Einer der aufregenden und herausfordernden Aspekte meiner täglichen Arbeit in unmittelbarem Kontakt mit Klinikärzten besteht darin, dass man immer wieder mit Demut feststellt, was in der Medizin und Biologie noch nicht bekannt oder verstanden ist. Es ist wie ein Fass ohne Boden, gefüllt mit Problemen, die gelöst werden müssen. Ich hoffe, dass ich mich weiterhin auf die Lösung von Problemen im Bereich der menschlichen Gesundheit und Medizin konzentrieren kann, indem ich sowohl die Photochemie als auch die Photonik nutze – zwei komplementäre Werkzeuge mit enormem Potenzial.
Die Mikroskopie stellt die Schnittstelle zwischen Photochemie und Photonik dar. Erstere liefert einen molekularen Kontrast. Letztere erlaubt es zu sehen, zu erkennen und zu quantifizieren. Für mich ist die Mikroskopie der Dreh- und Angelpunkt meiner Forschung, da sie es uns ermöglicht, räumlich-zeitliche Prozesse in Geweben oder Zellen direkt zu verstehen.
Viele unserer kurz- und langfristigen Forschungsziele werden erst durch die kontinuierlichen Fortschritte der mikroskopischen Techniken möglich, beispielsweise unsere Arbeit in der Pharmakologie und Krebsbiologie. Diese Vorteile betreffen nicht nur die Mikroskope, sondern auch unsere Arbeit an Verbänden und tragbaren Sensoren. Wir greifen häufig auf Bildgebung und Mikroskopie zurück, um Herstellungsverfahren, Materialeigenschaften und Ähnliches zu verstehen. Dies macht die Mikroskopie zu einer zentralen Ressource in unserer problemorientierten Forschung.
F: Wie setzen Sie Multiphotonen- und konfokale Bildgebung bei Ihrer Arbeit ein?
Dr. Evans: Die Multiphotonen-Bildgebung stellt den Hauptaspekt meiner Forschung dar, die konfokale Bildgebung spielt dabei eine wichtige Nebenrolle. Die kohärente Raman-Bildgebung, ein zentrales Instrument unserer Arbeit, ist eine Multiphotonen-Technik, bei der man sich viele der Vorteile der Zwei- und Dreiphotonen-Bildgebung zunutze macht: Anregung mit Licht im nahen Infrarotspektrum, Bildgebung von tiefem Gewebe und automatische Tiefenschnitte. Wir haben die kohärente Raman-Bildgebung – d. h. sowohl CARS als auch die stimulierte Raman-Streuung (SRS) – als biomedizinische Forschungsinstrumente entwickelt, die nun an der Schwelle der klinischen Anwendung beim Menschen stehen.
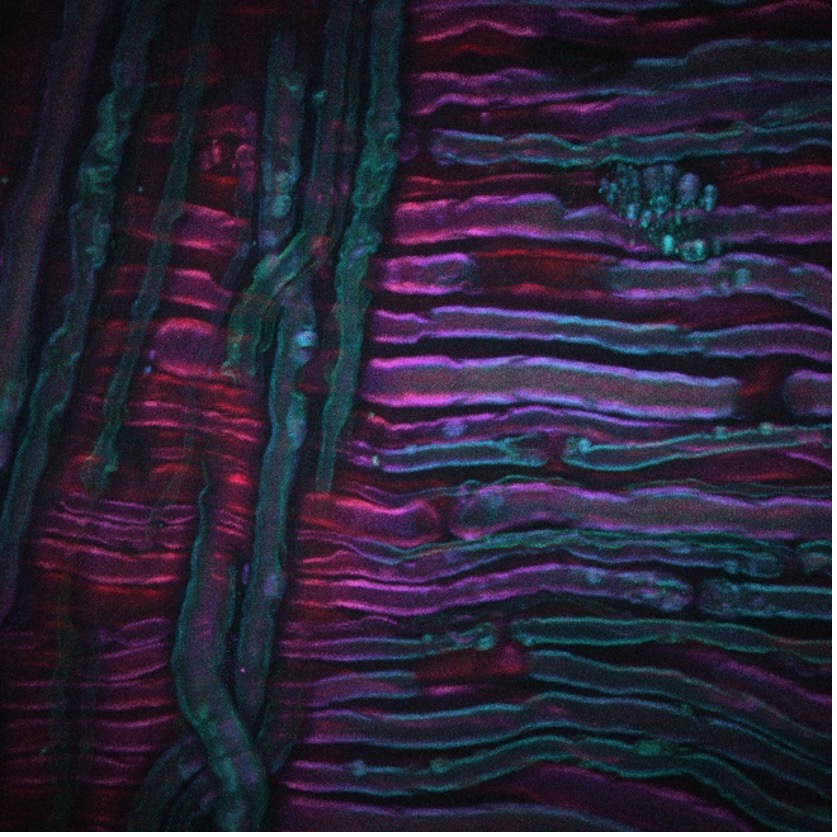
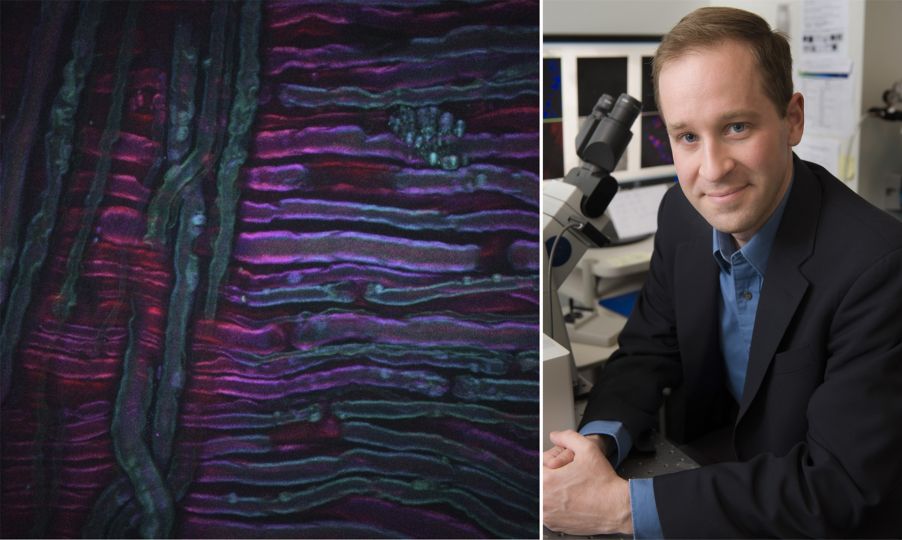
Das obige Beispiel zeigt eine CARS-Aufnahme des Ischiasnervs einer Ratte, die einer Kältetherapie unterzogen wurde, einem neuen Verfahren zur Schmerzbehandlung, das von Lilit Garibyan und Rox Anderson hier am MGH entwickelt wird. Das CARS-Bildgebungssystem wurde auf den symmetrischen CH2-Abschnitt der ungesättigten Lipide abgestimmt, sodass die Verteilung des Myelins sichtbar wird. Mein Dank für das Bild geht an Isaac Pence, PhD, einen Forschungsstipendiaten in meinem Team, und das Bild wäre ohne Sara Moradi Tuchayi, MD, nicht möglich gewesen.
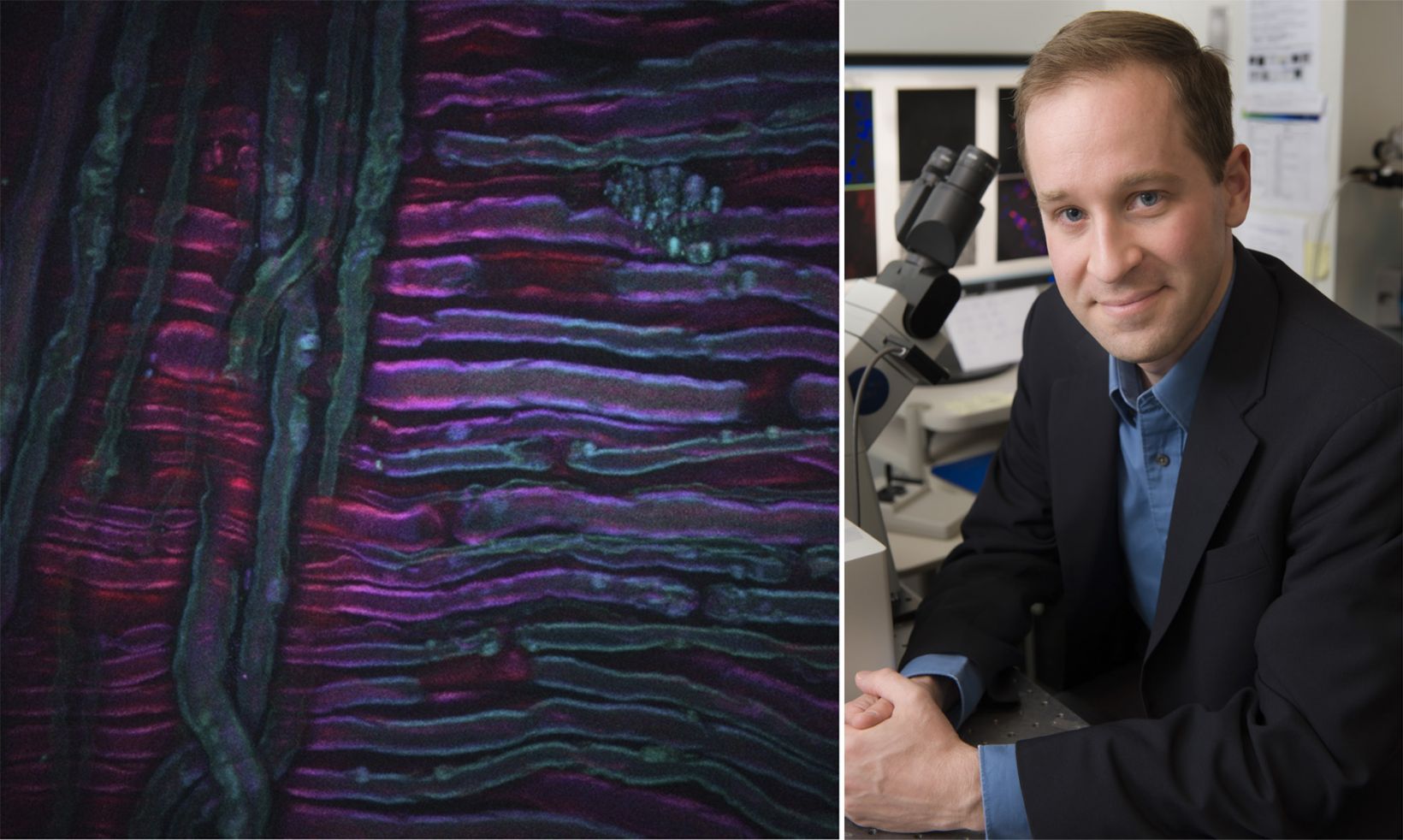
Das zweite Beispiel oben ist ein SRS-Bild des Medikaments Ruxolitinib (grün, SRS abgestimmt auf das Nitrilschwingungsband), das in Ethanol auf die Hautoberfläche einer Maus aufgetragen wurde. Hier erkennt man dank SRS, abgestimmt auf die Schwingung des symmetrischen CH2-Abschnitts (rot), wie sich die Wirksubstanz in den lipidreichen Anteilen des Stratum corneum der Maus anreichert. Das Bild wurde von Amin Feizpour, PhD, zur Verfügung gestellt, einem Forschungsstipendiaten in meinem Team.
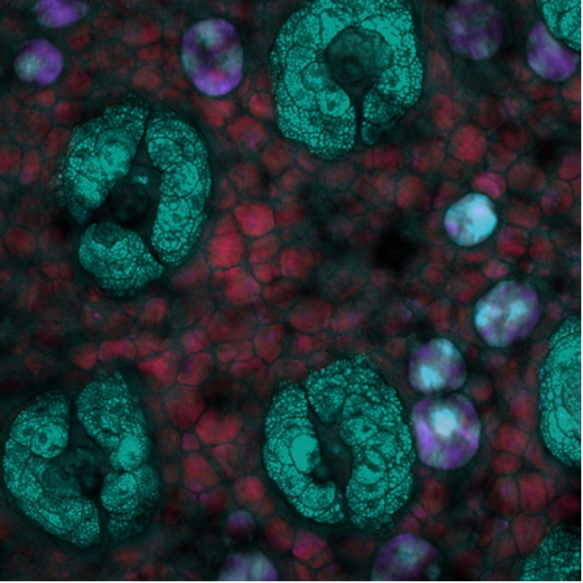
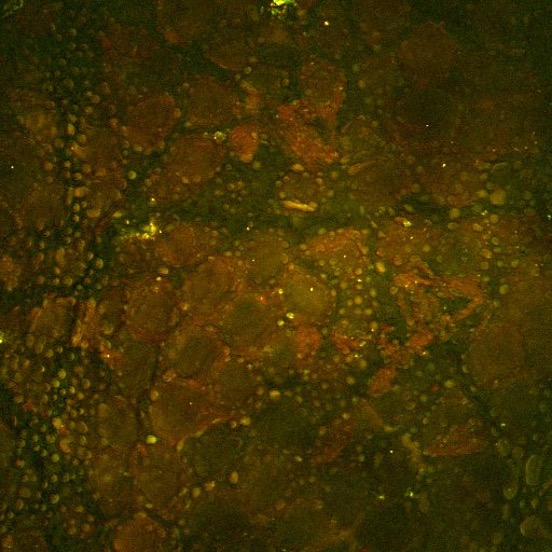
Schließlich sei noch dieses SRS-Tiefenbild in Mäusehaut gezeigt, bei dem die Tiefe farbkodiert ist. Hier sind spezielle lipidreiche Strukturen der Mäusehaut in verschiedenen Tiefen zu sehen, wenn das System auf die symmetrische Schwingung des CH2-Abschnitts abgestimmt ist. Das Bild stellte Isaac Pence, PhD zur Verfügung.
F: Können Sie uns einige bemerkenswerte Meilensteine nennen?
Dr. Evans: Dieses Jahr hat unser Team einige große Meilensteine erreicht, sowohl in unseren Mikroskopieprogrammen als auch in unseren Sensorikstudien. Wir haben unsere Studie zum erstmaligen Einsatz unseres Sauerstoffsensor-Toolkits am Menschen in Science Advances veröffentlicht und führen derzeit drei weitere Studien am Menschen mit dieser neuen Sensorplattform durch. Wir haben eine neue Zusammenarbeit mit 3M begonnen, um diese Instrumente aus unserem Labor zur Produktreife zu führen.
Im Bereich der Mikroskopie freuen wir uns über die Veröffentlichung unseres neuen Ansatzes mit der Bezeichnung „Sparse Spectral Sampling Stimulated Raman Scattering“ (S4RS), der viele der Hindernisse beseitigt, mit denen wir in den letzten Jahren bei der kohärenten Raman-Bildgebung konfrontiert waren. Hierbei springt ein schnell abstimmbarer Faserlaser nur zu bestimmten Raman-Bändern im Raman-Spektrum, statt das gesamte Spektrum abzustimmen. Dies ermöglicht eine schnelle, chemisch spezifische Spektrenerfassung für das gesamte Raman-Spektrum und erlaubt die Bildgebung und Quantifizierung einer breiten Palette von Molekülspezies, wie zum Beispiel von Wirkstoffen und Stoffwechselprodukten. Parallel dazu haben wir mit diesem Lasersystem ein klinisches kohärentes Raman-Imaging-System aufgebaut, das noch in diesem Jahr in ersten Studien am Menschen eingesetzt werden soll.
Trotz der durch COVID-19 verursachten Herausforderungen leistete mein Team bei der Umsetzung unserer Technologien hervorragende Arbeit. Ich bin unheimlich stolz auf das, was sie erreicht haben.
F: Was wird Ihrer Meinung nach die nächste Revolution in der Mikroskopie sein?
Dr. Evans: Ein großes Problem in der Mikroskopie ist aus meiner Sicht die Flut von Daten. Automatisierte Mehrkanalmikroskope eignen sich hervorragend zur Erfassung großer Datenmengen. Wir haben Bildgebungsprotokolle entwickelt, mit denen mehrere Färbungen, Fluorophore, Spektralkanäle und andere Datenpunkte schnell und effizient erfasst werden können.
Dies bringt jedoch die Herausforderung mit sich, aus den riesigen Datensätzen, die wir erfassen, die eigentlichen Informationen zu extrahieren. Mikroskopische Daten enthalten sehr viele Informationen. Die Erfassung von fünfdimensionalen Datensätzen ist relativ einfach, diese Daten sind räumlich, spektral und zeitlich. Es ist zwar manchmal möglich, diese Daten manuell zu sortieren, tiefe Einblicke und statistische Auswertungen erfordern jedoch eine computergestützte Analyse dieser komplexen multidimensionalen Daten.
Ich bin überzeugt, dass die nächste Revolution in der Mikroskopie diese Big-Data-Probleme überwinden wird und bereits in vollem Gange ist. Fortschritte in den Bereichen Datenvisualisierung, Bildanalysealgorithmen und maschinelles Lernen spielen eine große Rolle bei der Bewältigung des Problems mittlerer bis großer Datenmengen in der Mikroskopie. Wegweisend ist meiner Ansicht nach die Arbeit von Neurowissenschaftlern, die mit Connectome- und Hirnatlas-Projekten zeigen, was möglich ist.
Diese Programme sind jedoch enorm aufwändig und erfordern die Zusammenarbeit einer Vielzahl interdisziplinärer Forscher, Datenwissenschaftler und Programmierer. Kleineren Laboren stehen diese Ressourcen im Moment jedoch nicht zur Verfügung. Hinzu kommt, dass in der eher traditionell ausgelegten Ausbildung von Forschern in der Mikroskopie noch nicht überall die Fähigkeiten vermittelt werden, die für den Umgang mit großen, komplexen Bildgebungsdatensätzen erforderlich sind. Da Veränderungen bereits im Gange sind, brauchen wir auch neue Perspektiven für die Ausbildung unserer Studierenden und Stipendiaten sowie für den Umgang mit Mikroskopiedaten, um diese Fortschritte allen in der Mikroskopie Tätigen zugänglich zu machen.
Diese Revolution ist besonders wichtig für die Zukunft der Mikroskopie in der medizinischen Praxis, in der die Bildgebung auf Mikroebene eine immer wichtigere Rolle spielen wird – von der Krankheitsdiagnostik bis zu individuellen Therapien. Wir kennen bereits die mikroskopierbaren „Pillen“ von Gary Tearney, die geschluckt werden können, um In-situ-Diagnosen, bildgebende durchflusszytometrische Analysen von Patientenzellen und ein Hochdurchsatz-Screening von CAR-T-Zellen zu ermöglichen.
Mit der Ausweitung dieser mikroskopiefähigen Systeme auf noch mehr Patientenanwendungen wird die Datenflut weiter zunehmen, ebenso die Notwendigkeit, diese Datensätze sinnvoll zu nutzen.