In der medizinischen und biowissenschaftlichen Forschung haben sowohl Experimente auf Zellebene als auch Experimente mit Tiermodellen große Bedeutung. Jedes Jahr werden mehr Studien zu den Wechselbeziehungen zwischen Lebewesen und ihrer Umgebung unter Einsatz eines Mikroskops durchgeführt. Meistens handelt es sich dabei um intravitale Zeitrafferaufnahmen von lebenden Organismen. Ein großes Problem bei der intravitalen Bildgebung ist die Verschiebung der Mikroskopieebene aufgrund pulsierender Organe und der Bewegung des Tieres selbst.
Wir bieten nicht nur Standard-Mikroskopsysteme, sondern arbeiten auch mit Kunden zusammen, um maßgeschneiderte Lösungen zu entwickeln. Hier ein Beispiel – die von uns entwickelte Maus-Adsorptionsfixiervorrichtung als Lösung für Probleme im Zusammenhang mit der intravitalen Bildgebung von Mäusen.
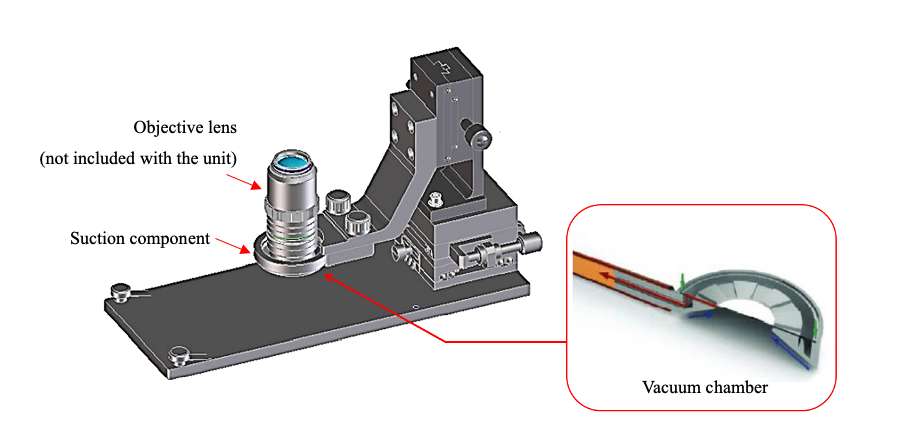
Beispiel für eine kundenspezifische Maus-Adsorptionsfixiervorrichtung
Herausforderungen bei der Durchführung von intravitalen Langzeit-Zeitrafferaufnahmen
Bei der intravitalen Bildaufnahme werden Zeitrafferexperimente durch die Bewegung des Präparats und der Mikroskopieebene aufgrund pulsierender Organe erschwert. Wir haben Interviews mit Forschenden geführt, die Langzeit-Zeitrafferexperimente an lebenden Mäusen durchführen, um ihre Probleme besser zu verstehen. Dabei haben wir Folgendes erfahren:
- Anders als bei Organen, die aus dem Körper entnommen werden können, z. B. bei der Ohrmuschel und dem Darm, ist es schwierig, Organe wie Milz und Leber zu beobachten.
- Herznahe Organe im Besonderen unterliegen dem Einfluss von Pulsation.
- Dabei handelt es sich nicht nur um Bewegungen im Millimeterbereich wie beispielsweise beim Pulsschlag; auch kleinere Bewegungen im Mikrometerbereich erschweren die Betrachtung.
Maßgeschneiderte Lösung von EVIDENT für Probleme mit intravitaler Bildverarbeitung
Um pulsierende Bewegungen bei der Maus auf der Mikroskopieebene zu unterdrücken, entwickelten wir eine Methode, bei der die Bewegung des Tieres im Millimeterbereich durch Unterdruck physikalisch unterbunden wird. Unsere Vorrichtung verfügt über ein ringförmiges Metallstück und eine Ansaugpumpe, um die Mikroskopieebene durch Unterdruck anzusaugen und zu fixieren. Indem wir die Bewegungen der Probe auf ein Minimum reduzierten, gelang es uns, den starken Einfluss des Herzschlags zu unterdrücken.
Lösung für das sekundäre Problem der Vorhaltung einer ausreichenden Menge Immersionsflüssigkeit
Für die Zeitraffermikroskopie von lebenden Organismen werden in der Regel Immersionsobjektive verwendet. Aufgrund der Oberflächenspannung kann jedoch nur eine geringe Menge der Immersionsflüssigkeit auf der Beobachtungsfläche verbleiben. Beim Auffüllen von Immersionsflüssigkeit während des Versuchs können Probleme wie Temperaturschwankungen und physikalischer Druck dazu führen, dass die Beobachtungsfläche und der zu beobachtende Ausschnitt falsch ausgerichtet werden. Um diese Probleme zu lösen, haben wir in der Maus-Adsorptionsfixiervorrichtung auch einen Mechanismus vorgesehen, der genügend Immersionsflüssigkeit für die Langzeitmikroskopie aufnehmen kann. Dieser Mechanismus ermöglicht es, Langzeitbetrachtungen durchzuführen, ohne dass Immersionsflüssigkeit nachgefüllt werden muss.
Ohne unsere Maus-Adsorptionsfixiervorrichtung musste der lebende Körper bei jedem Experiment fixiert werden. Mit dieser Vorrichtung ist es nun möglich, stabile Langzeit-Zeitrafferbetrachtungen durchzuführen und dabei die biologische Aktivität aufrechtzuerhalten.
Erleben Sie die Lösung in Aktion: Sehen Sie sich diese Beispiele für die intravitale Zeitraffer-Bildgebung an.
Sehen Sie selbst, wie gut die Maus-Adsorptionsfixierung funktioniert – in diesen Zeitraffervideos, die in Zusammenarbeit mit dem Matsuda-Labor der Universität Kyoto aufgenommen wurden.
Related Videos
Darstellung der Bewegung lymphatischer Zellen durch Laserablation in Lymphknoten mit Multiphotonenmikroskopie
In diesem Zeitrafferexperiment wurde die ERK-Aktivität in Leberzellen mittels FRET (CFP-YFP) beobachtet. Eine hohe ERK-Aktivität ist rot und eine niedrige ERK-Aktivität blau dargestellt. 30 Minuten nach Beginn der Bildaufnahme sammeln sich die lasergeschädigten Kupffer-Zellen (d. h. lymphoide Zellen) an der Entzündungsstelle.
- Bildaufnahme-Bedingungen
- Probe: Eisuke-Maus
- Objektiv: XLPLN25XWMP
- Laser: 840 nm
- Zoom: 1x (links), 3x (rechts)
- Z-Position: 0 µm (unten), 20 µm (oben)
- Intervall: 40 Sek.
- Gesamtdauer des Experiments: ca. 2,5 Stunden
Dieses Video zeigt die Zeitraffer-Mikroskopie der ERK-Aktivität in Lymphknoten mittels FRET (CFP-YFP). Eine hohe ERK-Aktivität ist rot und eine niedrige ERK-Aktivität blau dargestellt. 30 Minuten nach Beginn der Bildaufnahme kam es zu einer Laserschädigung, und unmittelbar danach hörten die Lymphoidzellen um den geschädigten Bereich auf, sich zu bewegen.
Related Videos
Darstellung der Bewegung lymphatischer Zellen durch Laserablation in Lymphknoten mit Multiphotonenmikroskopie
Dieses Video zeigt die Zeitraffer-Mikroskopie der ERK-Aktivität in Lymphknoten mittels FRET (CFP-YFP). Eine hohe ERK-Aktivität ist rot und eine niedrige ERK-Aktivität blau dargestellt. 30 Minuten nach Beginn der Bildaufnahme kam es zu einer Laserschädigung, und unmittelbar danach hörten die Lymphoidzellen um den geschädigten Bereich auf, sich zu bewegen.
- Bildaufnahme-Bedingungen
- Probe: Eisuke-Maus
- Objektiv: XLPLN25XWMP
- Laser: 840 nm
- Intervall: 30 Sek.
- Gesamtdauer des Experiments: ca. 1 Stunde
Related Videos
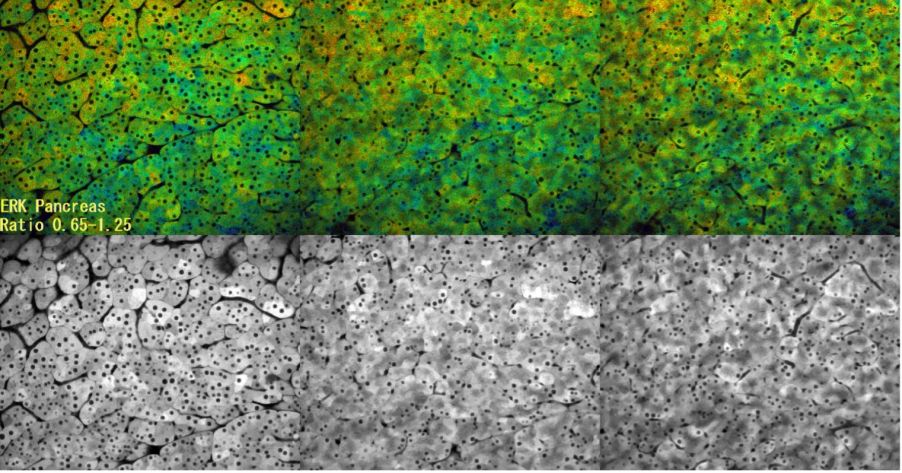
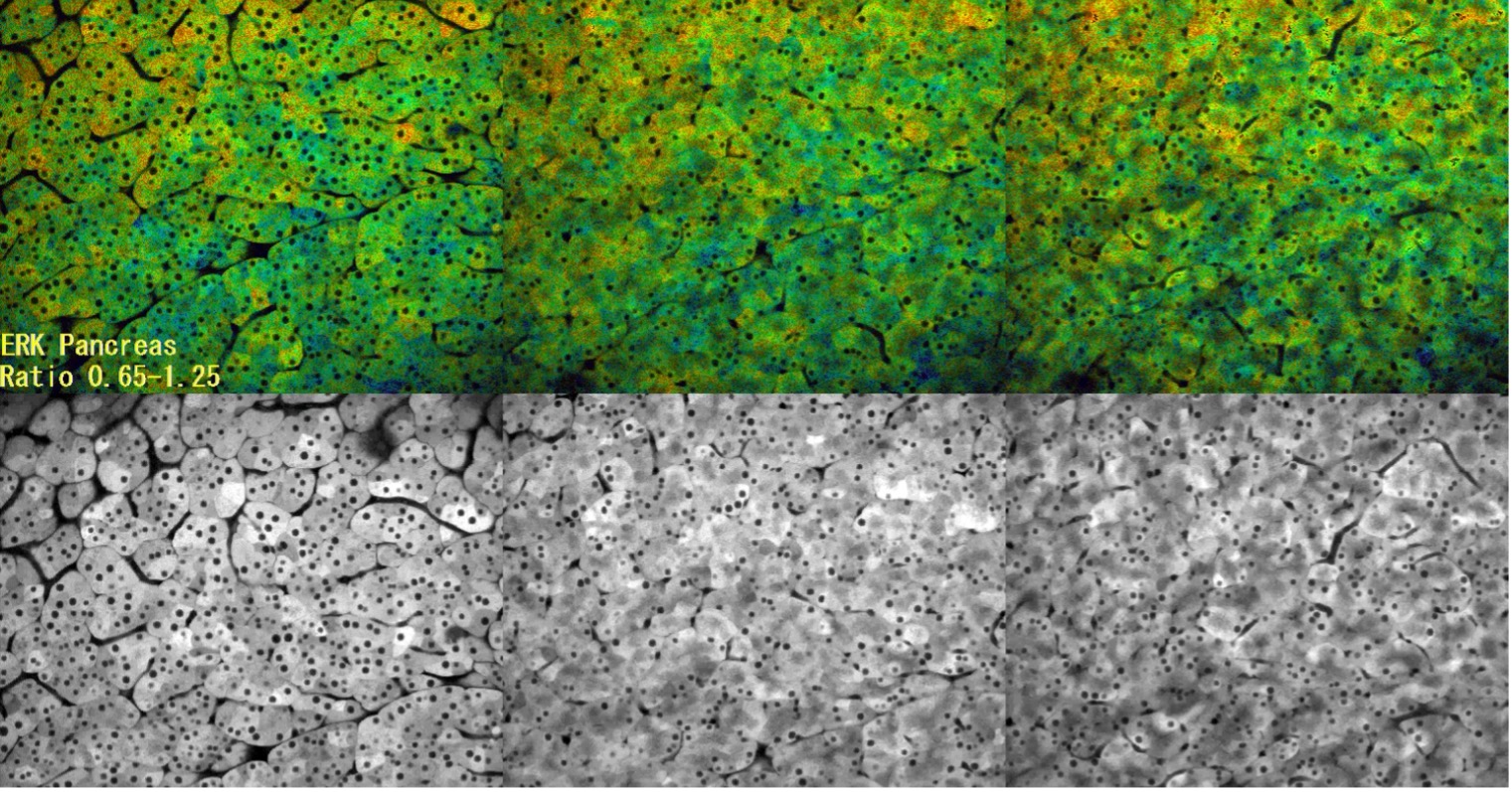
Beobachtung der ERK-Aktivität in Pankreaszellen durch Multiphotonenmikroskopie
In dieser Zeitrafferaufnahme wurde die ERK-Aktivität mittels FRET (CFP-YFP) beobachtet. Eine hohe ERK-Aktivität ist rot und eine niedrige ERK-Aktivität blau dargestellt. Hierbei handelte es sich um ein Kontrollexperiment, um zu bestätigen, dass die Bildaufnahmebedingungen die ERK-Aktivität nicht verändern. Da es auch nach 3 Stunden Mikroskopie keine Veränderung gab, ist davon auszugehen, dass keine Auswirkung auf die ERK-Aktivität vorliegt, auch nicht, wenn die Betrachtung während des Ansaugens mit einer Fixiervorrichtung erfolgt.
- Bildaufnahme-Bedingungen
- Probe: Eisuke-Maus
- Objektiv: XLPLN25XWMP
- Laser: 840 nm
- Z-Position: 0 µm (links), 7,5 µm (Mitte), 15 µm (rechts)
- Intervall: 2 Min.
- Gesamtdauer des Experiments: ca. 3 Stunden
Interessieren Sie sich für diese oder andere kundenspezifische Mikroskopielösungen?
Neben dieser Maus-Adsorptionsfixiervorrichtung bietet Evident andere erweiterte Lösungen für Standardsysteme mit moderner Mikroskopietechnik. Diese maßgeschneiderten Lösungen sind jedoch nicht in allen Ländern oder Regionen verfügbar. Erfahren Sie mehr auf unserer Seite Kundenspezifische Lösungen.
*Die Maus-Adsorptionsfixiervorrichtung beruht auf unserer patentierten Technologie (Patent Nr. 6037732).
**Diese Mikroskopbilder und die Videos in diesem Blogbeitrag wurden in Zusammenarbeit mit dem Matsuda-Labor der Universität Kyoto von Mäusen aufgenommen, die FRET-Sonden exprimieren.