Intravitale Multiphotonenmikroskopie zur Visualisierung dynamischer Interaktionen zwischen Neutrophilen und Monozyten/Makrophagen in den Atemwegen einer Influenza-infizierten Maus
Das angeborene Immunsystem des Körpers ist die erste Verteidigungslinie gegen virale Infektionen. Eine seiner Hauptfunktionen ist die Rekrutierung verschiedener Arten von weißen Blutkörperchen, oder Leukozyten, an Stellen mit Infektionsgeschehen (zum Beispiel den Atemwegen). Alle diese Leukozyten, einschließlich der Neutrophilen und Monozyten/Makrophagen, arbeiten koordiniert, um eine körpereigene Abwehr gegen das Virus aufzubauen. Ein tieferes Verständnis der Mechanismen dieses angeborenen Immunprozesses trägt zur Entwicklung und Verbesserung der Wirksamkeit von Impfstoffen und Therapien bei.
In diesem Anwendungsbeispiel untersuchten Dr. Minsoo Kim und seine Kollegen die Dynamik von Neutrophilen und Monozyten/Makrophagen in vivo in der Luftröhre einer Influenza-infizierten Maus mittels intravitaler Multiphotonenmikroskopie. Die 3D-Beobachtung und Bildanalyse offenbarten bisher nicht erkannte Motilitätsmuster der Interaktionen zwischen Neutrophilen und Monozyten/Makrophagen.
Die 3D-Rekonstruktion der Bilder zeigt die Migration von Neutrophilen der Luftröhre einer Influenza-infizierten Maus. Rot: Neutrophile; weiß: Blutgefäß. Maßstabsbalken: 50 μm. tdTomato-Fluoreszenz wurde bei 975 nm angeregt und im roten Kanal (575–630 nm) detektiert. Die Alexa Fluor 647-Fluoreszenz wurde bei 1200 nm angeregt und im fernroten Kanal (645–685 nm) detektiert. (Daten angepasst aus Referenz [1])
Neutrophilen-Migration in der Luftröhre einer Influenza-infizierten Maus
Für die Visualisierung von Neutrophilen in der Luftröhre einer Influenza-infizierten Maus wurden Ly6G-Cre/ROSA-tdTomato-Mäuse mit dem Influenzavirus infiziert. Innerhalb von 3–6 Tagen nach der Infektion kam es zu einer massiven transienten Infiltration von Neutrophilen und Monozyten in die Luftröhre. Zur Markierung der Blutgefäße wurde den Mäusen vor der Bildgebung ein mit Alexa Fluor 647 konjugierter Anti-CD31-Antikörper i.v. injiziert. An der chirurgisch kanülierten Luftröhre von anästhesierten Mäusen wurde eine intravitale Multiphotonenmikroskopie durchgeführt. Wie in Video 1 gezeigt, wurden sowohl tdTomato+ Neutrophile (rot) als auch Blutgefäße (weiß) visualisiert, sodass die Migration von Neutrophilen um benachbarte Blutgefäße in der Luftröhre der Influenza-infizierten Maus sichtbar wurde.
Motilitätsmuster von Interaktionen zwischen Neutrophilen und Monozyten/Makrophagen
Um sowohl Neutrophile als auch Monozyten/Makrophagen in der Luftröhre einer Influenza-infizierten Maus sichtbar zu machen, wurden Ly6G-Cre/ROSA-tdTomato/Csf1r-EGFP-Mäuse mit dem Influenzavirus infiziert. Neutrophile exprimieren sowohl GFP als auch tdTomato (rote/orange Fluoreszenz), während Monozyten/Makrophagen nur GFP exprimieren (grüne Fluoreszenz). Wie in Video 2 gezeigt, wurden GFP+/tdTomato+ Neutrophile (rot/orange), GFP+ Monozyten/Makrophagen (grün) und Blutgefäße (weiß) in der Luftröhre einer Influenza-infizierten Maus sichtbar gemacht. Am fünften Tag nach der Infektion wurden die meisten Monozyten/Makrophagen unbeweglich, während die meisten Neutrophilen nach wie vor sehr beweglich waren und sich ständig in unmittelbarer Nähe zu den umgebenden Monozyten/Makrophagen bewegten.
Migration und Interaktionen von Neutrophilen und Monozyten/Makrophagen in der Luftröhre einer Influenza-infizierten Maus. Rot/orange: Neutrophile; grün: Monozyten/Makrophagen; weiß: Blutgefäß. Maßstabsbalken: 50 μm. Sowohl GFP- als auch tdTomato-Fluoreszenz wurden bei 975 nm angeregt und dann im grünen Kanal (495–540 nm) bzw. im roten Kanal (575–630 nm) detektiert. Die Alexa Fluor 647-Fluoreszenz wurde bei 1200 nm angeregt und im fernroten Kanal (645–685 nm) detektiert. (Daten angepasst aus Referenz [1])
Ein genauerer Blick bei höherer Vergrößerung zeigte mehr Details im Interaktionsmuster zwischen Neutrophilen und Monozyten/Makrophagen. Video 3 zeigt die 3D-Rekonstruktion der Neutrophilen-Migration zwischen den Monozyten/Makrophagen in der Luftröhre der Maus am sechsten Tag nach der Infektion. Dieses Video zeigt, dass hochmotile Neutrophile (rot) aktiv auf nicht-migratorische umgebende Monozyten/Makrophagen (grün) treffen und sich in diese hinein bewegen. Häufige Begegnungen führten zum Engulfment der Neutrophilen durch Monozyten/Makrophagen als Mechanismus der Entfernung der absterbenden Neutrophilen aus der infizierten Luftröhre.
Die 3D-Rekonstruktion der Bilder zeigt detaillierte Interaktionen zwischen Neutrophilen und Monozyten/Makrophagen in der Luftröhre einer Influenza-infizierten Maus (Tag 6 nach der Infektion). Rot: Neutrophile; grün: Monozyten/Makrophagen. Sowohl GFP- als auch tdTomato-Fluoreszenz wurden bei 975 nm angeregt und dann im grünen Kanal (495–540 nm) bzw. im roten Kanal (575–630 nm) detektiert. (Daten angepasst aus Referenz [1])
Wie das Multiphotonenmikroskop FVMPE-RS unser Experiment erleichterte
FVMPE-RS Doppellasersystem für simultane Multiwellenlängen-Multiphotonen-Bildgebung
Gantry-Frame-Mikroskopsystem für In-vivo-Mausaufnahmen
XLPLN25XWMP2 Objektiv speziell für die Multiphotonen-Anregung
| Spezielle Objektive für die Multiphotonen-Anregung sind für die Multiphotonen-Bildgebung tief im Gewebe optimiert. Die optische Beschichtung bietet eine gute Transmission von 400 nm bis 1600 nm, um sowohl eine effiziente Anregung im nahen Infrarotbereich als auch die Erfassung der sichtbaren Fluoreszenz zu gewährleisten. Das Wasserimmersionsobjektiv XLPLN25XWMP2 von Olympus verfügt über eine hohe numerische Apertur (NA 1,05), einen großen Arbeitsabstand (2,0 mm) und ein breites Sichtfeld (FN 18 mm), sodass es sich hervorragend für die in vivo/intravitale Multiphotonen-Bildgebung eignet. | 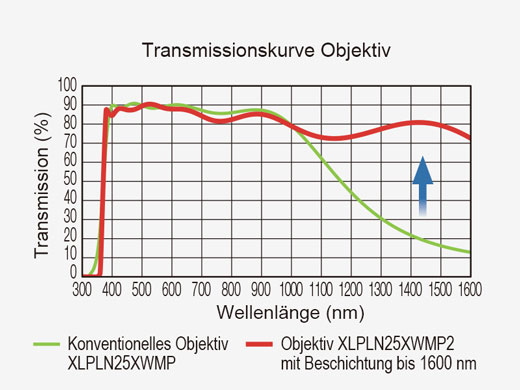 |
|---|
Biographie von Dr. Minsoo Kim
Danksagungen
Dieses Anwendungsbeispiel wurde in Zusammenarbeit mit Dr. Minsoo Kim und Dr. Kihong Lim vom Department of Microbiology and Immunology, David H. Smith Center for Vaccine Biology and Immunology, University of Rochester, NY, USA, erstellt.
Literaturnachweis
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.


