Automatisation du processus de criblage de médicaments, de la préparation de sphéroïdes cancéreux à l’analyse d’images 3D
Résumé
Une solution combinant le système automatisé d’imagerie et de sélection de cellules CELL HANDLER™ de Yamaha avec notre microscope confocal à balayage laser FLUOVIEW™ FV3000 et le logiciel NoviSight™ permet d’automatiser la quasi-totalité de la procédure de criblage de médicaments dans des sphéroïdes cancéreux (figure 1), de la préparation des échantillons jusqu’à l’analyse des images 3D. Un processus automatisé permet d’exécuter des analyses de manière stable et efficace sur grand nombre de modèles cellulaires 3D.
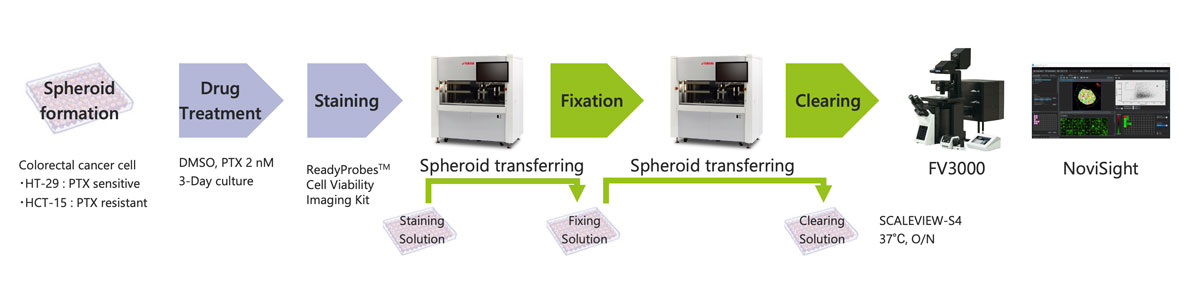
Figure 1 – Procédure de criblage de médicaments dans des sphéroïdes cancéreux
Introduction
L’évaluation des performances d’un médicament anticancéreux à l’aide de sphéroïdes tridimensionnels est d’une grande importance, parce que les sphéroïdes reflètent le complexe micro-environnement in vivo du cancer de façon bien plus fidèle que les modèles bidimensionnels. Les sphéroïdes permettent ainsi aux chercheurs d’évaluer l’efficacité d’un médicament dans des conditions les plus proches possible de celles du micro-environnement d’une tumeur.
Cependant, la préparation, le marquage, l’imagerie et l’analyse 3D de nombreux échantillons prennent énormément de temps. Pour simplifier ce processus, nous avons automatisé la préparation, la fixation et le marquage des sphéroïdes avec le CELL HANDLER™ de Yamaha, et l’acquisition et l’analyse 3D des images avec le système FV3000 et le logiciel NoviSight™.
Avantages
- Le CELL HANDLER permet de préparer les échantillons sans endommager les cellules ni perdre des échantillons. En outre, des images des sphéroïdes sont prises avant et après leur transfert, et divers paramètres sont analysés pour assurer une traçabilité complète.
- Le microscope confocal à balayage laser FV3000 et le logiciel NoviSight peuvent facilement effectuer une analyse tridimensionnelle de nombreux échantillons à la fois. Il est possible de quantifier les différences dans les effets de différents traitements à l’intérieur et à l’extérieur du sphéroïde.
Méthodes
Préparation d’échantillons de sphéroïdes cancéreux
Dans un premier temps, des sphéroïdes d’un diamètre de 100 µm ont été créés dans une plaque à fond en U à très faible adhérence et ont été traités avec 2 nM de paclitaxel (PTX) ou du DMSO. Après trois jours de culture, les sphéroïdes ont été marqués avec la trousse d’imagerie de viabilité cellulaire ReadyProbe™ (vert/bleu), puis transférés dans une plaque contenant une solution de fixation et incubés pendant toute une nuit à 4 ℃. Les cellules ont ensuite été transférées dans du SCALEVIEW-S4 et incubées pendant toute une nuit à 37 °C. Tous les transferts d’échantillons ont été effectués avec un système CELL HANDLER de Yamaha.
Imagerie de sphéroïdes dans des plaques de puits et analyse d’images 3D
Le microscope laser à balayage confocal FV3000 a été utilisé pour acquérir des images des sphéroïdes fluorescents dans chaque puits des plaques. Les données d’imagerie ont été importées dans le logiciel d’analyse cellulaire 3D NoviSight, qui a reconnu les cellules vivantes et les cellules mortes dans les images 3D et a ensuite calculé avec précision le taux de viabilité de chaque puits.
Résultats
Imagerie et analyse dans le CELL HANDLER™ de Yamaha
Le CELL HANDLER peut acquérir des images et des données morphologiques avant et après le transfert des échantillons. Les images montrent que la plupart des sphéroïdes ont été correctement transférés sans perte d’échantillon (figure 2).
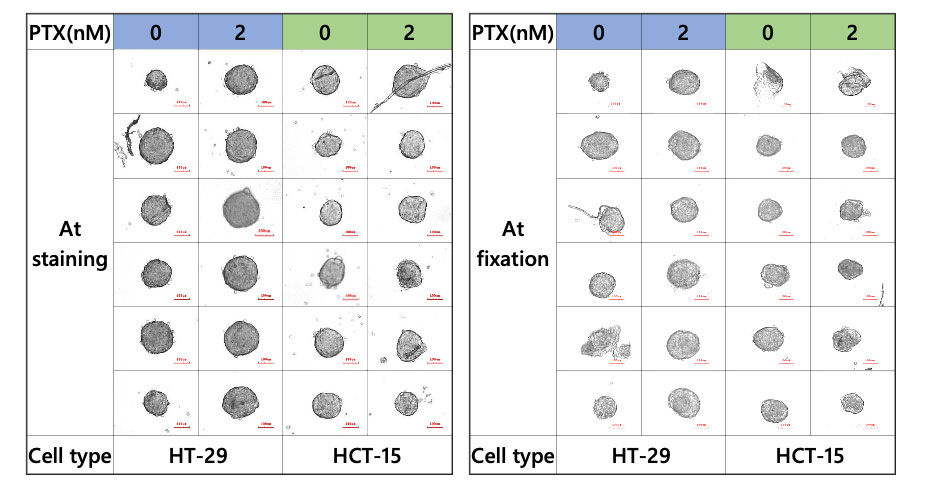
Figure 2 – Sphéroïde au cours du marquage et de la fixation
Aucune différence quant à la surface des sphéroïdes n’a été observée entre les sphéroïdes traités et non traités au PTX. D’autre part, les signaux fluorescents indiquent que le PTX réduit de façon significative le nombre de cellules vivantes dans les sphéroïdes HT-29, alors qu’aucune réduction n’est observée dans les sphéroïdes HCT-15 (figure 3).
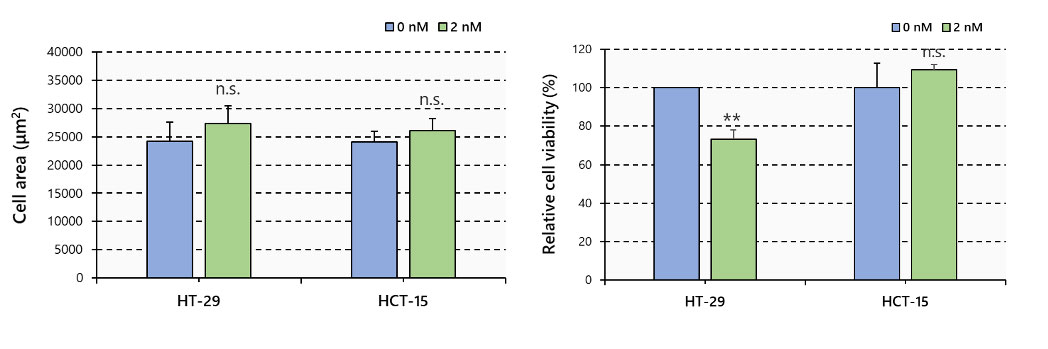
Figure 3 – Surface des sphéroïdes et viabilité cellulaire, N = 6, ** : p < 0,01, barres d’erreur : erreur type
Acquisition et analyse d’images 3D avec le système CLSM FV3000 et le logiciel NoviSight
Pour analyser l’effet du PTX sur le micro-environnement des sphéroïdes, ces derniers ont été observés avec le microscope FV3000 (figure 4).
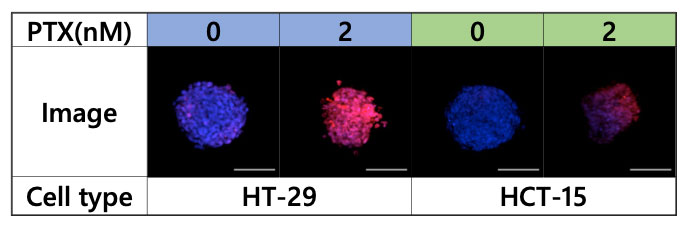
Figure 4 – Images acquises avec le microscope FV3000, bleu : noyau (toutes les cellules), rouge : noyau (cellule morte)
Plusieurs images 3D ont ensuite été chargées dans le logiciel NoviSight pour l’analyse 3D, qui montre que le PTX réduit considérablement le nombre de cellules viables dans les sphéroïdes HT-29 et affecte considérablement le sphéroïde du centre vers l’intérieur. Par contre, un effet moindre est observé dans les sphéroïdes HCT-15 (figure 5).
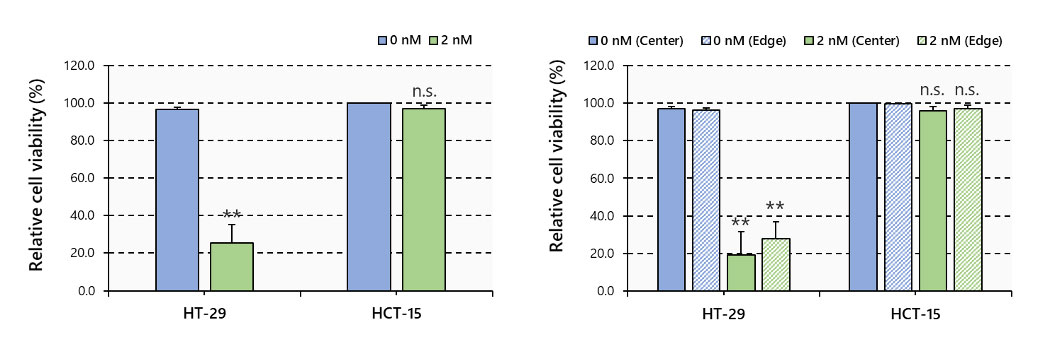
Figure 5 – Viabilité cellulaire par analyse d’images 3D, N = 3~6, ** : p < 0,01, barres d’erreur : erreur type
Conclusion
Le CELL HANDLER de Yamaha simplifie la préparation d’un grand nombre d’échantillons de sphéroïdes. Les échantillons peuvent être facilement analysés en trois dimensions à l’aide du microscope FV3000 et du logiciel NoviSight. La précision de l’analyse cellulaire 3D peut être améliorée grâce au haut degré de traçabilité offert par ce processus automatisé.
Auteur
Hiroya Ishihara, génie biologique, recherche et développement, EVIDENT
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.