Not Available in Your Country
Sorry, this page is not
available in your country.
Vue d’ensemble
 | FLUOVIEW nouvelle génération pour les prochaines révolutions scientifiquesLa série FLUOVIEW FV3000 de microscopes à balayage laser confocaux est conçue pour relever certains des défis les plus difficiles de la science moderne. Doté de la sensibilité et de la vitesse élevées requises pour l’imagerie cellulaire en temps réel ainsi que pour l’observation des tissus profonds, le microscope confocal FV3000 permet une large gamme de modalités d’imagerie, notamment l’imagerie macro-micro, la microscopie en très haute résolution et l’analyse de données quantitatives. This product has been discontinued, check out our current product |
|---|
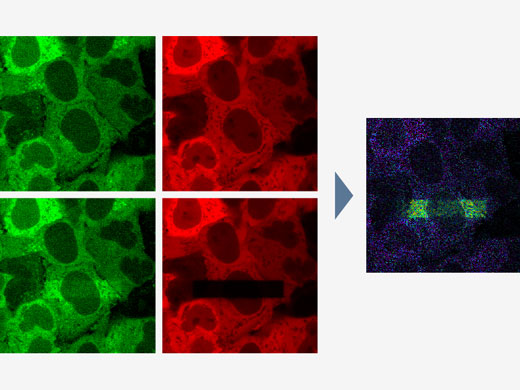
Multiplexage d’images à sensibilité élevée de l’UV au proche infrarougeEn s’appuyant sur une technologie de détection spectrale brevetée, les détecteurs TruSpectral du microscope confocal FV3000 associent une sensibilité élevée et une grande souplesse spectrale, afin de détecter tous les fluorophores, même les plus faibles.
Grâce à une série de mises à niveau soigneusement conçues, les capacités de détection dépendantes de la longueur d’onde pour le proche infrarouge de notre nouvelle solution proche infrarouge FV3000 Red sont encore plus performantes que celles du microscope FV3000 puisque celle-ci est capable de détecter des longueurs d’onde de 890 nm :
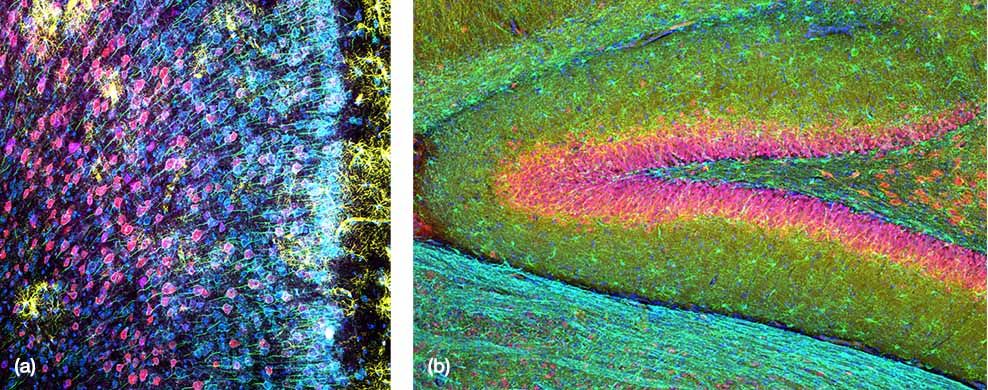
(a) Cortex préfrontal interne de souris avec marquage à la GFAP (glial fibrillary acidic protein, marqueur d’astrocytes, jaune), CaMKII (calmodulin-dependent protein kinase II, marqueur de neurones pyramidaux, rouge), AMIGO-1 (amphoterin-induced protein 1 precursor, marqueur de membranes neuronales, cyan), PV (parvalbumine, marqueur de neurones inhibiteurs, violet), AnkG (ankyrine-G, marqueur de segments initiaux des axones, vert)
et le colorant Nuclear Yellow (marqueur nucléaire, bleu).
|
|---|
Imagerie macro-micro et microscopie à très haute résolutionLa procédure « macro-micro » du microscope FV3000 offre une feuille de route pour l’acquisition de données. Ainsi, vous pouvez observer les données dans leur contexte et localiser aisément des régions d’intérêt à étudier en plus haute résolution.
|
Hémisection d’un cerveau de souris préparée pour microscopie par dilatation (avant dilatation), marquée par des anticorps secondaires anti-GFP (Alexa Fluor 488, vert), anti-SV2 (Alexa Fluor 565, rouge) et anti-Homer (Alexa Fluor 647, bleu). |
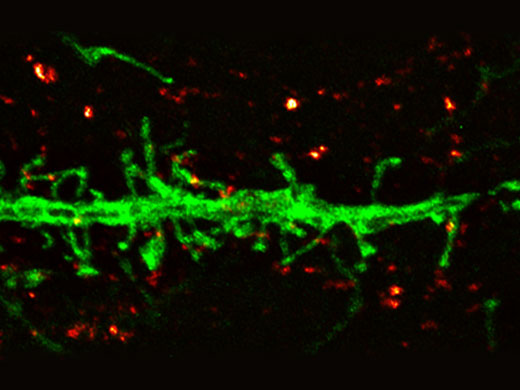
Dendrite (anti-GFP Alexa Fluor 488, vert) et marqueur synaptique (SV2, Alexa Fluor 565, rouge). Image Olympus Super Resolution traitée avec la déconvolution itérative contrainte avancée cellSens. Mesures moyennes sur toute la largeur à moitié du maximum ~135 nm. Image prise avec un objectif silicone 100X, ON 1,35. |
Balayage hybride pour une imagerie plus rapide et plus de productivitéLe scanner hybride FV3000 offre deux scanners en un et améliore les performances d’imagerie confocale.
| Related Videos |
|---|
Related Videos | Imagerie séquentielle préciseLes expériences séquentielles nécessitent une mise au point constante et une faible phototoxicité pour l’échantillon.
|
|---|
Observation des tissus profonds avec les objectifs à immersionL’indice de réfraction de l’huile de silicone est proche de celui d’un tissu vivant, ce qui permet d’effectuer des observations haute résolution profondément à l’intérieur d’un tissu avec une très faible aberration sphérique.
| Image 3D d’un ganglion ciliaire de poussin clarifié à l’aide d’un réactif de clarification.
|
|---|
Imagerie automatisée d’organoïdesDe la recherche des objets cibles à la prise d’images 3D en haute résolution, la procédure d’imagerie des organoïdes peut prendre beaucoup de temps, en particulier lorsque plusieurs puits d’une microplaque sont impliqués. Le module Macro-micro du système FV3000 est une solution intelligente qui automatise le flux de travail d’imagerie des organoïdes pour améliorer considérablement l’efficacité de l’imagerie. Le microscope FV3000 prend des images à faible grossissement, puis le logiciel Macro-micro peut localiser automatiquement vos objets d’intérêt dans le récipient ou le puits et prendre des images à fort grossissement. Ce processus automatisé réduit considérablement le temps que vous consacrez à l’utilisation du microscope. |
|---|
|
Technologies appliquées
Détection TruSpectralLa technologie de détection révolutionnaire TruSpectral offre des résultats exceptionnels par rapport aux détecteurs spectraux des générations précédentes. Intégrée sur chaque canal du microscope FV3000, la technologie de détection TruSpectral associe la souplesse d’un détecteur spectral et la sensibilité d’un détecteur à filtre. |
Related Videos |
|
|
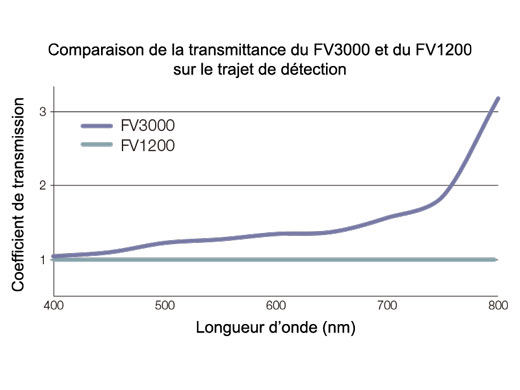
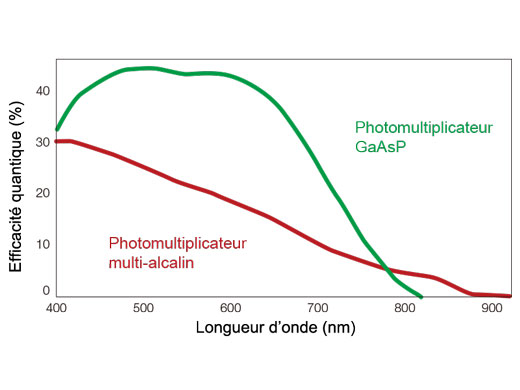
Principe de la technologie de détection TruSpectralBasée sur la technique de transmission holographique de phase volumique (VPH) pour plus d’efficacité, la détection TruSpectral utilise une fente ajustable pour sélectionner les longueurs d’onde de détection de chaque canal à 2 nm. | Sensibilité et précisionIntégrée à tous les microscopes confocaux FV3000, la technologie de détection TruSpectral offre un rendement lumineux largement supérieur à celui des unités de détection spectrale traditionnelles. L’efficacité de la diffraction holographique en phase volumique est jusqu’à trois fois supérieure à celle des réseaux en réflexion. L’utilisateur bénéficie ainsi d’images de microscopie en fluorescence d’excellente qualité pour les échantillons vivants et fixés avec plusieurs fluorochromes. | Efficacité quantique renforcéeLe détecteur haute sensibilité (HSD) du microscope FV3000 permet d’examiner des échantillons dont l’émission est trop faible pour être détectée par un système conventionnel. Le HSD incorpore deux canaux GaAsP avec une efficacité quantique maximale de 45 % et un refroidissement par effet Peltier qui réduit le bruit de fond de 20 % pour les images à rapport signal sur bruit (S/B) élevé sous une lumière d’excitation très faible. Deux HSD peuvent être associés pour une imagerie GaAsP à quatre canaux avec le système FV3000. |
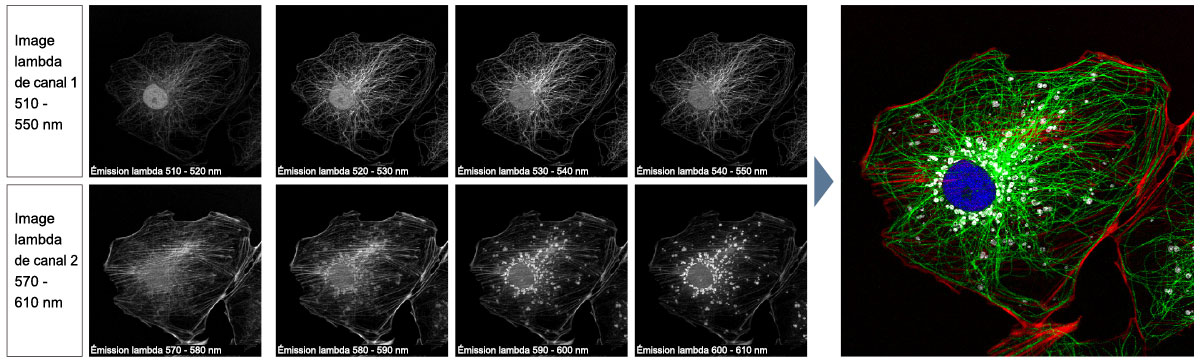
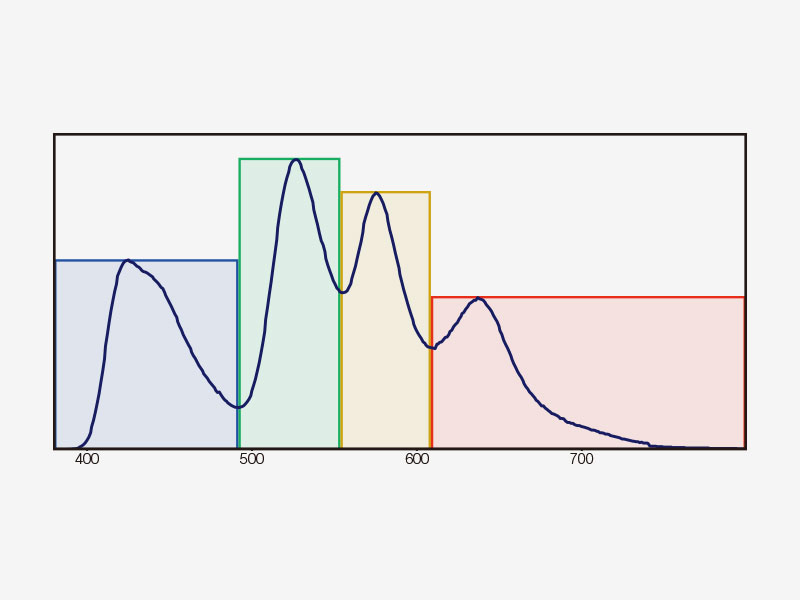 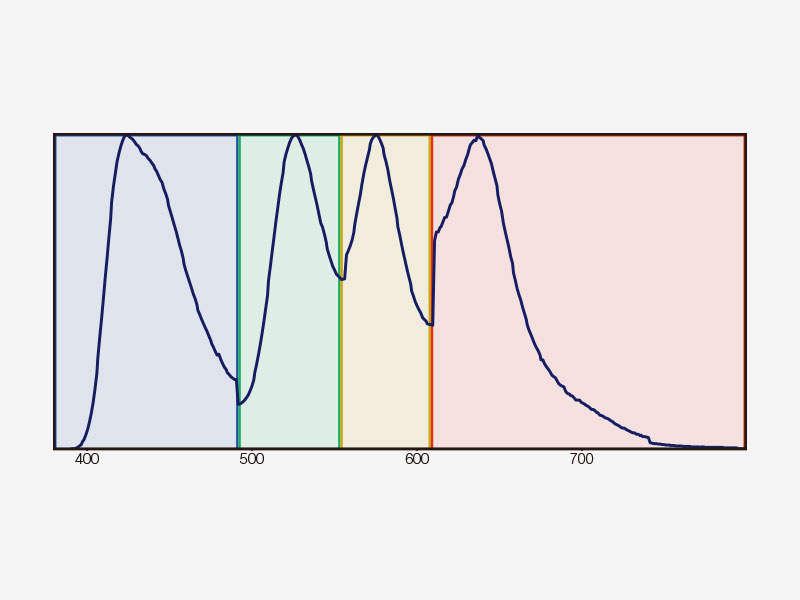 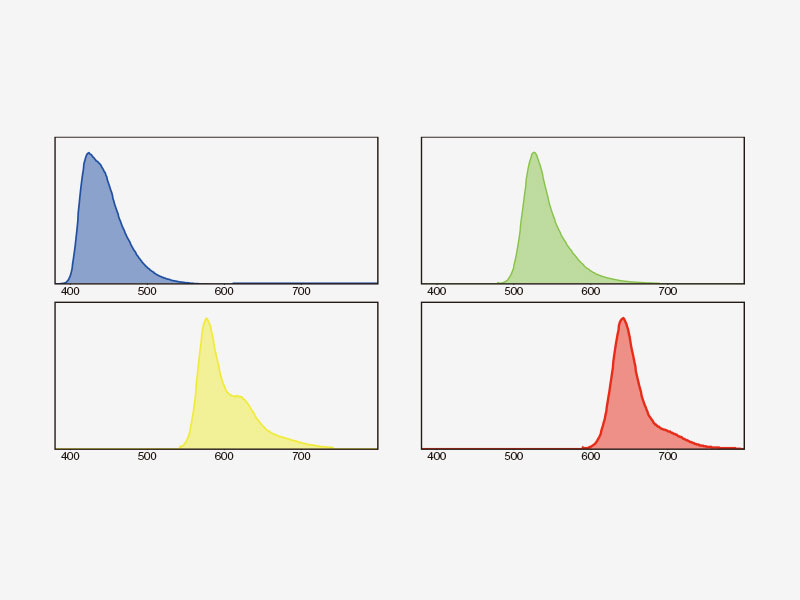 | Détection TruSpectral multicanale avec déconvolution à seize canauxLa détection TruSpectral fonctionne de manière indépendante sur tous les canaux du microscope, pour un véritable balayage lambda multicanal en simultané sur un maximum de quatre canaux. Le mode lambda multicanal facilite la déconvolution spectrale en direct et en post-traitement, pour d’excellents résultats de séparation spectrale. Avec jusqu’à quatre plages dynamiques, les signaux intenses et faibles peuvent être séparés de façon optimale en ajustant séparément la sensibilité de chaque détecteur. |
|---|
Déconvolution spectraleL’algorithme de déconvolution spectrale du système FV3000 permet de séparer les spectres qui se chevauchent à partir des informations spectrales des images de la pile lambda. Les interférences de fluorescence entre les canaux peuvent être éliminées par l’algorithme de déconvolution pendant l’acquisition d’images en direct et le post-traitement, pour une séparation nette de jusqu’à seize fluorophores. |
Déconvolution spectrale multicanal d’une cellule PtK2 marquée avec YOYO-1, Alexa Fluor 488, rhodamine-phalloïdine et MitoTracker Red à l’aide d’images de la pile lambda |
Plaquettes agrégées sur une thrombose dans un vaisseau sanguin de souris. Images prises à 30 ips en plein écran par un scanner résonant avec 2 canaux à photomultiplicateur GaAsP.
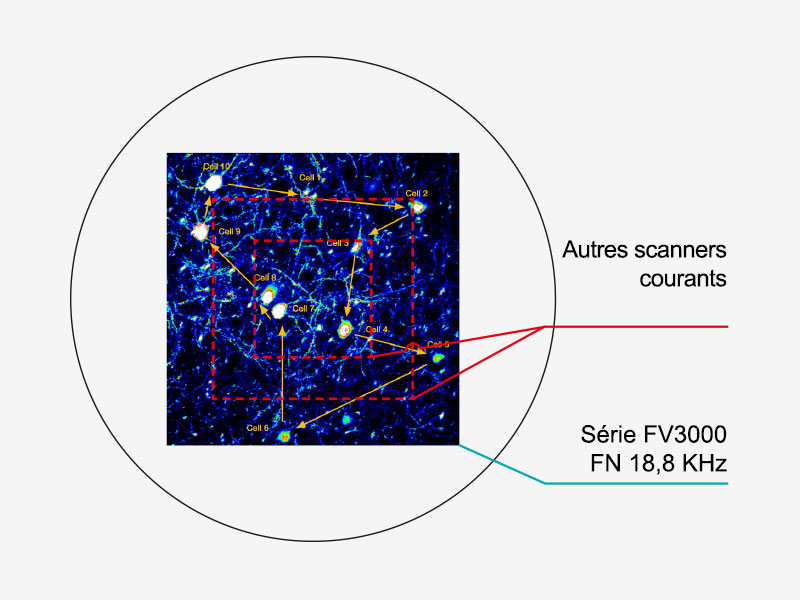
| Options à deux scannersFaites votre choix parmi deux systèmes de balayage : un scanner galvanométrique traditionnel (FV3000) ou un scanner hybride galvanométrique/résonant (FV3000RS).
Aucun compromis entre rapidité et champ d’observationDe nombreuses méthodes de balayage haute vitesse limitent le champ d’observation, et donc votre capacité à examiner de grandes zones avec plusieurs cellules. Le scanner résonant intégré au microscope FV3000RS maintient un champ d’observation 1X complet avec un FN18, même à une fréquence de 30 images par seconde. Le rétrécissement de l’axe Y permet d’atteindre jusqu’à 438 images par seconde. |
|---|
Calcul de la moyenne glissanteLe balayage haute vitesse avec un laser de faible puissance permet de limiter la phototoxicité, mais cette procédure diminue le plus souvent le rapport signal sur bruit, ce qui complique l’obtention d’images intermittentes haute résolution. Avec le traitement de moyenne glissante, vous pouvez ajuster les images intermittentes haute vitesse pour obtenir un meilleur rapport signal sur bruit tout en préservant l’échelle de temps et les données d’origine. |
À droite : Calcul de la moyenne glissante (10 images) sur des données acquises à 30 ips avec un laser de faible puissance. |
|---|
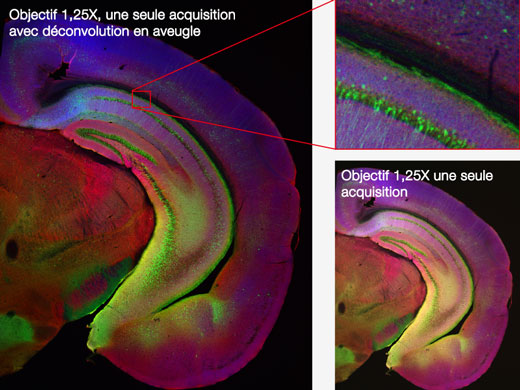
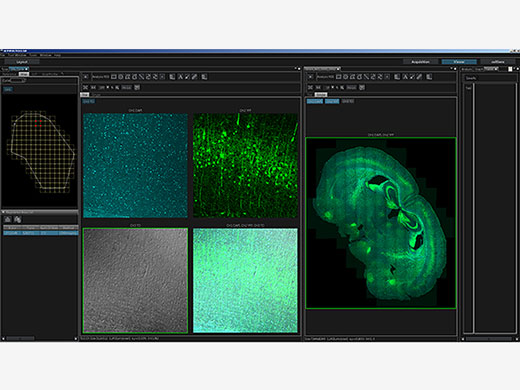 | Passage de « macro à micro »Étudiez les données dans leur contexte grâce au passage de « macro à micro ». Avec la trajectoire optique repensée du système FV3000, générez des images globales détaillées avec un niveau de grossissement faible de 1,25X, puis identifiez aisément les structures à examiner à un grossissement supérieur. L’imagerie en mosaïque permet d’acquérir des images continues 3D (XYZ) et 4D (XYZT) de champs d’observation adjacents. La procédure complète, de l’acquisition d’image à l’assemblage, peut être entièrement automatisée, afin de gagner du temps et de générer davantage de données significatives. |
|---|
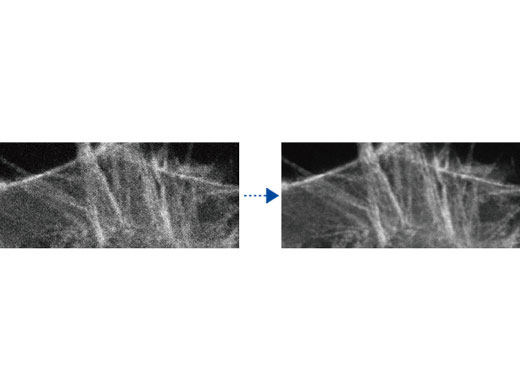
Déconvolution TruSight : traitement des images pour une résolution supérieureSupprimez tout flou et obtenez des images plus claires et plus nettes avec la déconvolution TruSight. Les algorithmes cellSens dédiés pour le microscope confocal FV3000 permettent de bénéficier d’un flux de travail fluide, de l’acquisition jusqu’à la publication en un clic. Profitez du traitement par GPU pour obtenir encore plus rapidement des résultats. | 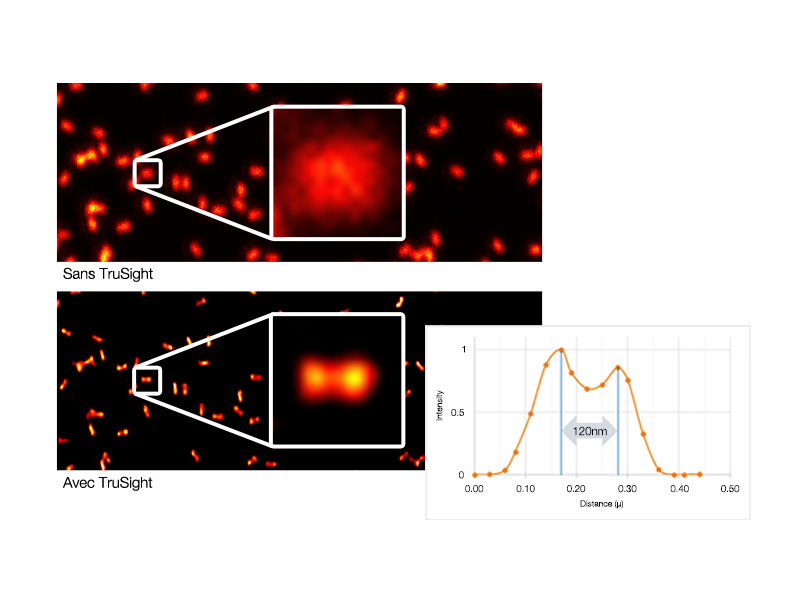  Gauche : image confocale brute / Droite : image avec TruSight |
|---|
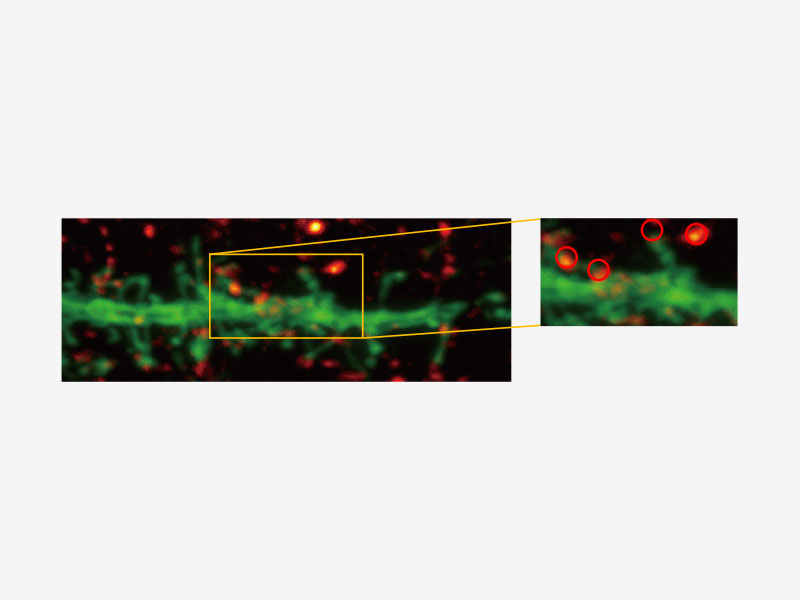 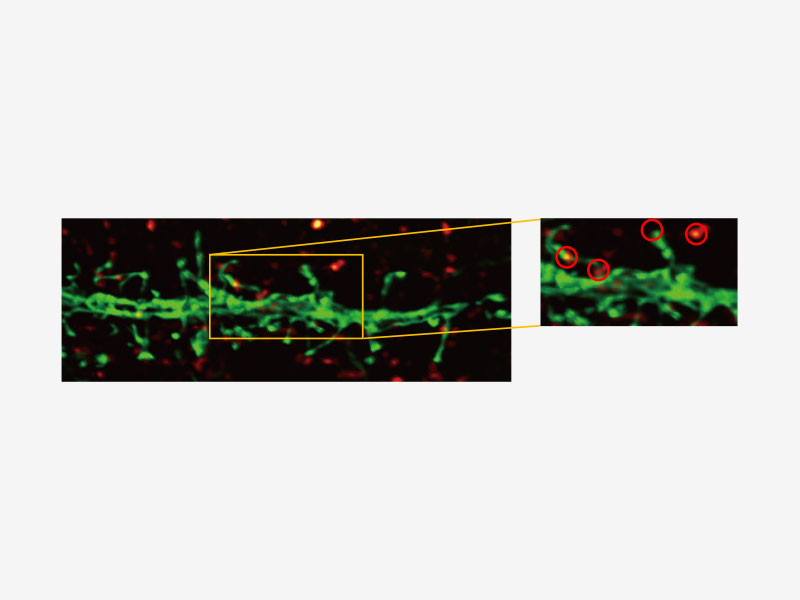 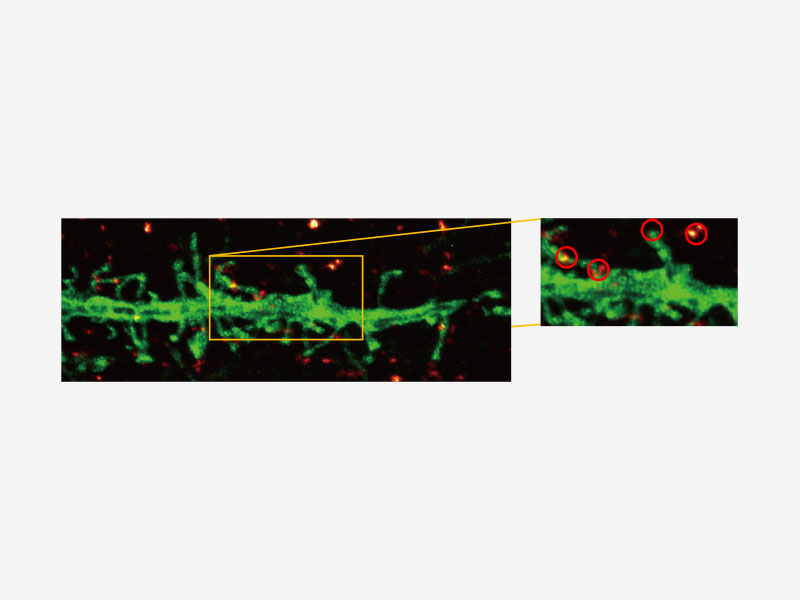 | Technologie Super Resolution d’Olympus (FV-OSR) avec jusqu’à quatre canaux simultanésIdéal pour l’analyse de colocalisation, le module d’imagerie Super Resolution d’Olympus peut acquérir quatre signaux fluorescents soit successivement, soit simultanément, avec une résolution d’environ 120 nm, doublant ainsi la résolution d’une microscopie confocale typique.
En savoir plus sur le module logiciel de Super Résolution FV3000 |
|---|
Imagerie par intermittence TruFocusLa technologie TruFocus permet de renforcer la fiabilité et la précision des expériences à position multiples et de l’imagerie par intermittence longue durée. La technologie TruFocus utilise un laser infrarouge à faible phototoxicité (classe 1) pour identifier la position du plan de l’échantillon et offre deux modes de maintien de la mise au point.
| Related Videos |
|---|
 Comparaison d'objectifs conventionnels (à gauche) avec les objectifs X Line (à droite) | Imagerie microscopique haute performance avec objectifs X LineAvec une correction étendue de l’aberration chromatique, une grande uniformité d’image et une ouverture numérique importante, les objectifs X Line améliorent la qualité d’image du microscope confocal FV3000. |
|---|
Observation des tissus profonds avec les objectifs à immersion dans l’huile de siliconeOlympus propose quatre objectifs à immersion dans l’huile de silicone et à grande ouverture numérique dont les performances sont excellentes pour l’imagerie de cellules vivantes.
| Related Videos |
  | Renforcez la fiabilité de vos analyses de colocalisation avec un objectif à faible aberration chromatique (PLAPON60XOSC2)L’objectif à immersion dans l’huile limite les aberrations chromatiques latérales et axiales dans le spectre 405–650 nm, afin de vous permettre d’acquérir des images de colocalisation fiables et de mesurer des objets avec une grande précision de positionnement. L’objectif compense également l’aberration chromatique en proche-infrarouge (jusqu’à 850 nm) ; il est donc idéal pour la microscopie quantitative.
|
|---|
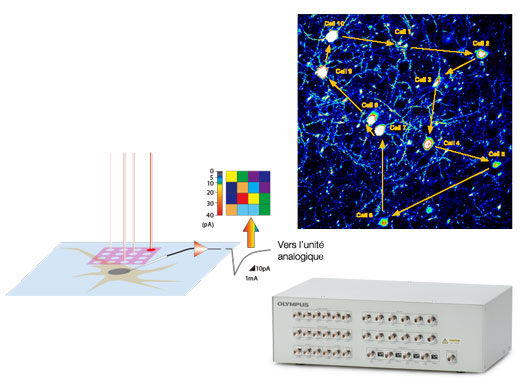
Configurations optimisées pour les expériences électrophysiologiquesSynchronisez votre imagerie confocale avec vos équipements d’électrophysiologie au moyen de la boîte d’interface E/S à signal déclencheur. La boîte d’interface E/S convertit également les signaux de tension en images pouvant être traitées de la même manière que les images de fluorescence. Cela permet de capturer des images sous forme de tension de façon synchrone avec la photostimulation par le scanner confocal. |
Logiciel
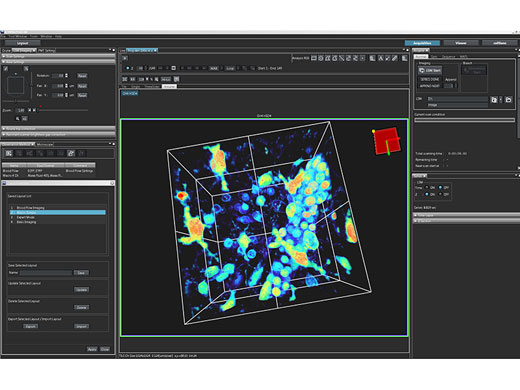
Logiciel intuitifLe logiciel FV3000 rationalise l’ensemble du flux de tâches de l’imagerie confocale, de l’acquisition jusqu’à l’analyse. La mise en page personnalisable et enregistrable permet d’adapter aisément l’interface pour répondre aux besoins de votre flux de tâches et de vos expériences, quelle qu’en soit la complexité. |
|
|---|
Rendu 3D en direct et analyseObservez vos résultats en temps réel grâce à la fonction d’affichage d’image 3D en direct du logiciel FV3000. Les images 3D peuvent être générées pendant leur acquisition, puis affichées en temps réel. Une analyse cellulaire 3D supplémentaire peut être effectuée à l’aide du logiciel NoviSight offert en option. Profitez des puissantes fonctions pour la quantification de cellules sphéroïdes ou d’autres objets 3D dans les expériences sur plaque à puits. |
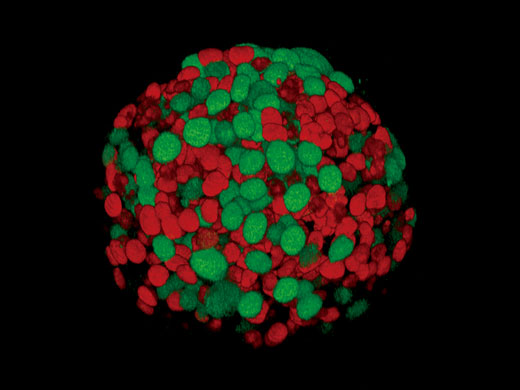
Sphéroïde de cellules HT29 induit avec rapporteurs Fucci.
|
Sphéroïde de cellules HT29 induit avec rapporteurs Fucci. |
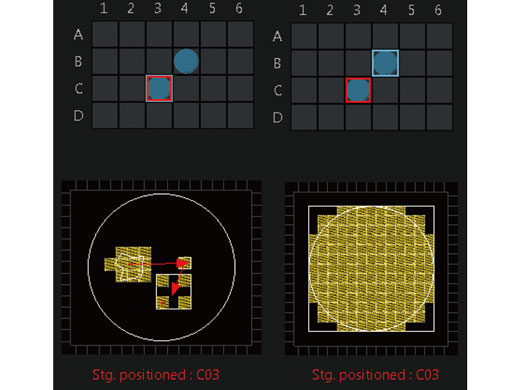
Imagerie sur microplaque et imagerie par intermittence multizoneLe module d’imagerie par intermittence multizone (MATL) offre des données par intermittence fiables et précises, grâce à un contrôle précis des mouvements de la platine motorisée. Vous pouvez ainsi générer des vues d’ensemble détaillées au microscope pour voir les données dans leur contexte. Associez le module MATL au module navigateur de puits pour renforcer encore davantage les fonctionnalités, avec des commandes intuitives et sophistiquées pour une large gamme de récipients de culture cellulaire et de microplaques sur mesure. |
|
|---|
Complexité réduite grâce au gestionnaire de séquenceLe module logiciel de gestion de séquence prend aisément en charge les protocoles les plus complexes. Les expériences par intermittence sur plusieurs jours sont contrôlées avec une précision de l’ordre de la microseconde au niveau du balayage et de l’ordre de la milliseconde pour l’exécution de la séquence. Différents protocoles complexes peuvent être exécutés, notamment :
|
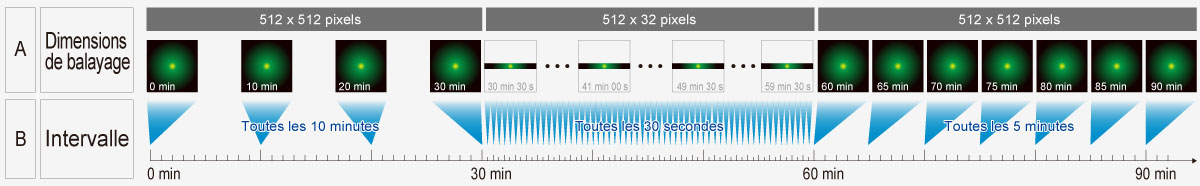 |
Analyse d’images microscopiques quantitativesLe microscope confocal FV3000 incorpore une suite de fonctions d’analyse facultatives pour compléter votre procédure d’imagerie et générer des données quantitatives.
|
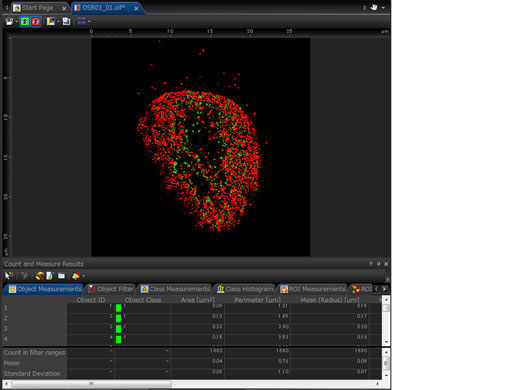
Dénombrement et mesures
|
|
Expériences FRET et FRAPLe microscope FV3000 associé au module d’analyse cellSens Life Science facilite l’acquisition et l’analyse des expériences FRET et FRAP.
|
| 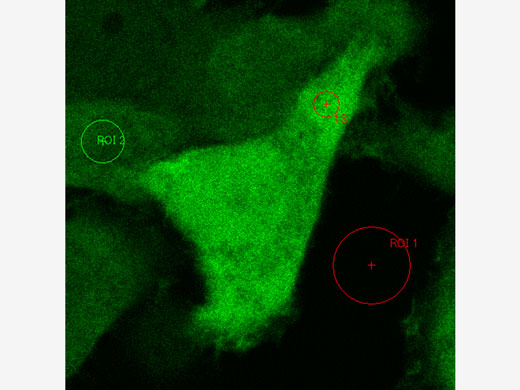 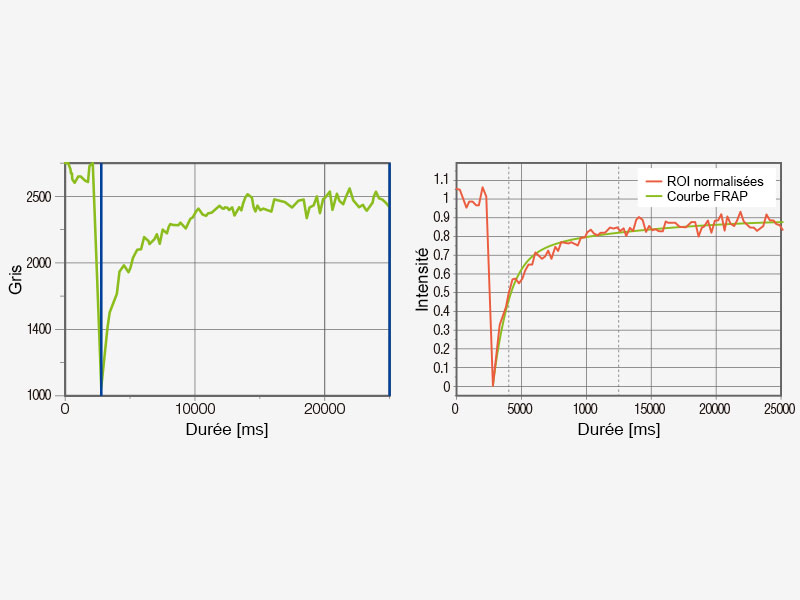 |
Exemple d’analyse FRET (photoblanchiment de l’accepteur) | Exemple d’analyse FRAP |
Imagerie ratiométrique et affichage à modulation de l’intensité (IMD)Le logiciel d’analyse d’imagerie ratiométrique du microscope FV3000 comprend une fonction d’affichage à modulation de l’intensité (IMD), qui affiche les variations du rapport de fluorescence quantitative pendant les acquisitions standard et grande vitesse. Cette fonction est particulièrement utile pour l’imagerie calcique et FRET quand un affichage strictement ratiométrique présente un contraste faible en arrière-plan. |
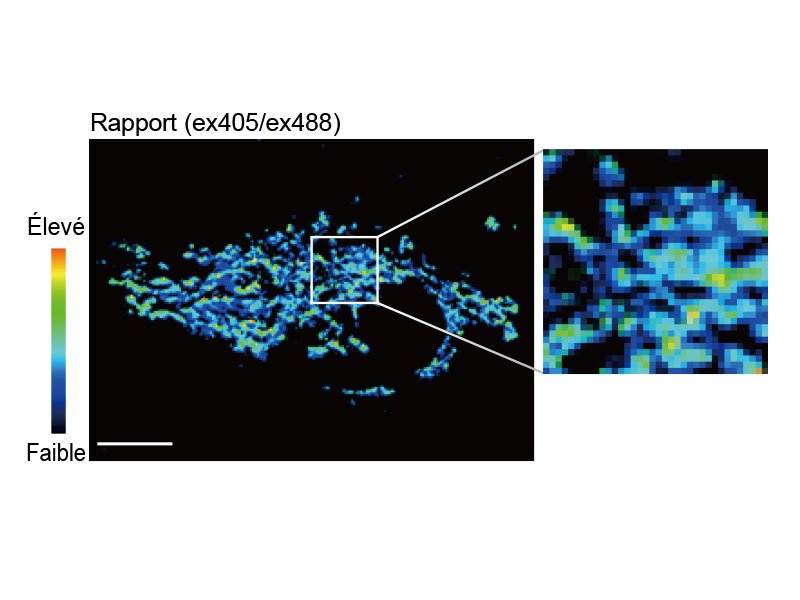 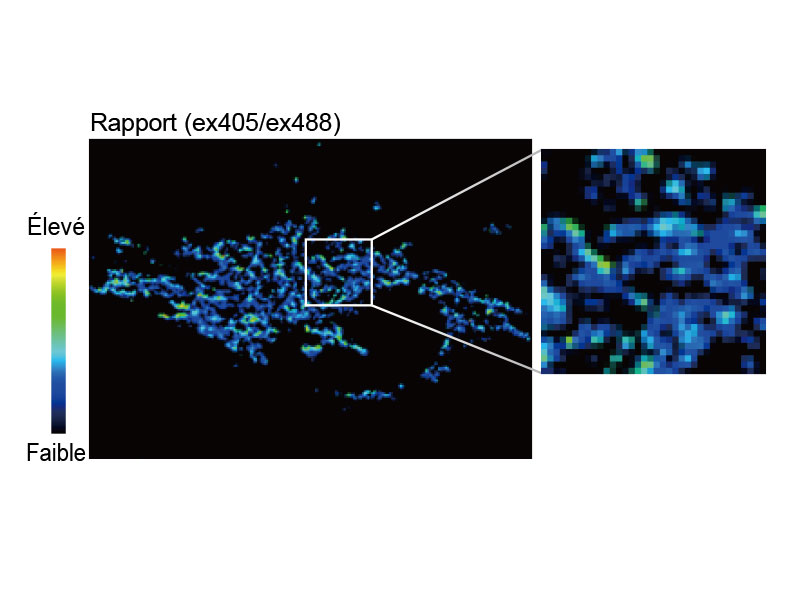
tsGFP1-mito révèle une hétérogénéité lors de la thermogenèse mitochondriale dans des cellules HeLa.
| 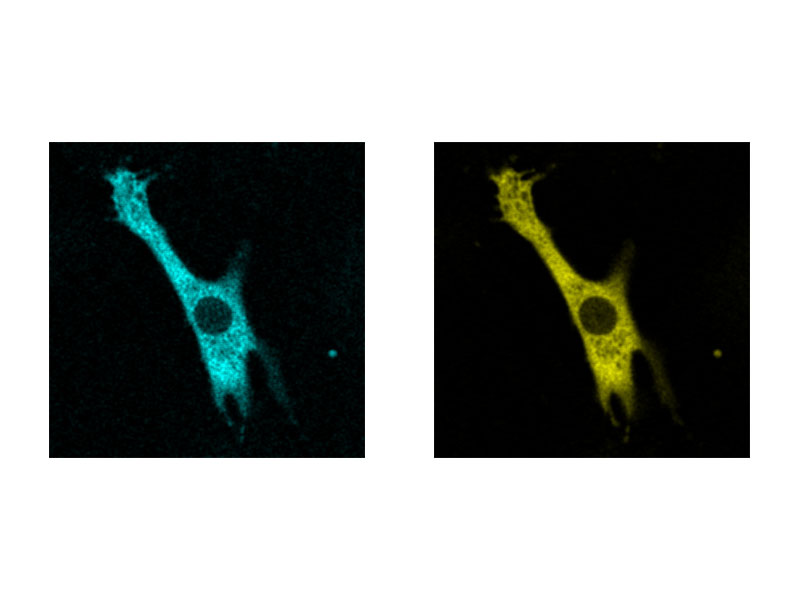 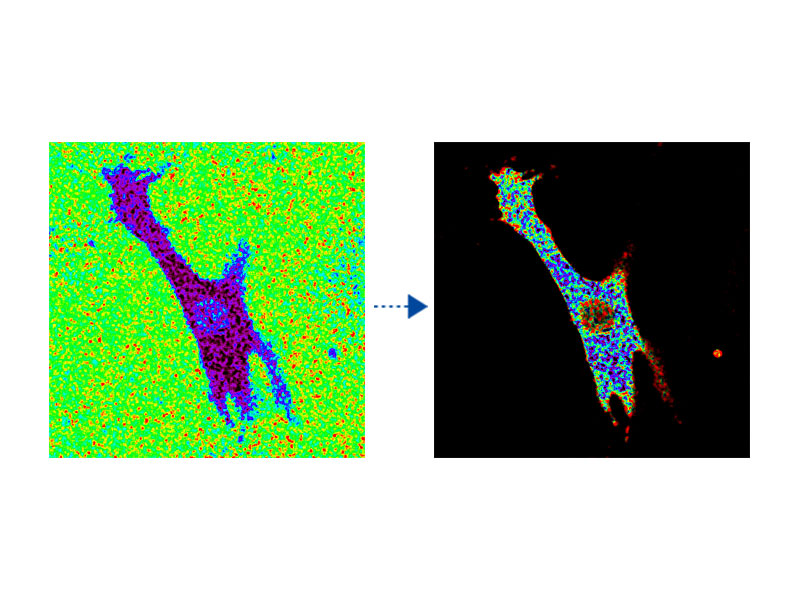
Cardiomyocyte
|
Bioluminescence de cellules souches embryonnaires en cours de différenciation induite par AR au jour 12 après transfection stable avec Bmal1:luc
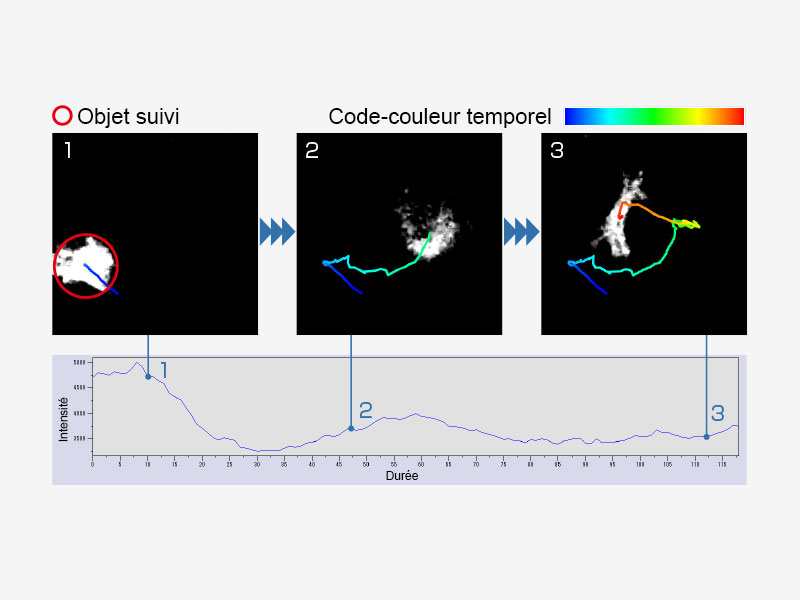
| Suivi d’objetDétectez, suivez et analysez automatiquement les objets en mouvement dans les images à intermittence à l’aide du module cellSens Object Tracking. La fonction de suivi offre un outil puissant et intuitif pour quantifier les processus dynamiques, comme les déplacements et divisions cellulaires. |
|---|
Module de trousse de développement à distance (RDK)La trousse de développement à distance permet la commande et la programmation à distance de certaines fonctions du microscope FV3000 dans des langages comme Python, C++ et Matlab. Le module RDK est un outil puissant pour les utilisateurs ayant de l’expérience en programmation, qui pourront exploiter pleinement leur système. | 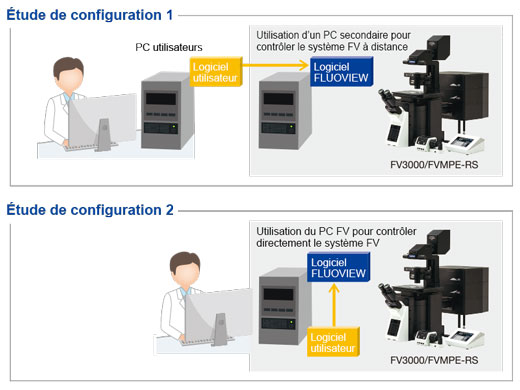 |
|---|
* Bien que la lignée cellulaire HeLa soit devenue l’une des plus importantes dans la recherche médicale, nous devons absolument reconnaître que la contribution de Henrietta Lacks à la science s’est produite sans son consentement. Cette injustice, bien qu’elle ait mené à des découvertes clés en immunologie, en maladies infectieuses et en cancer, a également suscité d’importantes conversations sur la
confidentialité, l’éthique et le consentement en médecine.
|
Configurations
Sélectionnez la configuration la mieux adaptée à votre application |
Microscope inversé
|
Microscope droit (configuré pour l’imagerie de lames)
|
Microscope droit (configuré pour l’électrophysiologie)
|
Composants Combineur laser principal et sous-combineur laser FV3000
Combineur laser principal et sous-combineur laser FV3000Solutions de microscope à balayage laser FLUOVIEW Détecteur de lumière transmise FV3000Solutions de microscope à balayage laser FLUOVIEW  Détecteur spectral haute sensibilité FV3000
Détecteur spectral haute sensibilité FV3000Solutions de microscope à balayage laser FLUOVIEW LogicielKit de développement à distance FV3000Solutions de microscope à balayage laser FLUOVIEW  Module logiciel d’imagerie multipoint et cartographie FV3000
Module logiciel d’imagerie multipoint et cartographie FV3000Solutions de microscope à balayage laser FLUOVIEW  Module logiciel d’imagerie par intermittence multizone FV3000
Module logiciel d’imagerie par intermittence multizone FV3000Solutions de microscope à balayage laser FLUOVIEW  Module logiciel Super Résolution FV3000
Module logiciel Super Résolution FV3000Solutions de microscope à balayage laser FLUOVIEW 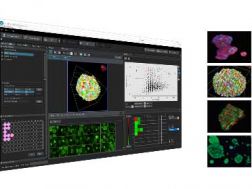 NoviSight Le logiciel d’analyse cellulaire 3D NoviSight procure des données statistiques sur les sphéroïdes et autres objets 3D dans les expériences réalisées en microplaque. Utilisez-le pour quantifier l’activité cellulaire en trois dimensions, observer plus facilement les événements cellulaires rares, obtenir des numérations cellulaires précises et améliorer la sensibilité de détection. Le logiciel NoviSight fonctionne avec toute une gamme de techniques d’imagerie, y compris l’imagerie confocale à balayage ponctuel, l’imagerie par excitation à deux photons, l’imagerie confocale à disque rotatif et l’imagerie de cellules vivantes à super-résolution.
Scanners |
Caractéristiques techniques
| FV3000 | FV3000RS | ||
|---|---|---|---|
| Combineur laser principal | Laser de lumière visible |
405 nm : 50 mW, 488 nm : 20 mW, 561 nm : 20 mW, 640 nm : 40 mW
Un port laser en option pour le sous-combineur laser ou une unité laser en option | |
| Laser en option | Sous-combineur laser |
Au maximum 3 unités laser comme suit :
445 nm : 75 mW, 514 nm : 40 mW, 594 nm : 20 mW, fibre connectée au combineur laser principal | |
| Unité laser unique | 445 nm : 75 mW, 514 nm : 40 mW ou 594 nm : 20 mW, directement connectée au combineur laser principal | ||
| Unité laser proche infrarouge unique | 730 nm : 30 mW, 785 nm : 100 mW, connectée au scanner via un port en option | ||
| Scanner | Méthode de balayage | 2 miroirs galvanométriques à revêtement en argent |
2 miroirs galvanométriques à revêtement en argent
1 miroir résonant à revêtement en argent et 1 miroir galvanométrique à revêtement en argent |
|
Scanner galvanométrique
(Imagerie normale) |
Résolution de balayage : 64 × 64 à 4096 × 4096 pixels
Vitesse de balayage (unidirectionnel) : 512 × 512 avec 1,1 s–264 s, durée de pixel : 2 µs–1 000 µs Vitesse de balayage (bidirectionnel) : 512 × 512 avec 63 ms–250 ms, 256 × 256 avec 16 ms–125 ms Zoom optique : 1X - 50X par incréments de 0,01X Rotation de balayage : rotation libre (360 degrés) par incréments de 0,1 degré Mode de balayage : PT, XT, XZ, XY, XZT, XYT, XYZ, XYλ, XYZT, XYλT, XYλZ, XYλZT Balayage ROI, rectangle, ellipse, polygone, zone libre, ligne, ligne libre et point, mode tornade pour stimulation seulement | ||
|
Scanner à résonance
(imagerie à haute vitesse) | - |
Résolution de balayage : 512 × 32 à 512 × 512 pixels
Vitesse de balayage : 30 i/s à 512 × 512, 438 i/s à 512 x 32 Zoom optique : 1X–8X par incréments de 0,01X Mode de balayage : XT, XZ, XY, XZT, XYT, XYZ, XYλ, XYZT, XYλT, XYZ, XYλZT Balayage ROI, rectangle, ligne | |
| Sténopé | Sténopé motorisé unique, diamètre de sténopé 50–800 µm (incréments de 1 µm) | ||
| Numéro de champ (FN) | 18 | ||
| Tourelle porte-cubes dichromatique | 8 positions (miroirs dichroïques haute performance et miroir 10/90) | ||
| Unité en option pour scanner | Contrôleur de puissance laser, port laser en option | ||
| Détecteur spectral | Module de détection | Photomultiplicateur GaAsP refroidi (type sensibilité élevée) ou photomultiplicateur multi-alcali, 2 canaux | |
| Méthode spectrale |
Réseau de diffraction holographique en phase volumique motorisé,
fente ajustable motorisée, bande passante de longueur d’onde sélectionnable : 1–100 nm, résolution de longueur d’onde : 2 nm | ||
| Tourelle porte-cubes dichromatique | 8 positions (miroirs dichroïques haute performance et miroir) | ||
| Détecteur proche infrarouge | Module de détection | Tube photomultiplicateur GaAs, 1 canal ou 2 canaux avec cube de filtres | |
| Unité d’éclairage pour fluorescence | Source de lumière pour fluorescence externe, adaptateur fibre vers le port optique de l’unité de balayage, commutation motorisée entre le trajet optique du microscope à balayage laser et l’éclairage par fluorescence | ||
| Unité de détecteur à lumière transmise | Module avec détecteur à photomultiplicateur de lumière transmise externe intégré et lampe à DEL, commutation motorisée | ||
Microscope |
| Statif inversé | Statif droit (pour l’imagerie) | Statif droit (pour l’électrophysiologie) | |
|---|---|---|---|
| Statif du microscope |
Microscope inversé motorisé
IX83 (IX83P2ZF) |
Microscope droit à platine fixe motorisée
BX63L |
Microscope droit à platine fixe motorisée
BX63L |
| Tourelle porte-objectifs | Tourelle porte-objectifs rotative sextuple motorisée | Tourelle porte-objectifs rotative septuple motorisée |
Tourelle porte-objectifs à bascule encodée
Tourelle porte-objectifs à glissière encodée |
| Condenseur | Condenseur à distance focale longue motorisé | Condenseur universel motorisé | Condenseur à distance de travail longue manuel |
| Course de mise au point |
Mise au point au niveau de la tourelle porte-objectifs motorisée intégrée
Course : incrément minimum : 0,01 µm | ||
Logiciel |
| Fonctions de base |
Interface graphique pour environnement en chambre noire. Disposition d’écran configurable par l’utilisateur.
Fonctions de récupération des paramètres d’acquisition. Capacité d’enregistrement sur disque dur, puissance laser réglable et HV avec Focus stacking. Focus stacking avec mélange alpha, projection d’intensité maximale, rendu de surface iso. |
|---|---|
| Affichage des images 2D | Affichage de l’image individuelle : chaque canal individuellement côte à côte, fusion, rognage, mosaïque en direct, tuile en direct, série (Z/T/λ), LUT : réglage de couleur individuel, pseudo-couleur, commentaire : graphique et saisie de texte. |
| Visualisation et observation 3D |
Rendu volumique interactif : affichage de rendu volumique, affichage de projection, animation affichée.
Fonctionnalité d’opérations séquentielles 3D et 2D avec animation 3D (méthode de projection d’intensité maximale, mélange α). |
| Format d’image |
Format d’image OIR
Échelle de gris / indice 8/16 bits, couleur 24/32/48 bits, formats d’image JPEG / BMP / TIFF, format Olympus multi-tif. |
| Déconvolution spectrale | Modes de déconvolution spectrale à fluorescence (jusqu’à 16 canaux) |
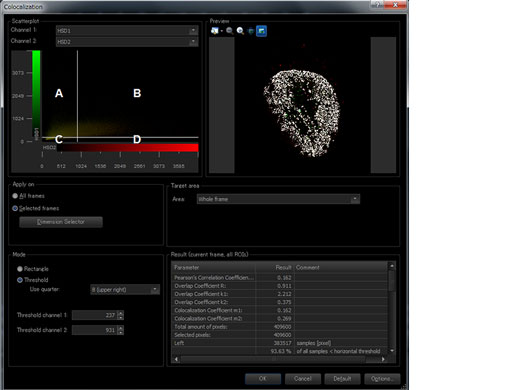
| Analyse d’images | Mesures linéaires et de région, tracé de l’intensité dans le temps/Z, analyse de colocalisation. |
| Traitement statistique | Affichage d’histogramme de données 2D. |
| Logiciels en option | Contrôle de platine motorisé |