Not Available in Your Country
Sorry, this page is not
available in your country.
Übersicht
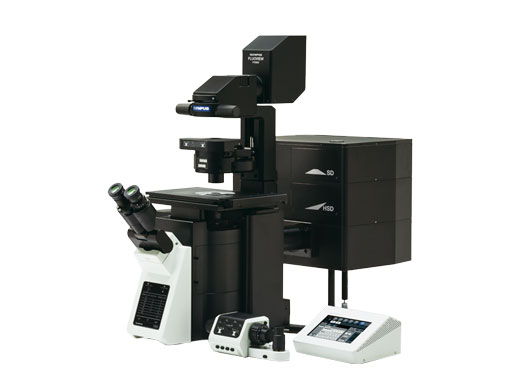
 | FLUOVIEW der nächsten Generation für die nächste Revolution in der WissenschaftMit den konfokalen Laser-Scanning-Mikroskopen der Serie FLUOVIEW FV3000 lassen sich einige der schwierigsten Herausforderungen in der modernen Wissenschaft meistern. Das FV3000 Konfokalmikroskop besitzt die hohe Empfindlichkeit und Geschwindigkeit, die für die Bildgebung von lebenden Zellen sowie für die Betrachtung tiefer Gewebeschichten erforderlich sind, und unterstützt eine breite Palette von Bildgebungsmodalitäten, beispielsweise Makro- und Mikro-Beobachtung, Mikroskopie mit Superauflösung und die quantitative Datenanalyse. |
|---|
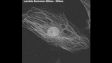
Hochempfindliches Bildmultiplexing von Violett bis NIR-LichtDie TruSpectral Detektoren des FV3000 Konfokalmikroskops kombinieren hohe Empfindlichkeit mit spektraler Flexibilität und erkennen so selbst schwächste Fluorophore.
Durch verschiedene sorgfältig entwickelte NIR-Upgrades vergrößert unsere neue FV3000 Lösung für Nah-Infrarot (NIR) die Wellenlängenerkennungsfähigkeiten des FV3000 Mikroskops bis 890 nm:
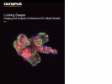
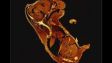
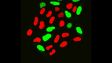
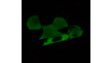
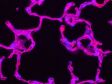
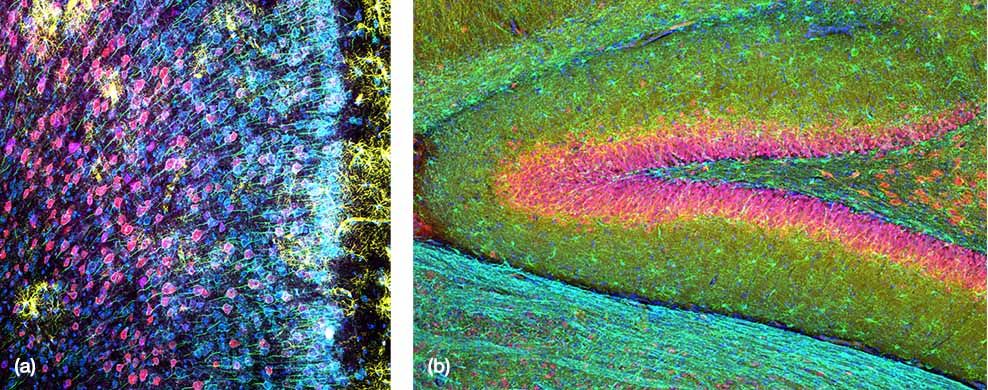
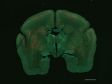
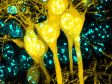
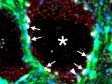
(a) Maus-mPFC mit Färbung des sauren Gliafaserproteins (GFAP; Astrozytenmarker; gelb), der Calmodulin-abhängigen Proteinkinase II (CaMKII; Pyramidenzellenmarker; rot), der Vorstufe des Amphoterin-induzierten-Proteins 1 (AMIGO-1; Marker für neuronale Membranen; cyan), von Parvalbumin (PV; Marker für inhibitorische Neuronen; violett), von Ankyrin-G (AnkG; Axon-Initialsegmentmarker; grün) und Nuclear Yellow (Marker für Zellkerne; blau). |
|---|
Makro- und Mikro-Beobachtung und Mikroskopie mit SuperauflösungDie Makro- und Mikro-Beobachtung des FV3000 ermöglichen eine Datenerfassung, bei der Sie die Daten im Kontext sehen und interessante Regionen für eine hochauflösende Bildgebung leicht lokalisieren können.
|
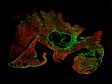
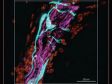
Eingebettete Maus-Hirnhälfte für die Expansionsmikroskopie (Prä-Expansion), markiert mit sekundären Antikörpern gegen GFP (Alexa Fluor 488, grün), SV2 (Alexa Fluor 565, rot), Homer (Alexa Fluor 647, blau). |
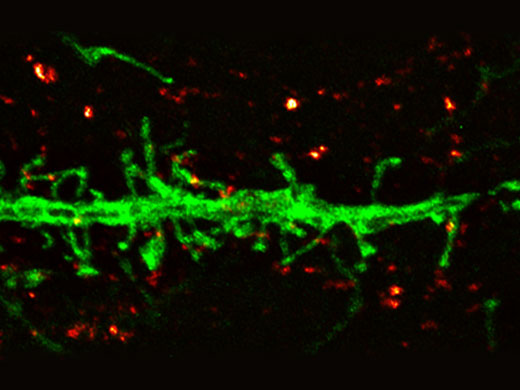
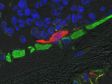
Dendriten (Anti-GFP Alexa Fluor 488, grün) und synaptischer Marker (SV2, Alexa Fluor 565, rot). Mit Olympus Super Resolution aufgenommenes Bild, Verarbeitung mit der eingeschränkten iterativen Dekonvolution von cellSens Durchschnittliche Messungen der Halbwertsbreite bei ~135 nm. Bild aufgenommen mit einem 100X 1,35 NA Silikonöl-Immersionsobjektiv. |
Hybrid-Scanning für Hochgeschwindigkeitsbildgebung und höhere ProduktivitätIm FV3000 Hybridscanner sind für erweiterte konfokale Bildgebungsfunktionen zwei Scanner in einem kombiniert.
| Related Videos |
|---|
Related Videos | Präzise ZeitrafferaufnahmenZeitraffer-Experimente erfordern einen konstanten Fokus und eine geringe Phototoxizität für die Probe.
|
|---|
Beobachtung tief liegender Gewebeschichten mit Silikonöl-ImmersionsobjektivenDer Brechungsindex von Silikonöl unterscheidet sich nur wenig von lebendem Gewebe und ermöglicht eine hochauflösende Beobachtung tief im Gewebe bei minimaler sphärischer Aberration.
| 3D-Bild eines Kükenziliarganglions nach Reinigung mit einem Gewebe-Reinigungsreagenz. |
|---|
Automatisierte Bildgebung von OrganoidenDer Arbeitsablauf für die Bildgebung von Organoiden kann von der Suche nach Zielobjekten bis zur Aufnahme hochauflösender 3D-Bilder sehr zeitaufwändig sein, insbesondere, wenn mehrere Wells einer Mikroplatte abgebildet werden. Das Makro-Mikro-Modul für das FV3000 System ist eine intelligente Lösung, die den Arbeitsablauf bei der Darstellung von Organoiden automatisiert und so die Effizienz der Bildgebung drastisch erhöht. Das FV3000 Mikroskop nimmt Bilder mit geringer Vergrößerung auf. Anschließend kann das Makro-Mikro-Softwaremodul automatisch die Objekte von Interesse im Behälter oder im Well lokalisieren und sie mit hoher Vergrößerung aufnehmen. Durch diesen automatisierten Prozess wird der Aufwand zur Bedienung des Mikroskops drastisch reduziert. |
|---|
|
Für Unterstützung
|
Angewandte Technologien
TruSpectral ErkennungDas bahnbrechende TruSpectral-Erkennungsverfahren liefert im Gegensatz zu früheren Generationen von Spektralerkennungseinheiten hervorragende Ergebnisse und kombiniert auf jedem Kanal des FV3000 die Flexibilität eines Spektraldetektors mit der Empfindlichkeit eines Filterdetektors. |
Related Videos |
|
|
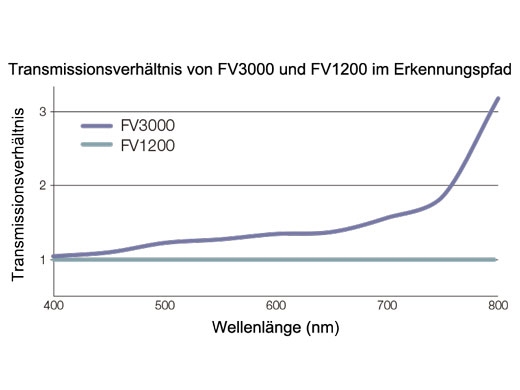
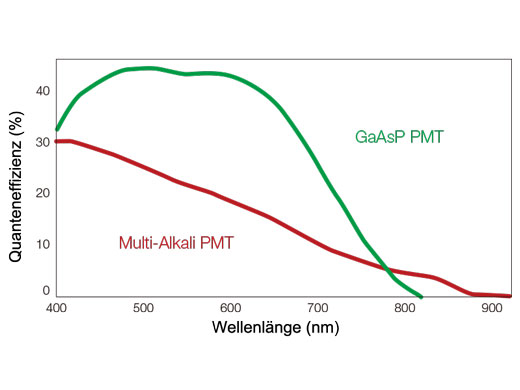
Funktionsweise des TruSpectral-ErkennungsverfahrensDie hohe Effizienz der TruSpectal-Erkennung wird durch die patentierte Volumenphasen-Hologrammübertragung (VPH) und den einstellbaren Spalt erreicht. Die Erkennungswellenlängen jedes einzelnen Kanals können bis auf 2 nm genau ausgewählt werden. | Empfindlichkeit und GenauigkeitDas in alle konfokalen Mikroskope FV3000 integrierte TruSpectral-Erkennungsverfahren ermöglicht einen deutlich höheren Lichtdurchsatz als herkömmliche spektrale Erkennungseinheiten: Das Volumenphasenhologramm beugt Licht mit bis zu dreifach höherer Transmissionseffizienz als Reflexionsgitter und liefert hervorragende mehrfarbige Fluoreszenzmikroskopiebilder von lebenden und fixierten Geweben. | Verbesserte QuanteneffizienzDie HSD-Einheit (für den hochempfindlichen Detektor) des Mikroskops FV3000 ermöglicht die Anzeige von Proben, deren Emissionen für konventionelle Detektoren zu schwach sind. Die HSD-Einheit verfügt über zwei GaAsP-Kanäle mit einer maximalen Quanteneffizienz von 45 % und Peltierkühlung, die das Hintergrundrauschen um 20 % reduziert. Dadurch lassen sich Bilder mit hohem Signal-Rausch-Abstand auch bei sehr geringem Anregungslicht erfassen. HSD-Einheiten können auch kombiniert werden, wenn eine Vierkanal-GaAsP-Bildgebung mit dem FV3000-System benötigt wird. |
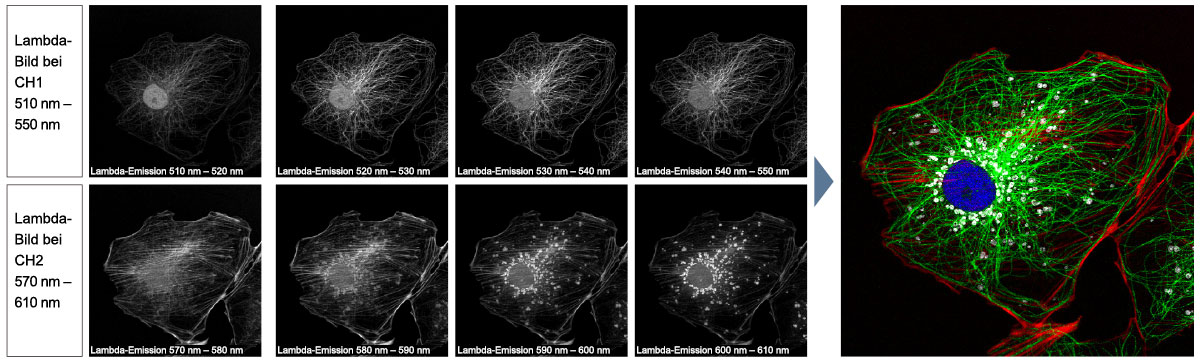
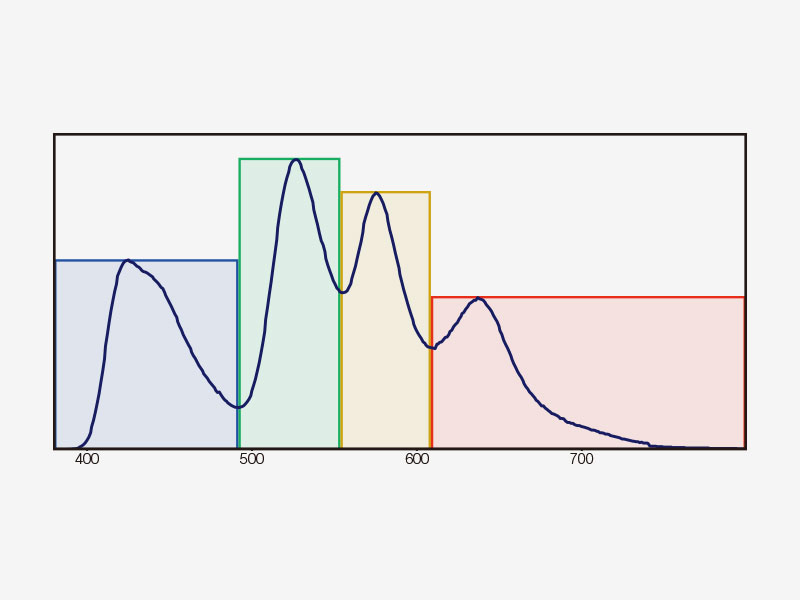 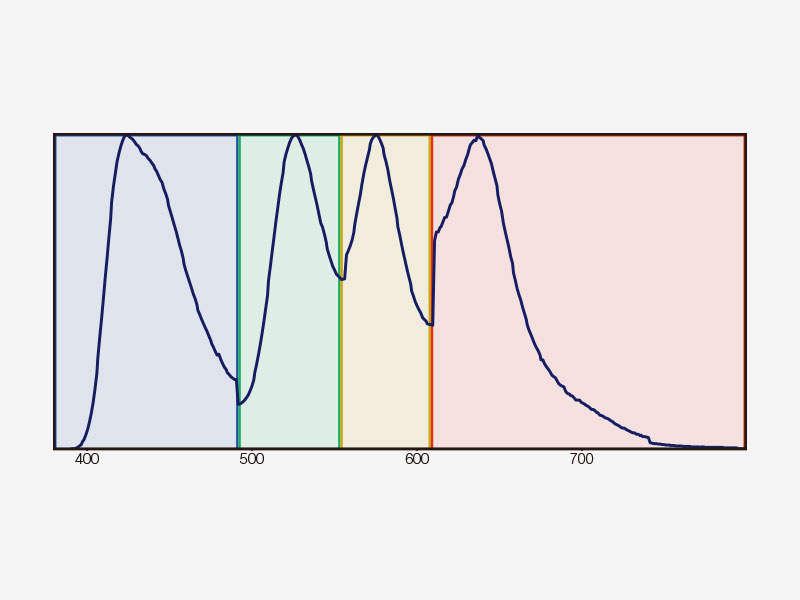 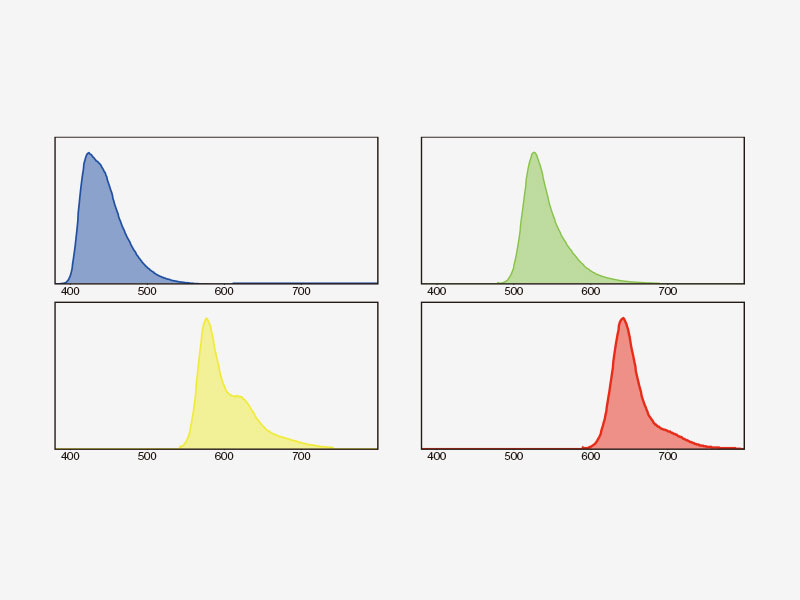 | Mehrkanalige TruSpectral-Erkennung mit 16-Kanal-EntmischungDie TruSpectral Erkennung arbeitet unabhängig auf allen Mikroskopkanälen und ermöglicht eine echte simultane mehrkanalige Lambda-Abtastung auf bis zu vier Kanälen. Der Mehrkanal-Lambdamodus liefert durch seine Spektralentmischung bei Live-Bildern und Bildnachbearbeitung hervorragende spektrale Separationsergebnisse. Mit bis zu vier Dynamikbereichen lassen sich Helligkeit und Dimmersignale durch unabhängige Anpassung der Empfindlichkeit jedes Detektors optimal trennen. |
|---|
Spektrale EntmischungMit dem spektralen Dekonvolutionsalgorithmus des FV3000 können sich überlappende Spektren anhand der Spektralinformationen aus Lambda-Stapelbildern getrennt und gegenseitige Fluoreszenzstörungen zwischen den Kanälen durch den Entmischungsalgorithmus sowohl bei der Live-Bildaufnahme als auch bei der Nachbearbeitung eliminiert werden, sodass eine saubere Trennung von bis zu sechzehn Fluorophoren möglich ist. |
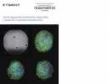
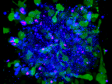
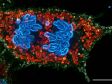
Spektrale Entmischung einer PtK2-Zelle, die mit YOYO-1, Alexa Fluor 488, Rhodamin-Phalloidin und MitoTracker Red markiert ist, in einem Mehrkanal-Lambda-Stapelbild. |
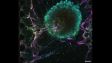
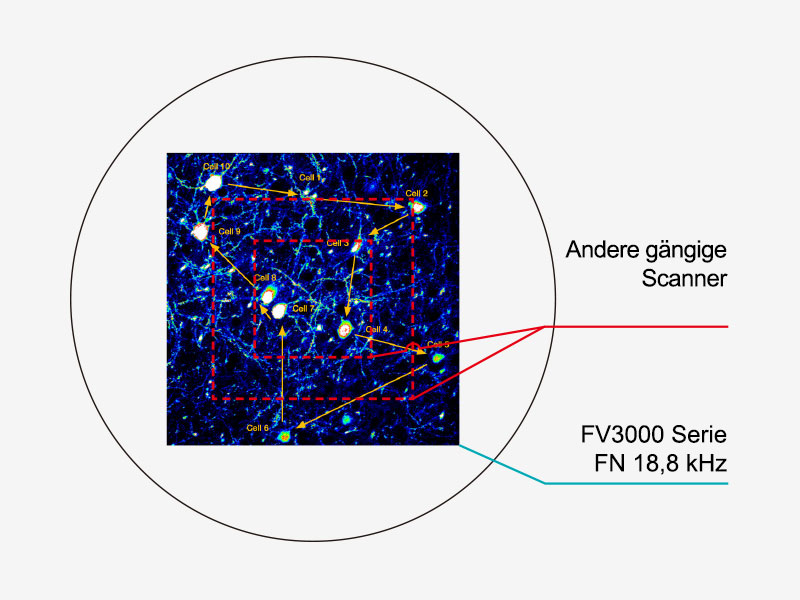 An eine Thrombose im Blutgefäß einer Maus gebundene Thrombozyten: Die Bilder wurden mit 30 fps im Vollbildmodus von einem Resonanzscanner mit 2 CH GaAsP PMTs aufgenommen. | Zwei ScanneroptionenWählen Sie zwischen zwei Scannereinheiten: einem herkömmlichen Galvanometerscanner (FV3000) und einem Hybrid-Galvanometer/Resonanzscanner (FV3000RS).
Keine Kompromisse zwischen Geschwindigkeit und SichtfeldViele Hochgeschwindigkeits-Abtastverfahren beschränken das Sichtfeld und erschweren damit die Untersuchung großer Areale mit mehreren Zellen. Der Resonanzscanner des Mikroskops FV3000RS behält mit FN 18 auch bei einer Videorate von 30 Bildern pro Sekunde ein volles 1X-Sichtfeld bei und ermöglicht durch Anpassung der Y-Achse Aufnahmegeschwindigkeiten von bis zu 438 Bildern pro Sekunde. |
|---|
Verarbeitung unter Verwendung des gleitenden MittelwertsDie Hochgeschwindigkeitsabtastung mit geringer Laserleistung minimiert zwar die Fototoxizität, verringert aber oft den Signal-Rausch-Abstand, was die Aufnahme hochauflösender Zeitraffer-Bilder erschwert. Mit der Verarbeitung unter Verwendung des gleitenden Mittelwerts können Sie Hochgeschwindigkeits-Zeitraffer-Bilder anpassen und bessere Signal-Rausch-Abstände erzielen, ohne die Zeitskala oder die Originaldaten zu verändern. |
(Rechts) Verarbeitung unter Verwendung des gleitenden Mittelwerts (10 Einzelbilder) bei Daten mit 30 fps, die mit geringer Laserleistung erfasst wurden. |
|---|
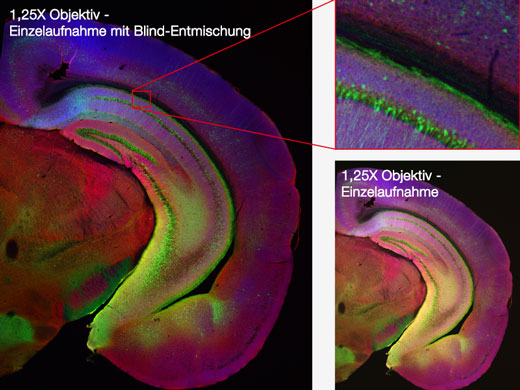
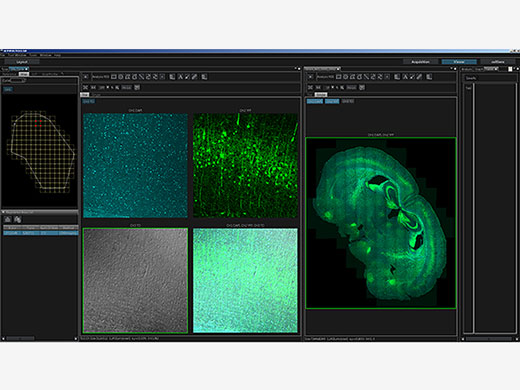 | Makro- und Mikro-BeobachtungSiehe dazu die Daten zur Makro- und Mikro-Beobachtung. Mit dem überarbeiteten Lichtweg des FV3000 erzeugen Sie detaillierte Übersichtsbilder mit Vergrößerungen von bis zu 1,25X, und erkennen mühelos auch solche Strukturen, zu deren Darstellung eigentlich eine höhere Vergrößerung erforderlich ist. Mit der Mosaikbildgebung können Sie kontinuierlich 3D- (XYZ) und 4D-Bilder (XYZT) von angrenzenden Sichtfeldern aufnehmen. Der gesamte Prozess von der Bilderfassung bis zum Stitching kann vollständig automatisiert werden, was Zeit spart und aussagekräftigere Daten erzeugt. |
|---|
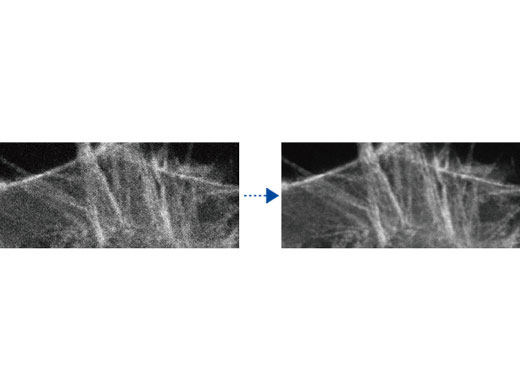
TruSight Dekonvolution: Bildverarbeitung für höhere AuflösungEntfernen Sie Unschärfen und erhalten Sie klarere, schärfere Bilder mit der TruSight-Dekonvolution. Spezielle cellSens-Algorithmen für das konfokale Mikroskop FV3000 ermöglichen einen nahtlosen Workflow von der Aufnahme bis zur Veröffentlichung per Tastendruck. Noch schnellere Ergebnisse erhalten Sie durch die GPU-Verarbeitung. | 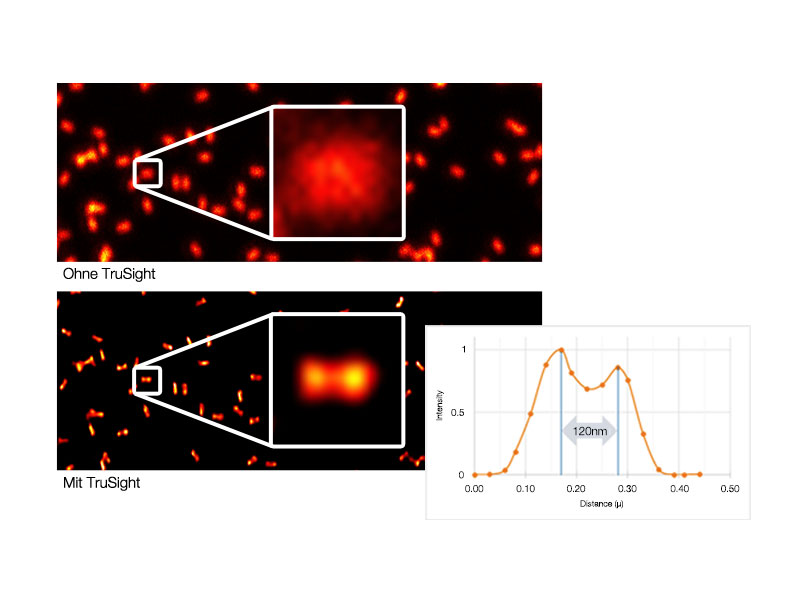  Links: Konfokales Rohbild/Rechts: Bild mit TruSight |
|---|
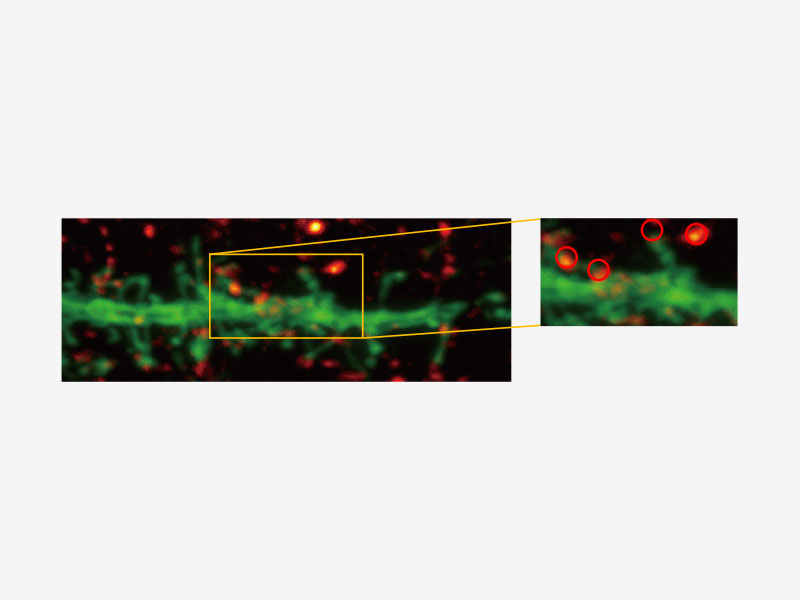 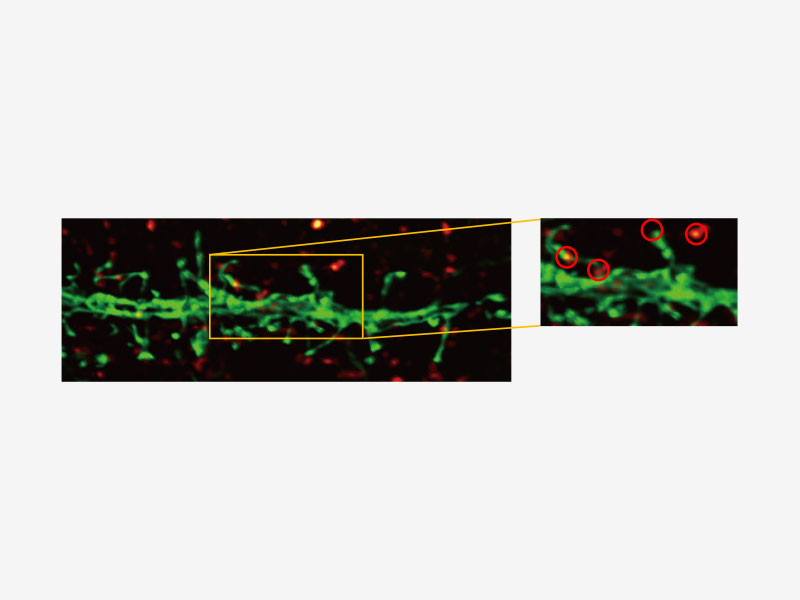 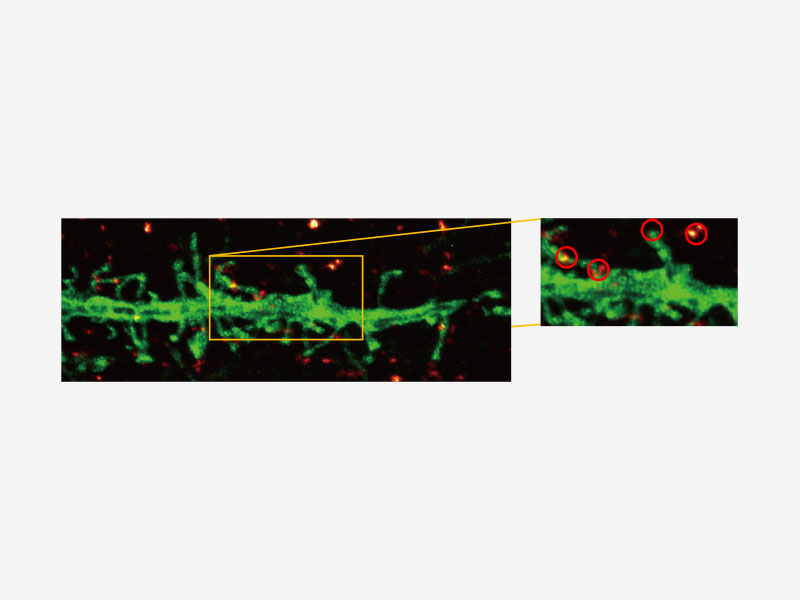 | Olympus Super Resolution (FV-OSR) Technologie mit bis zu vier simultanen KanälenDas für die Kolokalisationsanalyse geeignete Super Resolution-Bildmodul von Olympus kann vier Fluoreszenzsignale entweder sequentiell oder gleichzeitig mit einer Auflösung von ca. 120 nm erfassen und damit die Auflösung typischer Konfokalmikroskope nahezu verdoppeln.
Erfahren Sie mehr über das Super Resolution-Softwaremodul des FV3000 |
|---|
TruFocus-Zeitraffer-BildgebungDie TruFocus Technologie macht Multipositionsexperimente und Langzeit-Zeitrafferbildgebung robuster und zuverlässiger. Sie bestimmt mit einem minimal fototoxischen Infrarotlaser (Klasse 1) die Probenebene und bietet zwei Modi zur Aufrechterhaltung der Fokussierung.
| Related Videos |
|---|
 Konventionelle Objektive (links) und X Line Objektive (rechts) | Leistungsstarke mikroskopische Bildgebung mit X-Line ObjektivenMit ihrer breiten chromatischen Aberrationskorrektur, gleichmäßigen Bildern und der hohen numerischen Apertur verbessern die X-Line-Objektive die Bildqualität des konfokalen Mikroskops FV3000. |
|---|
Beobachtung tief liegender Gewebeschichten mit Silikonöl-ImmersionsobjektivenOlympus bietet vier Silikonöl-Immersionsobjektive mit hohem NA-Wert an, die sich hervorragend zur Bildgebung von lebenden Zellen eignen.
| Related Videos |
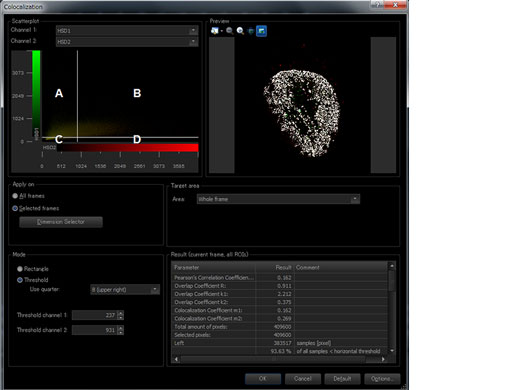
 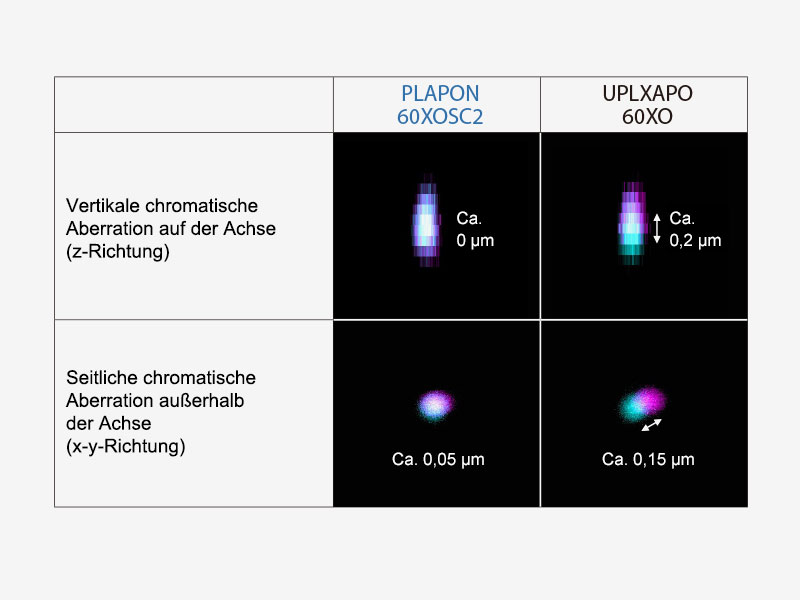 | Verbessern Sie die Zuverlässigkeit der Kolokalisationsanalyse mit einem Objektiv mit geringer chromatischer Aberration (PLAPON60XOSC2)Dieses Silikonöl-Immersionsobjektiv minimiert die laterale und axiale chromatische Aberration im Bereich von 405–650 nm, ermöglicht die zuverlässig Aufnahme von Kolokalisationsbildern, die positionsgenaue Messung von Objekten sowie die Kompensation der chromatischen Aberration im nahen Infrarotbereich (bis 850 nm) und eignet sich daher ideal für die quantitative Mikroskopie.
|
|---|
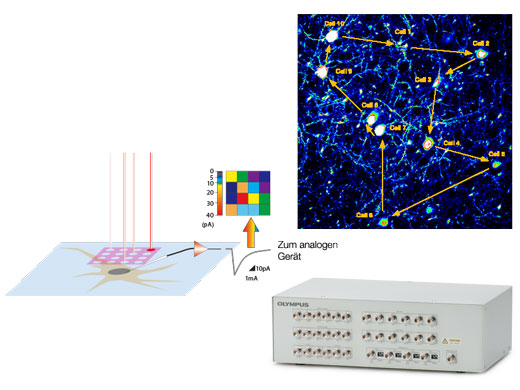
Optimierte Konfigurationen für elektrophysiologische ExperimenteSynchronisieren Sie konfokale Bildgebungsereignisse mit elektrophysiologischen Geräten über die Triggersignal-I/O-Anschlussbox. Die I/O-Anschlussbox wandelt auch Spannungssignale in Bilder um, die genauso verarbeitet werden können wie Fluoreszenzbilder. Auf diese Weise können Sie spannungsabhängige Bilder synchron zur Fotostimulation mit dem konfokalen Scanner aufnehmen. |
Für Unterstützung |
Software
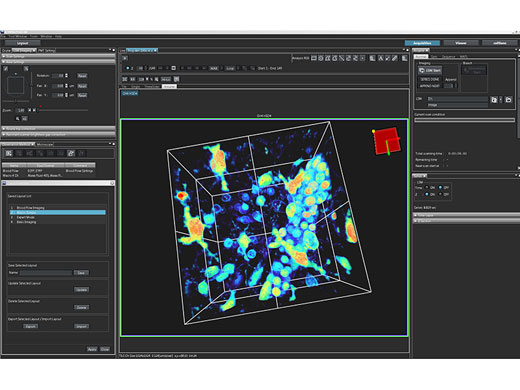
Intuitive SoftwareDie FV3000-Software rationalisiert den gesamten Workflow der konfokalen Bildgebung von der Erfassung bis zur Analyse: Individuell anpassbare und speicherbare Layouts erleichtern die Anpassung der Benutzeroberfläche an Ihren Workflow und Ihre Experimente unabhängig vom Grad der Komplexität. |
|
|---|
Echtzeit-3D-Rendering und AnalyseMit der Echtzeit-3D-Bildanzeigefunktion der FV3000 Software können Sie Ihre Daten in Echtzeit sehen. 3D-Bilder können während der Bilderfassung erstellt und als Echtzeit-Bilder angezeigt werden. Mit der optionalen NoviSight Software sind zusätzlich 3D-Zellanalysen möglich. Nutzen Sie die leistungsstarken Softwarefunktionen zur Quantifizierung von Sphäroidzellen oder anderen 3D-Objekten für Untersuchungen auf Mikrotiterplatten. |
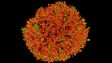
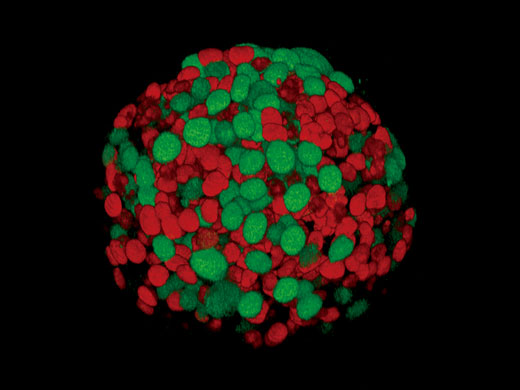
Fucci-induziertes Sphäroid der HT29-Zelllinie |
Mit der optionalen NoviSight Software lassen sich verschiedene 3D-Zellanalysen durchführen. |
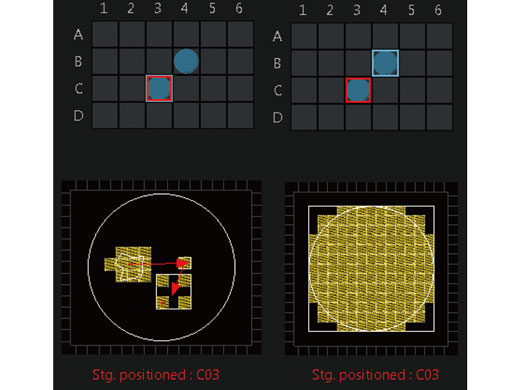
Zeitraffer für mehrere Bereiche und Mikrotiterplatten-BildgebungDas Zeitraffer-Modul für mehrere Bereiche (Multi-Area Time-Lapse - MATL) liefert robuste und genaue Zeitrafferdaten durch präzise Steuerung der motorisierten Tischbewegungen, sodass Sie detaillierte Übersichtsmikroskopbilder erzeugen können, um Daten im Kontext zu sehen. Kombinieren Sie das MATL-Modul mit dem Mikrotiterplatten-Navigatormodul, um durch die moderne, intuitive Steuerung eine erweiterte Funktionalität für diverse Zellkulturgefäße und kundenspezifische Mikrotiterplatten zu erreichen. |
|
|---|
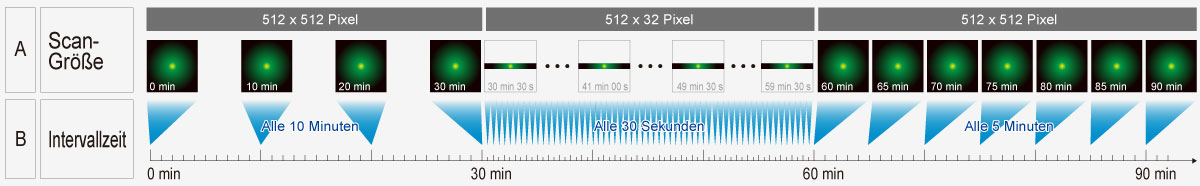
Reduzieren Sie Komplexität mit dem Sequence Manager.Das Sequence Manager Softwaremodul verarbeitet problemlos komplexe Protokolle: Mehrtägige Zeitraffer-Experimente werden mikrosekundengenau abgetastet und Sequenzen millisekundengenau ausgeführt. Es lassen sich verschiedene komplexe Protokolle ausführen, beispielsweise:
|
 |
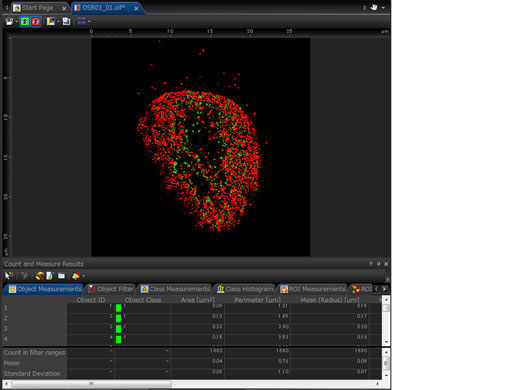
Quantitative Mikroskopie-BildanalyseDas konfokale Mikroskop FV3000 verfügt über eine Reihe optionaler Analysefunktionen, die Ihren Workflow bei der Bildverarbeitung ergänzen und quantitative Daten liefern.
|
Zählen und Messen |
|
FRET- und FRAP-ExperimenteDas Mikroskop FV3000 ermöglicht in Verbindung mit dem cellSens Life Science Analysemodul eine einfache Erfassung und Analyse von FRET- und FRAP-Experimenten.
|
| 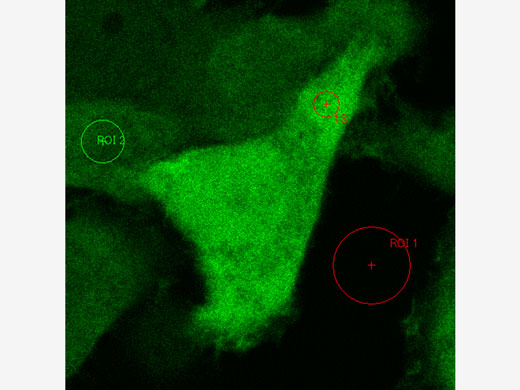 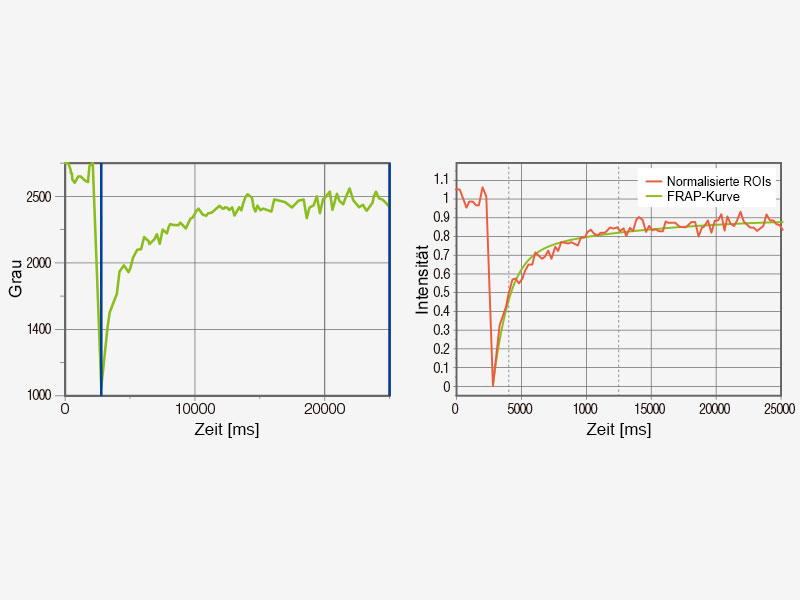 |
Beispiel für eine FRET-Analyse (Akzeptor-Fotobleiche) | Beispiel für eine FRAP-Analyse |
Fluoreszenzverhältnis-Bildgebung und intensitätsmodulierte Darstellung (IMD)Die Analysesoftware für die Fluoreszenzverhältnis-Bildgebung des FV3000-Mikroskops enthält eine Funktion zur intensitätsmodulierten Darstellung (IMD) quantitativer Fluoreszenzverhältnisänderungen sowohl bei Standard- als auch bei Hochgeschwindigkeitsaufnahmen, insbesondere bei der Calcium- und FRET-Bildgebung, wenn der Kontrast in Hintergrundbereichen bei bloßer Anzeige des Fluoreszenzverhältnisses unzureichend ist. |
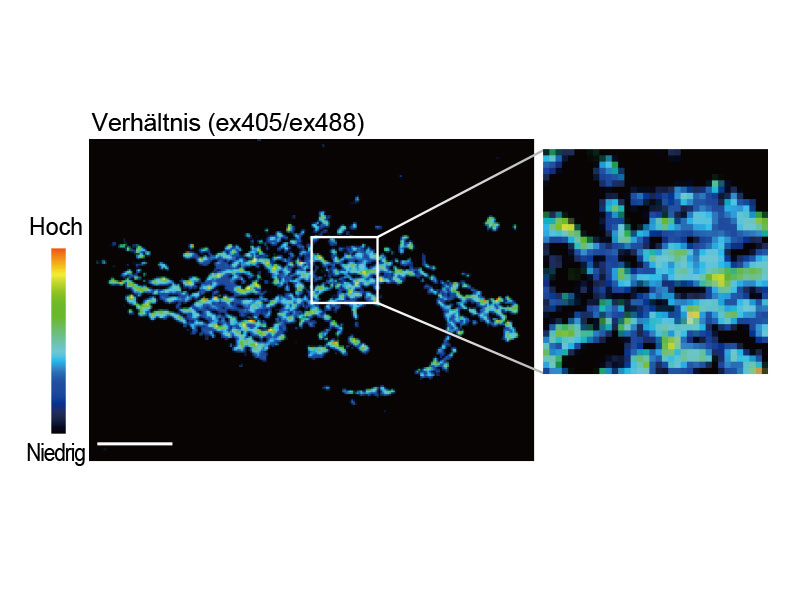 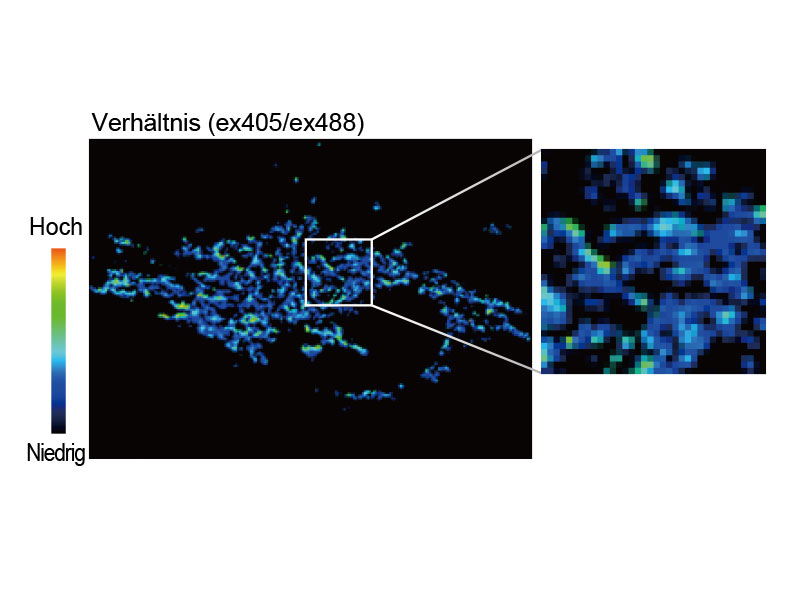 tsGFP1-mito zeigt die Heterogenität der mitochondrialen Thermogenese in HeLa-Zellen. | 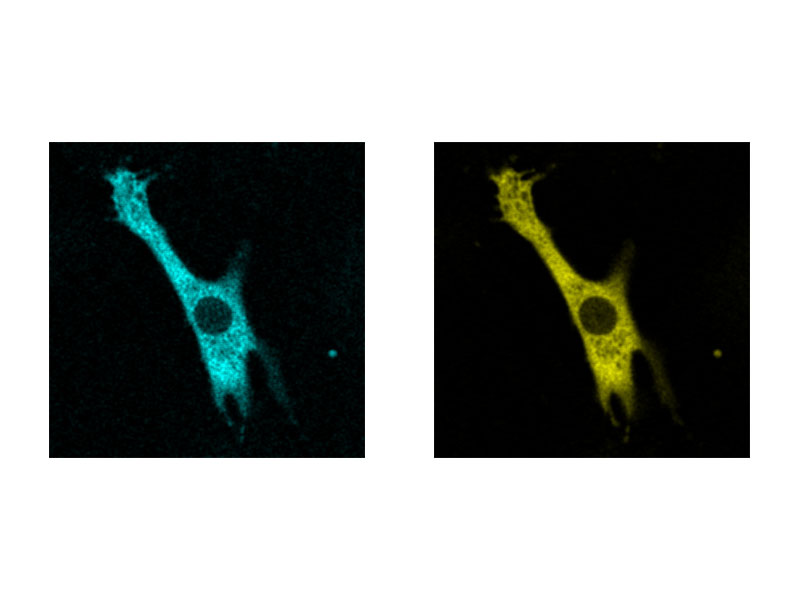 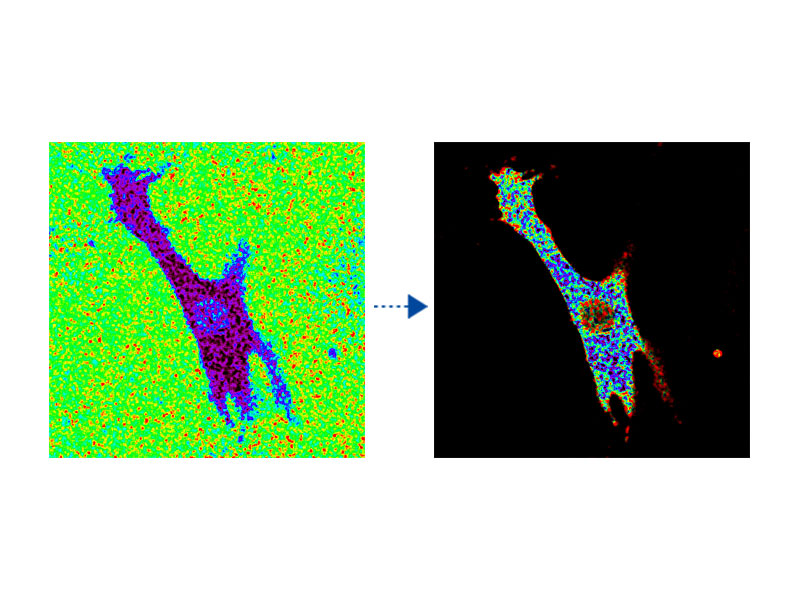 Herzmuskelzelle |
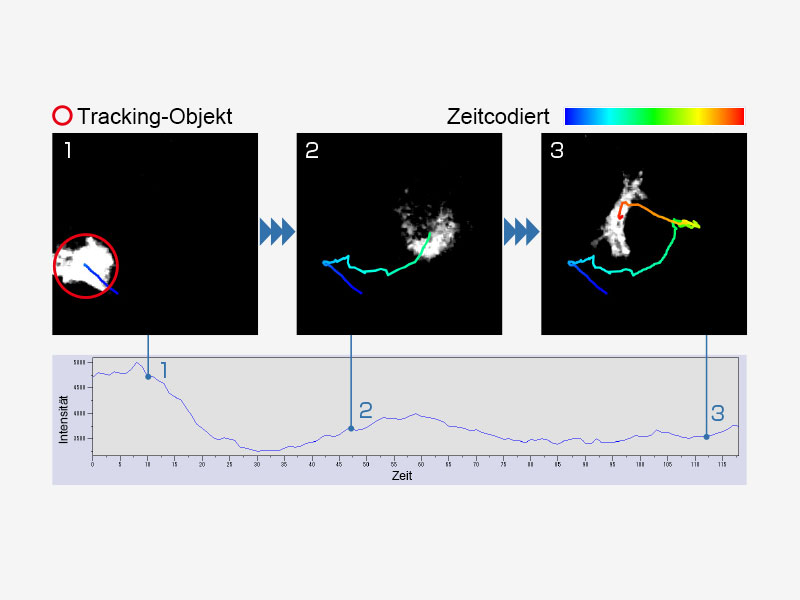 Biolumineszenz von RA-induzierten, sich differenzierenden Zellen an Tag 12 aus mit Bmal1:luc stabil transfizierten ES-Zellen | ObjektverfolgungAutomatische Erkennung, Verfolgung und Analyse bewegter Objekte in Zeitrafferbildern mit dem cellSens Object Tracking-Modul. Mit der Tracking-Funktion steht ein leistungsstarkes und intuitives Tool zur Quantifizierung dynamischer Prozesse wie Zellbewegung und -teilung zur Verfügung. |
|---|
Development Kit für Fernsteuerung (RDK)Das Development Kit ermöglicht die Fernsteuerung und Programmierung bestimmter Mikroskopfunktionen des FV3000 in Sprachen wie Python, C++ und Matlab. Das RDK-Modul ist ein leistungsstarkes Tool für Anwender mit Programmiererfahrung, die das volle Potenzial des Systems erschließen möchten. | 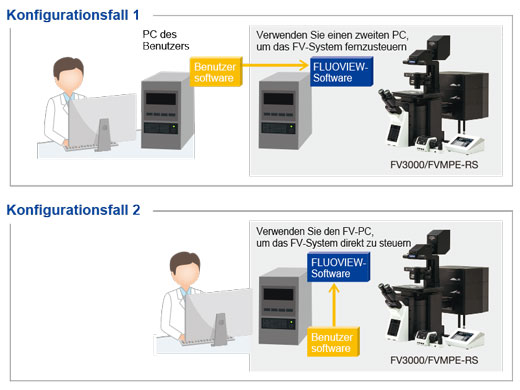 |
|---|
* Obwohl sie zu einer der wichtigsten Zelllinien in der medizinischen Forschung wurde, müssen wir unbedingt anerkennen, dass Henrietta Lacks Beitrag zur Wissenschaft ohne ihre Zustimmung erfolgte. Diese Ungerechtigkeit führte nicht nur zu wichtigen Entdeckungen in der Immunologie, bei Infektionskrankheiten und Krebs, sondern warf auch wichtige Diskussionen über Datenschutz, Ethik und Einwilligung in der Medizin auf. |
Für Unterstützung |
Konfigurationen
Wählen Sie die Konfiguration, die zu Ihrer Anwendung passt |
Inversmikroskop
|
Aufrechtes Mikroskop (konfiguriert für Objektträgeraufnahmen)
|
Aufrechtes Mikroskop (konfiguriert für die Elektrophysiologie)
|
Komponenten FV3000 Hauptlaser-Strahlkombinierer und Sublaser-Strahlkombinierer
FV3000 Hauptlaser-Strahlkombinierer und Sublaser-StrahlkombiniererFLUOVIEW Lösungen für Laser-Scanning-Mikroskope  FV3000 Hochempfindlicher Spektraldetektor
FV3000 Hochempfindlicher SpektraldetektorFLUOVIEW Lösungen für Laser-Scanning-Mikroskope SoftwareFV3000 Development Kit für FernsteuerungFLUOVIEW Lösungen für Laser-Scanning-Mikroskope FV3000 Mehrpunkt- und Mapping-SoftwaremodulFLUOVIEW Lösungen für Laser-Scanning-Mikroskope  FV3000 Zeitraffer-Softwaremodul für mehrere Bereiche
FV3000 Zeitraffer-Softwaremodul für mehrere BereicheFLUOVIEW Lösungen für Laser-Scanning-Mikroskope  NoviSight Die 3D-Zellanalyse-Software NoviSight liefert statistische Daten für Sphäroide und 3D-Objekte in Mikrotiterplatten-Experimenten. Damit lassen sich die Zellaktivität in 3D quantifizieren und die Nachweisempfindlichkeit verbessern, seltene Zellereignisse können leichter erfasst und Zellzahlen genauer bestimmt werden. Die NoviSight Software ist für verschiedene Bildgebungsverfahren geeignet, d. h. von der konfokalen Point-Scan-Bildgebung, der Zwei-Photonen-Bildgebung und der konfokalen Spinning-Disk-Bildgebung bis hin zur hochauflösenden Lebendzell-Bildgebung.
Scanners |
Spezifikationen
| FV3000 | FV3000RS | ||
|---|---|---|---|
| Hauptlaser-Strahlkombinierer | Laser im Bereich des sichtbaren Lichts |
405 nm: 50 mW, 488 nm: 20 mW, 561 nm: 20 mW, 640 nm: 40 mW
Ein optionaler Laseranschluss für den Sublaser-Strahlkombinierer oder eine optionale Lasereinheit | |
| Optionaler Laser | Sublaser-Kombieinheit |
Maximal 3 Lasereinheiten wie folgt:
445 nm: 75 mW, 514 nm: 40 mW, 594 nm: 20 mW, Faser verbunden mit dem Hauptlaser-Strahlkombinierer | |
| Einzelne Lasereinheit | 445 nm: 75 mW, 514 nm: 40 mW oder 594 nm: 20 mW, direkt mit dem Hauptlaser-Strahlkombinierer verbunden | ||
| Eine NIR-Lasereinheit | 730 nm: 30 mW, 785 nm: 100 mW, über optionalen Port mit Scanner verbunden | ||
| Scanner | Scan-Methode | 2 silberbeschichtete Galvanometer-Scannerspiegel |
2 silberbeschichtete Galvanometer-Scannerspiegel
1 silberbeschichteter Resonanz- und 1 silberbeschichteter Galvanometer-Scannerspiegel |
|
Galvanometer-Scanner
(Normale Bildgebung) |
Scan-Auflösung: 64 × 64 bis 4096 × 4096 Pixel
Scangeschwindigkeit (eine Richtung): 512 × 512 mit 1,1 s – 264 s. Pixelzeit: 2 µs – 1000 µs Scangeschwindigkeit (hin und zurück): 512 × 512 mit 63 ms – 250 ms, 256 × 256 mit 16 ms – 125 ms Optischer Zoom: 1X bis 50X in Schritten von 0,01X Scan-Rotation: freie Rotation (360 Grad) in Schritten von 0,1 Grad Scan-Modus: PT, XT, XZ, XY, XZT, XYT, XYZ, XYλ, XYZT, XYλT, XYλZ, XYλZT ROI-Scanning, Rechteckclip, Ellipse, Polygon, freier Bereich, Linie, freie Linie und Punkt, Tornado-Modus nur zur Stimulation | ||
|
Resonanz-Scanner
(Hochgeschwindigkeitsbildgebung) | - |
Scan-Auflösung: 512 × 32 bis 512 × 512 Pixel
Scangeschwindigkeit: 30 F/s bei 512 × 512, 438 F/s bei 512 x 32 Optischer Zoom: 1X bis 8X in Schritten von 0,01X Scan-Modus: XT, XZ, XY, XZT, XYT, XYZ, XYλ, XYZT, XYλT, XYZ, XYλZT ROI-Scannen, Rechteck-Clip, Linie | |
| Lochblende | Einzelne motorisierte Lochblende, Lochblendendurchmesser ø 50 – 800 µm (in Schritten von 1 µm) | ||
| Sehfeldzahl (FN) | 18 | ||
| Dichroitisches Spiegelmodul (DM) | 8 Positionen (Hochleistungs-DMs und 10/90-Spiegel) | ||
| Optionale Einheit für Scanner | Laserleistungsüberwachung, optionaler Laseranschluss | ||
| Spektraler Detektor | Detektormodul | Gekühlter GaAsP-Photomultiplier (hochempfindlich) oder Multi-Alkali-Photomultiplier, 2 Kanäle | |
| Spektralverfahren |
Motorgesteuertes, holografisches Volumenphasen-Beugungsgitter mit motorgesteuertem verstellbarem Spalt,
wählbare Wellenlängenbandbreite: 1–100 nm, Wellenlängenauflösung: 2 nm | ||
| Dichroitisches Spiegelmodul (DM) | 8 Positionen (Hochleistungs-DMs und Spiegel) | ||
| NIR-Detektor | Detektormodul | GaAs-Photomultiplier-Röhre, 1 Kanal oder 2 Kanäle mit Filterwürfel | |
| Fluoreszenz-Beleuchtungseinheit | Externe Fluoreszenzlichtquelle, Faseradapter für den optischen Anschluss der Abtasteinheit, motorisiertes Umschalten zwischen LSM-Lichtweg und Fluoreszenzbeleuchtung | ||
| Durchlicht-Detektoreinheit | Modul mit integriertem externen Durchlicht-Fotovervielfacher-Detektor und LED-Lampe, motorgesteuertes Umschalten | ||
Mikroskop |
| Inverses Stativ | Aufrechtes Stativ (für die Bildgebung) | Aufrechtes Stativ (für die Elektrophysiologie) | |
|---|---|---|---|
| Mikroskopstativ |
Motorgesteuertes inverses Mikroskop
IX83 (IX83P2ZF) |
Motorgesteuertes aufrechtes Mikroskop mit festem Tisch
BX63L |
Motorgesteuertes aufrechtes Mikroskop mit festem Tisch
BX63L |
| Objektivrevolver | Motorgesteuerter Sechsfach-Objektivrevolver | Motorgesteuerter Siebenfach-Objektivrevolver |
Codierter Schwenkrevolver
Codierter Schieberrevolver |
| Kondensor | Motorgesteuerter Kondensor mit großem Arbeitsabstand | Motorgesteuerter Universalkondensor | Manuell verstellbarer Kondensor mit großem Arbeitsabstand |
| Fokussierungshub |
Eingebauter motorgesteuerter Objektivrevolverfokus
Hub: kleinste Schrittweite: 0,01 μm | ||
Software |
| Grundfunktionen |
Benutzerschnittstelle für Dunkelkammerumgebung ausgelegt. Vom Anwender veränderbares Layout.
Ladefunktionen für Aufnahmeparameter. Festplattenaufzeichnung möglich, Anpassung der Laserleistung und HV bei Z-Stapelerfassung. Z-Stapel mit Alpha-Blending, Projektion mit maximaler Helligkeit, ISO-Oberflächen-Rendering. |
|---|---|
| 2D-Bilddarstellung | Jede Bildanzeige: Einzelkanal nebeneinander, Zusammenfügen, Ausschneiden, Live-Kacheln, Live-Kachel, Serie (Z/T/λ), LUT: individuelle Farbeinstellung, Falschfarbe, Kommentar: Grafik- und Texteingabe. |
| 3D-Visualisierung und -Beobachtung |
Interaktives Volumen-Rendering: Volumen-Rendering-Anzeige, Projektionsanzeige, Animationsanzeige.
3D-Animation (Projektionsverfahren mit maximaler Intensität, α-Blending) 3D- und 2D-Sequenzbetriebsfunktion. |
| Bildformat |
OIR-Bildformat
8/16-Bit Graustufen-/Indexfarbe, 24/32/48-Bit-Farbe, JPEG/BMP/TIFF-Bildfunktionen, Olympus Multi-TIF-Format. |
| Spektrale Entmischung | Fluoreszenzspektrum-Entmischungsmodi (bis zu 16 Kanäle) |
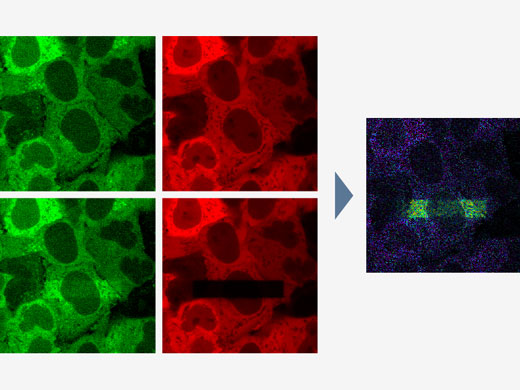
| Bildanalyse | Bereichs- und Linienmessungen, Intensitätsplot über Zeit/Z, Kolokalisierungsanalyse. |
| Statistische Verarbeitung | 2D-Daten-Histogrammanzeige |
| Optionale Software | Motorsteuerung des Tisches |
Multimedia
Anwendungshinweis
Blog
Dokumentationen
Broschüren
Infografiken
Bedienungsanleitungen
Videos
Webinar
Whitepaper
References List |
























![4 Schritte für eine erfolgreiche Rückkehr ins Labor [+ kostenlose Anleitung zur Fehlerbehebung]](https://static2.olympus-lifescience.com/modules/imageresizer/b63/12d/c104e94569/112x84p336x252.jpg)