Beurteilung von Anti-Krebswirkstoffen an 3D-Krebssphäroiden mithilfe eines bildgebungsbasierten Arbeitsablaufs
Bei der Prüfung von Wirkstoffen an individuellen Organismen wie Menschen und Versuchstieren werden die Messwerte von verschiedenen Faktoren wie Alter und Wachstumsumgebung beeinflusst. Dies erschwert die statistische Analyse von Daten aus mehreren Proben.
3D-Zellkulturmodelle wie Organoide und Sphäroide spiegeln die Struktur und Funktion eines Organs oder Gewebes in vivo genau wider. Sie lassen sich in vitro in Massenkultur anzüchten und sind somit in hohem Maß reproduzierbar, was die statistische Datenanalyse erleichtert. Zudem spiegeln sie die zelluläre Heterogenität in einem Tumor wider, sodass sie für die zellbasierte Wirkstoffbeurteilung gut geeignet sind.
Der Arbeitsablauf zur Wirkstoffbeurteilung mithilfe eines 3D-zellbasierten Assays lässt sich in die folgenden drei Prozesse unterteilen (Abbildung 1):
- Vorbereitung, Anzucht und Behandlung des 3D-zellbasierten Kulturmodells
- Aufnahme von Bildern der Zellen
- Durchführung der statistischen Analyse
In diesem Anwendungshinweis wird ein bildgebungsbasierter Arbeitsablauf für die einzelnen Prozesse vorgestellt. Anhand eines Assays zur Quantifizierung wirkstoffinduzierter Schäden an 3D-Krebssphäroiden auf zellulärer Ebene werden wir die Vorgehensweise Schritt für Schritt erläutern.
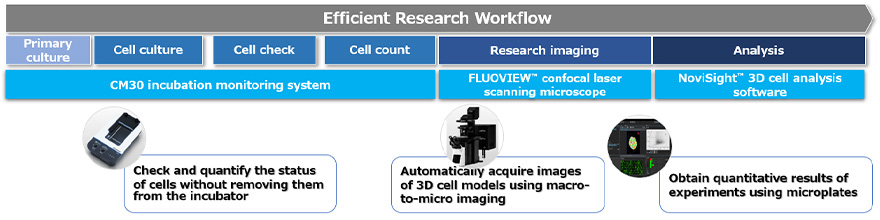
Abbildung 1. Bildgebungsbasierter Arbeitsablauf für 3D-Zellkulturmodelle mit Technologien von Evident.
1. Vorbereitung der 3D-Krebssphäroide (Vorkultur)
Krebssphäroide können die zelluläre Mikroumgebung in Tumoren in vivo sehr gut nachbilden und werden daher häufig in Screening-Assays von Anti-Krebswirkstoffen eingesetzt. Ihre Herstellung erfolgt durch Kultivierung von Krebszellen in einem halbkugelförmigen Zellkulturgefäß mit geringer Adhäsion.
Für diese Wirkstoffbeurteilung haben wir Krebssphäroide mit einer Größe von mindestens 600 µm gezüchtet und dabei das CM30 Inkubationsüberwachungssystem verwendet. Dieses System ermöglicht die Langzeitüberwachung von Zellen und die Nachverfolgung des Zellkulturstatus, ohne dass die Zellkulturen aus dem Inkubator genommen werden müssen.
Für die Herstellung der Krebssphäroide wurden MCF-7-Brustkrebszellen in U-förmige 96-Well-Platten mit geringer Adhäsion in einer Dichte von 2.000 Zellen/Well ausgesät. Direkt im Anschluss an das Aussäen der Zellen wurde die Mikrotiterplatte in das CM30 System gestellt und das System in einen CO2-Inkubator gestellt. Mithilfe des CM30 Systems ließ sich beobachten, wie die dispergierten MCF-7-Zellen Sphäroide bildeten, die sich allmählich
vergrößerten (Abbildung 2).
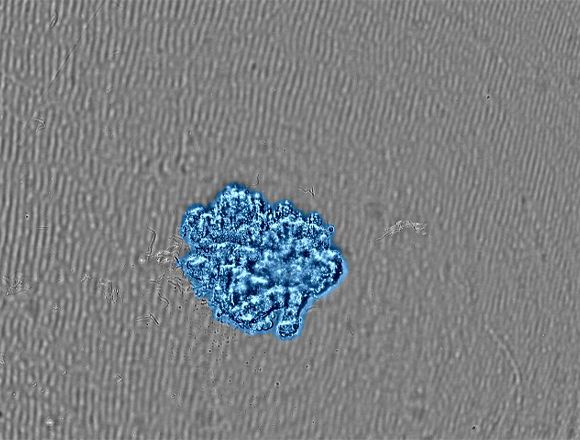
Related VideosAbbildung 2. (a) Zeitrafferaufnahmen der Sphäroidbildung. |
(b) Bild des auf die Zielgröße gewachsenen Sphäroids. Eine Konfluenzmaske zeigt die erkannten Zellen in Blau. |
Das CM30 System erkannte die Sphäroidfläche durch Anwendung der Funktion zur Messung der Konfluenz automatisch. Diese Funktion berechnet die Konfluenz als Verhältnis zwischen der von Zellen belegten Fläche und der Fläche des gesamten Bildes. Abbildung 3 zeigt die Veränderungen der Fläche der MCF-7-Sphäroide über sieben Tage.
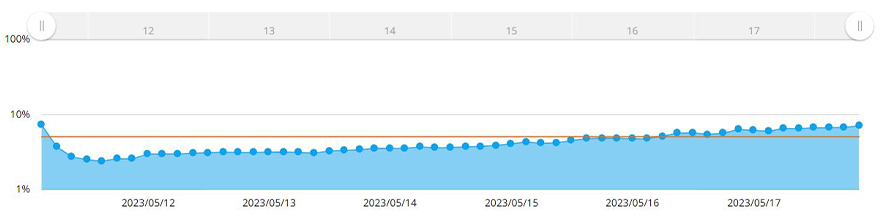
Abbildung 3. Veränderung der Sphäroidgröße über sieben Tage. Die gelbe Linie ist das im System festgelegte Konfluenzziel.
Sobald die Konfluenz 5 % der aufgenommenen Bildfläche erreicht hatte, führte die Software eine Messung der Sphäroidfläche durch. Hier wurde festgelegt, dass der Sphäroiddurchmesser mindestens 600 µm beträgt, wenn die Konfluenz 5 % erreicht. Entsprechend gaben wir in der Software des CM30 Systems eine Zielkonfluenz von 5 % ein. Als die Zellen diese Konfluenz erreicht oder überschritten hatten, wurde eine Benachrichtigung ausgelöst.
Als wir die Sphäroidgröße in 12 Wells einen Tag nach der Benachrichtigung überprüften, konnten wir bestätigen, dass die Krebssphäroide in allen Wells tatsächlich einen Durchmesser von mindestens 600 µm aufwiesen (Abbildung 4).
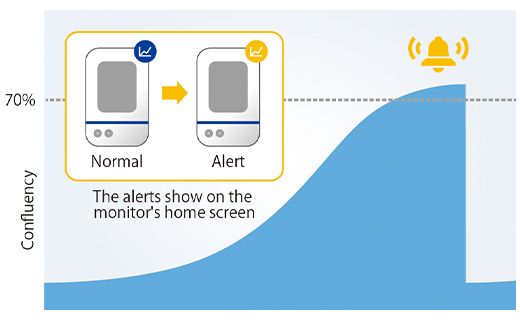 | 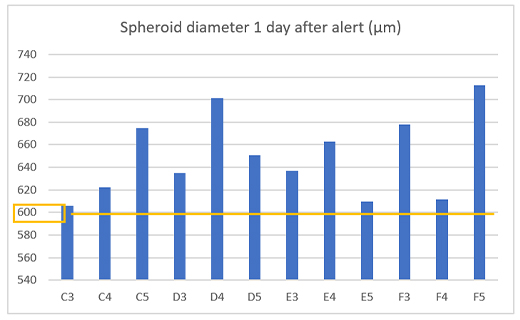 |
Abbildung 4. Größe der gebildeten Sphäroide einen Tag nach der Benachrichtigung.
(a) Beispiel für eine Benachrichtigung auf dem CM30 System (b) Durchmesser der gebildeten Sphäroide (n = 12).
Da die Anzucht der Sphäroide unter Verwendung des CM30 Systems stattfand, konnten wir den Wachstumsstatus überwachen, ohne den Behälter aus dem Inkubator zu nehmen oder manuell einzugreifen. Zudem war mit der Analysesoftware eine Quantifizierung der Sphäroidgröße möglich, und das System gab eine Benachrichtigung aus, als die angestrebte Sphäroidgröße erreicht war. Somit bleibt durch Verwendung des CM30 Systems mehr Zeit für andere Aufgaben, da keine manuelle Überprüfung der Zellkultur mehr erforderlich ist.
Krebssphäroide, die eine bestimmte Größe überschritten, wurden mit einem von drei Anti-Krebswirkstoffen (Cisplatin, Paclitaxel oder 5-FU) in unterschiedlicher Dosierung oder mit einer Kontrolle behandelt. 24 Stunden später wurden Hoechst 33342, Propidiumiodid (PI) und Calcein-AM in alle Wells gegeben, um die Kerne aller Zellen, die Kerne abgestorbener Zellen bzw. lebensfähige Zellen in Sphäroiden anzufärben. Nach dem Anfärben wurden die
Krebssphäroide mithilfe von Laser-Scanning-Mikroskopie abgebildet.
2. Aufnahme von Bildern der Zellen in den 3D-Krebssphäroiden
Mit dem FLUOVIEW FV3000 Laser-Scanning-Konfokalmikroskop erstellten wir hochauflösende Bilder von dicken Krebssphäroiden auf Einzelzellebene. Das Makro-Mikro-Bildgebungsmodul des FV3000 Mikroskops ermöglichte die Aufnahme von Bildern, ohne nach der Probe suchen zu müssen.
Abbildung 5 zeigt eine schematische Darstellung des automatischen Bildaufnahmeprozesses unter Verwendung des Makro-Mikro-Bildgebungsmoduls. Die Krebssphäroide befinden sich an unterschiedlichen Positionen in dem U-förmigen Well. Deshalb erfasst das Makro-Mikro-Bildgebungsmodul zunächst die Position des zu untersuchenden Sphäroids, indem es das gesamte Well bei geringer Vergrößerung abbildet (Makrobild). Danach kann das Modul automatisch nur das Sphäroid bei starker Vergrößerung (Mikrobild) erfassen. Dadurch ist die Dateigröße des aufgenommenen Bildes kleiner, was Speicherplatz im System spart.
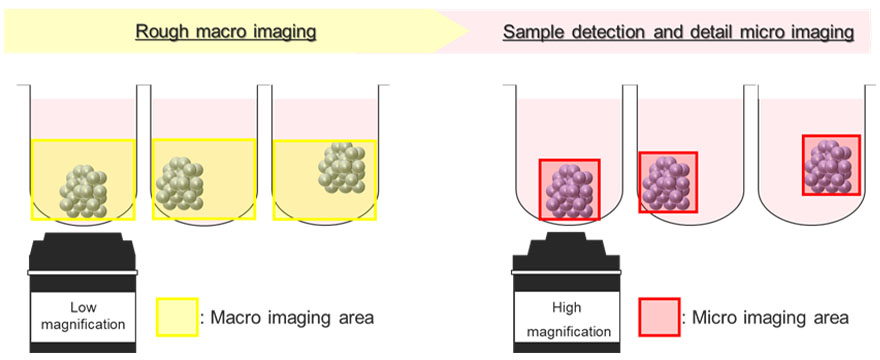
Abbildung 5. Schematische Darstellung des Makro-Mikro-Bildgebungsmoduls des FV3000 Laser-Scanning-Konfokalmikroskops.
Das Mikroskop erfasste aufeinanderfolgende Z-Schnittbilder von Krebssphäroiden in 60 Wells.
Wie in Abbildung 6 dargestellt, wurde ein hochauflösendes Bild von jeder Zelle des Krebssphäroids aufgenommen. In der mit Cisplatin behandelten Gruppe war im Vergleich zur Kontrollgruppe und zu den beiden anderen Anti-Krebswirkstoffen eine große Anzahl PI-positiver Zellen zu sehen, was darauf hindeutet, dass Cisplatin den Tod dieser Zellen verursachte.

Abbildung 6. Bilder zur Bestimmung von lebenden und toten Zellen werden automatisch vom Makro-Mikro-Bildgebungsmodul aufgenommen.
3. Statistische Analyse der Zellen in 3D-Krebssphäroiden
Zur Bestimmung der Viabilität jeder Zelle in dem Sphäroid analysierten wir kontinuierliche Z-Schnittbilder aus mehreren Wells mit der NoviSight 3D-Zellanalysesoftware. Die mit Hoechst 33342 erzielten Fluoreszenzsignale wurden zur Erkennung aller Zellkerne verwendet. Mithilfe eines auf einem Streudiagramm basierenden Gating-Verfahrens wurden Zellen mit geringer Intensität des von Calcein-AM stammenden Fluoreszenzsignals und solche mit hoher Intensität des von PI stammenden Signals als tote Zellen definiert. Im Gegensatz dazu wurden Zellen mit hoher Intensität des von Calcein-AM stammenden Signals bzw. niedriger Intensität des von PI stammenden Signals als vitale Zellen definiert (Abbildung 7). Anschließend konnten wir die Validität unserer Klassifizierung mithilfe der Galerie-Funktion überprüfen. Dies bestätigte, dass wir mit der NoviSight Software eine große Anzahl automatisch erkannter Zellen anhand der Intensität des Fluoreszenzsignals klassifizieren konnten.
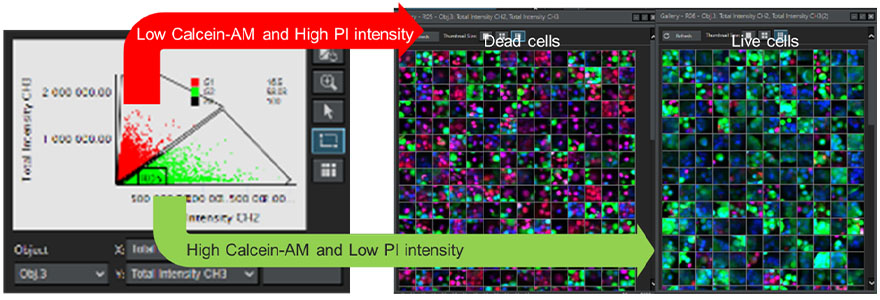
Abbildung 7. Bestimmung der Viabilität aller Zellen mit der NoviSight Software. Links: Auftragung der Fluoreszenzsignalintensität des Calcein-AM-Kanals und des PI-Kanals für jede Zelle. Rechts: Galeriebilder von toten und lebenden Zellen.
Wir berechneten den Prozentsatz der vitalen Zellen in den mit Anti-Krebswirkstoffen behandelten Sphäroiden (siehe Abbildung 8). Bei Zugabe von Paclitaxel und 5-FU in unterschiedlichen Konzentrationen ergaben sich in Bezug auf den Anteil vitaler Zellen in unserem Versuch kaum Veränderungen. Allerdings konnten wir feststellen, dass der Anteil der vitalen Zellen mit zunehmender Konzentration des zugesetzten Cisplatins abnahm. Die NoviSight Software erleichtert die bildgebungsbasierte Analyse von zellbasierten Assays mit 3D-Zellkulturmodellen, um die Wirksamkeit mehrerer Wirkstoffkandidaten gleichzeitig zu bewerten.
Überlegungen zur Beurteilung der Wirksamkeit von Anti-Krebsmedikamenten an Krebssphäroiden
In dieser Studie konnten wir aufzeigen, wie bildgebungsbasierte Lösungen in jedem Schritt des Prozesses helfen können, die Auswirkungen von Anti-Krebswirkstoffen auf Krebssphäroide auf zellulärer Ebene zu untersuchen.
Krebssphäroide werden in einem aufwändigen Zellkulturverfahren hergestellt. Um die Wirkung von Anti-Krebswirkstoffen quantitativ zu bestätigen, müssen die Sphäroide homogene Bedingungen aufweisen (wie etwa in Bezug auf die Sphäroidgröße in dieser Studie). Dank der Fernüberwachungsfunktionen des CM30 Systems waren wir in der Lage zu überprüfen, wie sich die Zellen vermehrten, bis das Sphäroid eine festgelegte Größe erreicht hatte, ohne die Kultur aus dem Inkubator zu nehmen. Darüber hinaus konnten wir dank der Benachrichtigungsfunktion des CM30 Systems die Behandlung mit den Anti-Krebswirkstoffen zeitlich genau abstimmen.
Konfokale Laser-Scanning-Mikroskopie ist eine geeignete Option zur Beobachtung der Reaktion von Krebssphäroiden auf Anti-Krebswirkstoffe auf zellulärer Ebene. Entgegen der Annahme, dass sich kultivierte Krebssphäroide in U-förmigen Wells eher in der Mitte des Wells befinden, liegen sie tatsächlich oft etwas weiter außen. Die Aufnahme des gesamten Wells zur Erfassung der Position der Krebssphäroide ist jedoch zeitaufwändig und benötigt viel Speicherplatz. Zur Vereinfachung dieses Prozesses kann das Makro-Mikro-Bildgebungsmodul des FV3000 Mikroskops eingesetzt werden. Das Modul nimmt ein Bild mit geringer Vergrößerung (Makrobild) des gesamten Wells auf und bestimmt automatisch die optimale Position für die Aufnahme mit hoher Vergrößerung (Mikrobild). Da das Modul nur die Probe (Krebssphäroide) bei starker Vergrößerung abbildet, verringert sich die Größe der Bilddatei und der Zeitaufwand für die Bildgebung.
Die mit dem FV3000 Mikroskop aufgenommenen Bilder können anschließend mit der NoviSight 3D-Zellanalysesoftware analysiert werden. Die statistische Auswertung der Viabilitätssignale auf Zellebene zeigte, dass sich bei Zugabe von Cisplatin die Anzahl der toten Zellen dosisabhängig erhöhte. Die NoviSight Software ermöglicht durch Verwendung von Analyseparametern wie der Signalintensität und von Zellpositionsinformationen eine erweiterte Analyse. Durch die Analyse des Verhaltens jeder einzelnen heterogenen Zelle innerhalb eines 3D-Sphäroids in vitro lässt sich die Wirkstoffbeurteilung in einer ähnlichen Zellumgebung wie in vivo durchführen.
Bei diesem Arbeitsablauf werden Technologien von Evident verwendet, um schwierige oder komplizierte Prozesse bei der Analyse von 3D-Zellkulturmodellen zu automatisieren, zu verkürzen und zu vereinfachen. Durch Kombination verschiedener Lösungen kann der gesamte Ablauf der Forschungsarbeit optimiert werden.
Erfahren Sie mehr über konfokale Bildgebung und Bildanalyse.
Literaturangabe
1)Elena M. Tosca et al., Replacement, Reduction, and Refinement of Animal Experiments in Anticancer Drug Development: The Contribution of 3D In Vitro Cancer Models in the Drug Efficacy Assessment. Biomedicines 2023, 11, 1058.
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.