Évaluation de l’efficacité de médicaments dans des sphéroïdes tumoraux 3D à l’aide d’un processus d’imagerie
Lors de l’évaluation de médicaments sur des organismes individuels, comme l’homme ou les animaux de laboratoire, les mesures sont influencées par divers facteurs comme l’âge et l’environnement de croissance, ce qui rend difficile l’analyse statistique des données issues de différents échantillons.
Les modèles de culture cellulaire 3D, comme les organoïdes et les sphéroïdes, peuvent mimer de manière fidèle la structure et la physiologie in vivo d’un organe ou d’un tissu et peuvent être cultivés en masse in vitro. Ils sont donc facilement reproductibles pour l’analyse statistique des données. Étant donné que les modèles de culture cellulaire 3D sont capables de répliquer l’hétérogénéité cellulaire des tumeurs, l’imagerie des essais sur des cultures cellulaires 3D est utile pour l’évaluation des médicaments.
Le processus d’évaluation de l’efficacité des médicaments par un essai sur une culture cellulaire 3D se divise en trois étapes (figure 1) :
- Préparation, culture et traitement du modèle de culture cellulaire 3D
- Acquisition des images des cellules
- Réalisation de l’analyse statistique
Cette note d’application présente un processus d’imagerie pour chacune de ces étapes. Pour illustrer le processus étape par étape, nous avons utilisé un essai pour évaluer de manière quantitative les dégâts induits par un composé à des sphéroïdes tumoraux 3D au niveau cellulaire.
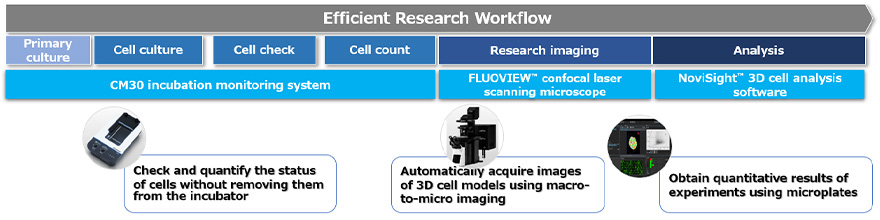
Figure 1 – Processus d’imagerie de modèles de culture cellulaire 3D à l’aide des technologies Evident
1. Préparation des sphéroïdes tumoraux 3D (préculture)
Les sphéroïdes tumoraux peuvent mimer de manière fidèle le micro-environnement cellulaire des tumeurs in vivo, de sorte qu’ils sont souvent utilisés pour le criblage d’anticancéreux. Ils sont généralement générés par mise en culture de cellules cancéreuses dans un récipient de culture hémisphérique à faible adhérence.
Pour évaluer l’efficacité des médicaments, nous avons préparé des sphéroïdes tumoraux de 600 µm de diamètre minimum. Pour cette étape, nous avons utilisé le système de surveillance de l’incubation CM30. Cet appareil permet une surveillance à long terme des cellules et vous permet de suivre l’évolution de l’état des cultures cellulaires sans avoir à les retirer de l’incubateur.
Pour préparer les sphéroïdes tumoraux, du milieu de culture a été ensemencé avec des cellules MCF-7 dérivées d’un cancer dans des plaques à faible adhérence à 96 puits en forme de U à une densité de 2 000 cellules/puits. Immédiatement après l’ensemencement, nous avons installé la microplaque dans le système CM30 et placé le tout dans un incubateur à CO2. En utilisant le
système CM30, nous pouvons observer la formation des sphéroïdes à partir de cellules MCF-7 dispersées et l’augmentation de leur taille dans le temps (figure 2).
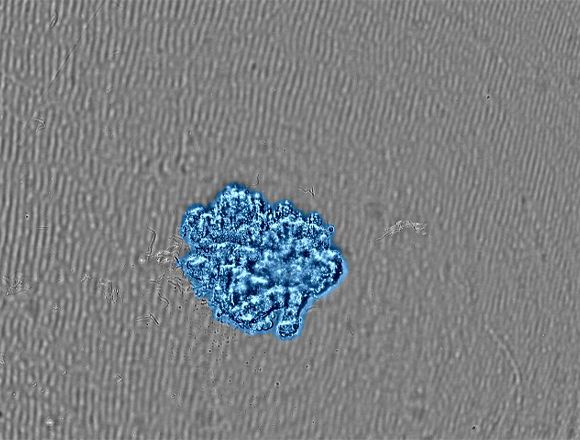
Related VideosFigure 2 – (a) Images à intervalles de la formation d’un sphéroïde |
(b) Image du sphéroïde ayant atteint la taille cible.
|
Le système CM30 a reconnu de manière automatique le sphéroïde grâce à la fonction de mesure de la confluence. Cette fonction permet de calculer la confluence, à savoir le ratio entre la surface occupée par les cellules et la surface de l’image tout entière. La figure 3 illustre l’évolution de la surface d’un sphéroïde MCF-7 observée sur une période de sept jours.
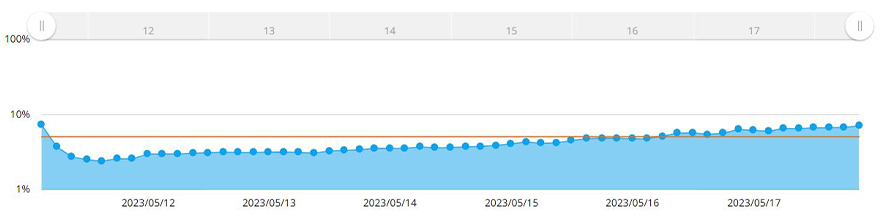
Figure 3 – Graphique représentant l’évolution de la taille d’un sphéroïde sur une période de sept jours. La ligne jaune est la cible de confluence définie dans le système.
Une fois que la confluence a atteint 5 % de la surface de l’image acquise, le logiciel a mesuré la surface du sphéroïde. Dans le cas présent, nous avons déterminé que le diamètre du sphéroïde dépassait 600 µm au moment où la confluence atteignait 5 %. L’utilisation du système CM30 permet de définir dans le logiciel une confluence cible de 5 %. Dès que les cellules atteignent ou dépassent ce pourcentage de confluence, une alerte est déclenchée.
Pour vérifier que l’alerte n’a pas été lancée par erreur, nous avons mesuré le lendemain de l’alerte la taille des sphéroïdes de 12 puits et avons confirmé que tous les sphéroïdes tumoraux présentaient un diamètre de 600 µm au minimum (figure 4).
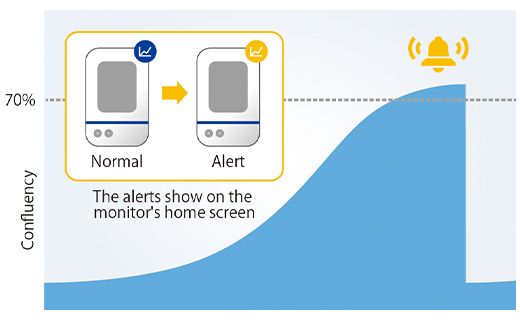 | 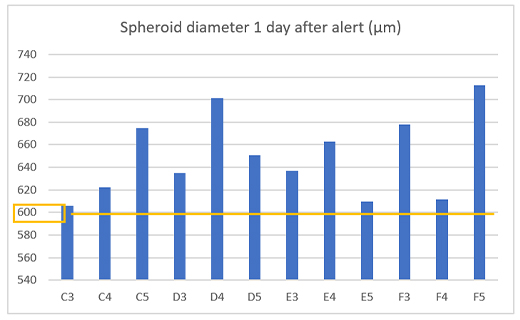 |
Figure 4 – Taille des sphéroïdes préparés un jour après l’alerte
(a) Exemple d’une alerte sur le système CM30 (b) Diamètre des sphéroïdes préparés (n=12).
La préparation des sphéroïdes à l’aide du système CM30 nous a permis de surveiller la croissance de ces derniers sans avoir à sortir le récipient de l’incubateur et à l’y remettre et sans intervention des chercheurs. En outre, le logiciel d’analyse permet de quantifier le diamètre des sphéroïdes et de nous alerter lorsque le diamètre cible des sphéroïdes est atteint. Une fois le système CM30 mis en œuvre dans votre processus, les chercheurs peuvent consacrer à d’autres tâches le temps auparavant alloué à la surveillance de la culture cellulaire.
Les sphéroïdes tumoraux dont le diamètre dépassait celui défini ont été traités avec trois médicaments anticancéreux (cisplatine, paclitaxel ou 5‑FU) à différentes doses ou avec un contrôle. De l’Hoechst 33342, de l’iodure de propidium (IP) et de la calcéine AM ont été ajoutés à tous les puits 24 heures plus tard. L’Hoechst 33342, l’iodure de propidium (IP)
et la calcéine AM servent à marquer, respectivement, les noyaux de toutes les cellules, les noyaux des cellules mortes et les cellules viables dans les sphéroïdes. Une fois le marquage terminé, nous avons acquis des données d’images des sphéroïdes tumoraux par microscopie à balayage laser.
2. Acquisition d’images des cellules dans les sphéroïdes tumoraux 3D
Nous avons utilisé le microscope confocal à balayage laser FLUOVIEW™ FV3000 pour acquérir des images à haute résolution des sphéroïdes tumoraux épais au niveau unicellulaire. Le module d’imagerie macro à micro du microscope FV3000 nous a permis d’acquérir des images sans avoir à chercher l’échantillon.
La figure 5 représente un schéma de principe du processus d’acquisition d’images automatique à l’aide du module d’imagerie macro vers micro. Les sphéroïdes tumoraux flottent dans des positions variables à l’intérieur des puits en forme de U. Pour régler ce problème, le module d’imagerie macro vers micro enregistre d’abord la position du sphéroïde d’intérêt en prenant une image de l’ensemble du puits à faible grossissement (image macro). Ensuite, le module ne peut acquérir automatiquement une image que de la zone où se trouve le sphéroïde à fort grossissement (image micro). Ce processus permet de réduire la taille de fichier de l’image acquise. Ainsi, il permet également de réduire la charge imposée sur la mémoire du système.
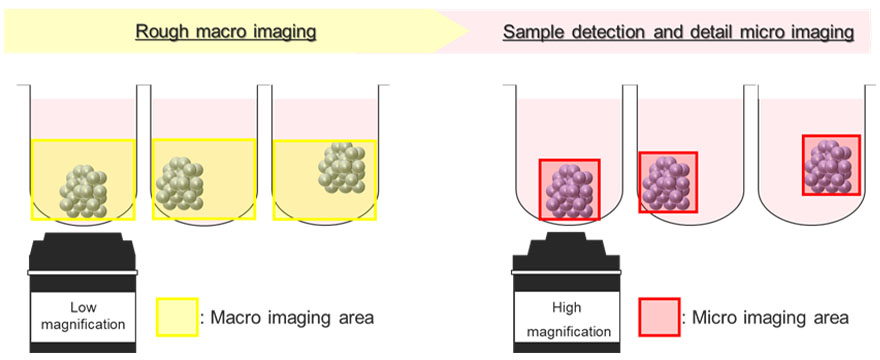
Figure 5 – Schéma de principe du module d’imagerie macro à micro sur le microscope confocal à balayage laser FV3000
Le microscope a acquis des images de coupes optiques consécutives sur l’axe Z de sphéroïdes tumoraux dans 60 puits.
Comme indiqué sur la figure 6, une image à haute résolution de chaque cellule des sphéroïdes tumoraux a été acquise. Comparativement au groupe témoin et aux groupes traités avec les deux autres anticancéreux, un grand nombre de cellules positives à l’IP étaient visibles dans le groupe traité à la cisplatine, ce qui suggère que ce médicament anticancéreux est à l’origine de la mort de ces
cellules.

Figure 6 – Les images utilisées pour déterminer la viabilité ou la mort des cellules sont automatiquement acquises par le module d’imagerie macro à micro.
3. Analyse statistique des cellules des sphéroïdes tumoraux 3D
Pour déterminer la viabilité de chaque cellule dans les sphéroïdes, nous avons analysé les images des coupes otiques consécutives sur l’axe Z prises dans plusieurs puits à l’aide du logiciel d’analyse cellulaire 3D NoviSight™. Les signaux de fluorescence émis par l’Hoechst 33342 ont été utilisés pour la reconnaissance des noyaux de toutes les cellules. Au moyen d’une méthode de classification basée sur un diagramme de dispersion, les cellules dont l’intensité des signaux de fluorescence dus à la calcéine AM était faible et dont l’intensité des signaux dus à l’IP était forte ont été définies comme des cellules mortes. À l’inverse, les cellules présentant des signaux de fluorescence dus à la calcéine AM forts et des signaux de fluorescence dus à l’IP faibles ont été définies comme des cellules viables (figure 7). Nous avons ensuite pu vérifier la validité de notre classification en utilisant la fonction de galerie. Cela a permis de montrer que l’utilisation du logiciel NoviSight permettait de classer un grand nombre de cellules reconnues automatiquement en fonction de l’intensité des signaux de fluorescence.
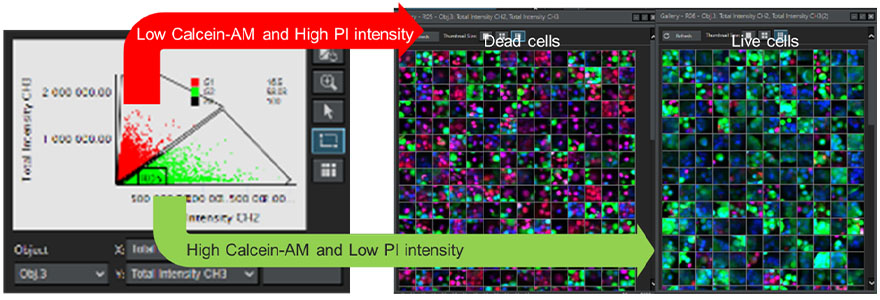
Figure 7 – Détermination de la viabilité de toutes les cellules à l’aide du logiciel NoviSight.
Gauche : représentation graphique de l’intensité des signaux de fluorescence du canal de la calcéine AM et du canal de l’IP de chaque cellule.
Droite : galerie des images des cellules viables et des cellules mortes.
Comme illustré dans la figure 8, nous avons calculé le pourcentage de cellules viables dans les sphéroïdes traités avec un médicament anticancéreux. Lorsque les médicaments paclitaxel et 5-FU ont été ajoutés à différentes concentrations, nous n’avons observé aucune altération du taux de cellules viables. Cependant, nous avons confirmé une baisse du taux de cellules viables à mesure que la concentration de cisplatine administrée augmentait. Le logiciel NoviSight facilite l’analyse basée sur l’imagerie des essais réalisés sur des modèles de culture cellulaire 3D pour évaluer simultanément l’efficacité de plusieurs médicaments candidats.
Éléments à prendre en compte pour l’évaluation des effets des médicaments anticancéreux sur les sphéroïdes tumoraux
Avec cette étude, nous avons vérifié en quoi les solutions basées sur l’imagerie peuvent aider à comprendre, à chaque étape du processus, les effets des médicaments anticancéreux sur les cellules de sphéroïdes tumoraux.
Les sphéroïdes tumoraux sont préparés par une procédure de culture cellulaire laborieuse. Afin de confirmer de manière quantitative les effets de médicaments anticancéreux, les sphéroïdes doivent être dans des états similaires (par exemple, la taille des sphéroïdes dans cette étude). Grâce aux capacités de surveillance à distance du système CM30, nous avons pu vérifier le degré de prolifération des cellules au cours du temps jusqu’à ce que les sphéroïdes atteignent un diamètre prédéterminé, et ce, sans avoir besoin de sortir les cultures de l’incubateur. En outre, la fonctionnalité d’alerte du système CM30 nous a permis de traiter les sphéroïdes avec des médicaments anticancéreux au moment adéquat.
La microscopie confocale à balayage laser est une option adaptée pour l’observation au niveau cellulaire de la réponse des sphéroïdes tumoraux aux médicaments anticancéreux. Les sphéroïdes tumoraux mis en culture dans les puits en U sont censés être situés à proximité du centre du puits. En réalité, ils sont souvent légèrement décalés par rapport au centre du puits. Pour réaliser une imagerie de tout le puits afin d’être sûr d’acquérir la zone où sont situés les sphéroïdes tumoraux, il est nécessaire de stocker une grande quantité de données, et le processus est chronophage. Le module d’imagerie macro à micro du microscope FV3000 simplifie ce processus. Le module prend une image à faible grossissement (image macro) de l’ensemble du puits et détermine automatiquement la position optimale pour prendre une image de l’échantillon sphéroïde à fort grossissement (image micro). En ne prenant des images que des échantillons (sphéroïdes tumoraux) à fort grossissement, le module réduit la taille de fichier d’image et le temps passé pour réaliser l’imagerie.
Les images acquises avec le microscope FV3000 peuvent être analysées directement avec le logiciel d’analyse cellulaire 3D NoviSight. Le traitement statistique des signaux de viabilité au niveau cellulaire a montré que l’administration de cisplatine augmente le nombre de cellules mortes de façon dépendante de la dose. Le logiciel NoviSight peut être utilisé avec des paramètres d’analyse comme l’intensité des signaux et la position des cellules afin de réaliser une analyse plus approfondie. En analysant le comportement de chaque cellule particulière au sein de sphéroïdes 3D hétérogènes, l’évaluation des médicaments peut être réalisée dans un environnement qui reproduit fidèlement l’environnement cellulaire in vivo.
Ce processus fait appel à des technologies d’Evident capables de faire économiser aux utilisateurs du temps et des efforts et d’automatiser et de raccourcir les procédures que ces derniers trouvent difficiles ou compliqués dans le cadre de l’analyse des modèles de culture cellulaire 3D. L’association de ces solutions offre un processus de recherche rationalisé de bout en bout.
Apprenez-en plus sur l’imagerie confocale et l’analyse des images.
Références bibliographiques
1)Elena M. Tosca et coll. « Replacement, Reduction, and Refinement of Animal Experiments in Anticancer Drug Development: The Contribution of 3D In Vitro Cancer Models in the Drug Efficacy Assessment ». Biomedicines, 2023, 11, 1058.
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.