Avaliação de eficácia de fármaco de esferoides de câncer 3D usando um processo de trabalho baseado em formação de imagem
Nas avaliações de fármacos que usam organismos individuais, como cobaias humanas e animais, os valores de medição são afetados por vários fatores, como idade e ambiente de crescimento, o que torna difícil analisar estatisticamente os dados de várias amostras.
Os modelos de cultura de células 3D, como organoides e esferoides, conseguem imitar na perfeição a estrutura e a função in vivo de um órgão ou tecido, e podem ser cultivados em massa in vitro. Como resultado, são altamente reproduzíveis para análise de dados estatísticos. Como os modelos de cultura de células 3D são capazes de replicar a heterogeneidade celular encontrada em tumores, a formação de imagem de ensaios baseados em células 3D é útil para a avaliação dos fármacos.
O processo de trabalho para avaliar a eficácia de fármacos usando um ensaio baseado em células 3D pode ser dividido nos três processos a seguir (Figura 1):
- Preparar, cultivar e tratar o modelo de cultura de células 3D
- Adquirir imagens das células
- Realizar a análise estatística
Esta nota da aplicação apresenta um processo de trabalho baseado na formação de imagem para cada processo. Para demonstrar o passo a passo do processo de trabalho, usamos um ensaio para avaliar quantitativamente o dano induzido pelo composto nos esferoides de câncer 3D a nível celular.
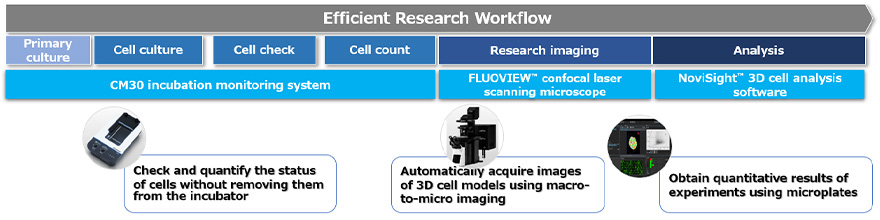
Figura 1. Processo de trabalho baseado na formação de imagem para modelos de cultura de células 3D usando tecnologias da Evident.
1. Preparação dos esferoides de câncer 3D (pré-cultura)
Os esferoides de câncer conseguem imitar na perfeição o microambiente celular encontrado dentro de tumores in vivo, por isso, são frequentemente usados em ensaios de triagem de fármacos anticancerígenos. Eles geralmente são formados por meio da cultura de células cancerígenas em um recipiente de cultura de células hemisférico de baixa adesão.
Para avaliar a eficácia do fármaco, preparamos esferoides de câncer de 600 µm ou superiores. Para esse processo, usamos o sistema de monitoramento de incubação CM30. Este dispositivo possibilita o monitoramento a longo prazo das células e permite acompanhar o status das culturas de células sem retirá-las da incubadora.
Para preparar os esferoides de câncer, células MCF-7 derivadas de câncer de mama foram semeadas em frascos de baixa fixação com 96 poços em formato de U, a uma densidade de 2000 células/poço. Imediatamente após a semeadura, colocamos a microplaca no sistema CM30 e colocamos o sistema em uma incubadora CO2. Usando o sistema CM30, pudemos monitorar como as células MCF-7 dispersas formaram esferoides e como o seu tamanho aumentou com o passar do
tempo (Figuras 2).
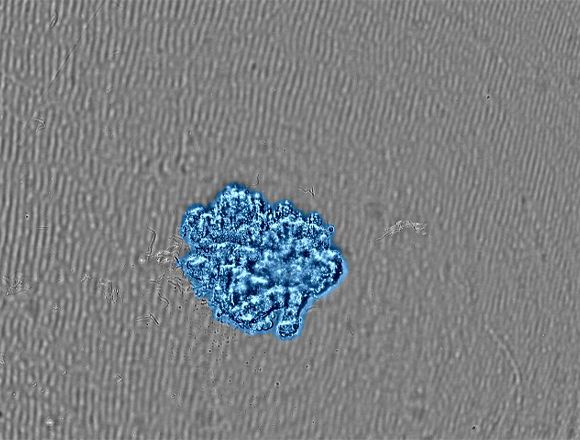
Vídeos relacionadosFigura 2. (a) Imagens com lapso de tempo da formação do esferoide. |
(b) Imagem do esferoide com o tamanho-alvo atingido. Uma máscara de confluência mostra as células detectadas em azul. |
O sistema CM30 reconheceu automaticamente a área do esferoide aplicando a função de medição de confluência. Com a função de medição de confluência, a confluência é calculada como uma proporção da área ocupada pelas células comparada à área da imagem inteira. A Figura 3 mostra as mudanças na área do esferoide MCF-7 ao longo de sete dias.
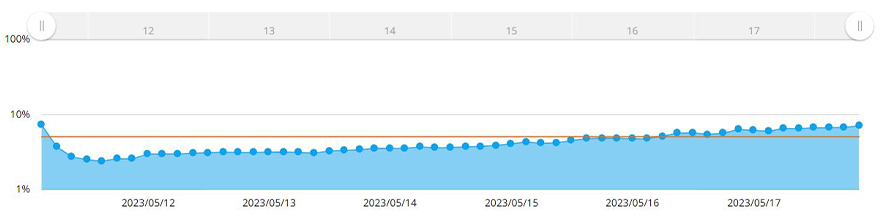
Figura 3. Gráfico mostrando as mudanças de tamanho do esferoide ao longo de sete dias. A linha amarela é o alvo de confluência definido no sistema.
Quando a confluência atingiu 5% da área da imagem adquirida, o software mediu a área do esferoide. Aqui constatamos que o diâmetro do esferoide ultrapassa 600 µm quando a confluência atinge 5%. Usando o sistema CM30, definimos uma confluência-alvo de 5% no software. Um alerta era gerado quando as células atingiam ou ultrapassavam essa confluência.
Para verificar se o alerta funcionou corretamente, medimos o tamanho do esferoide em 12 poços um dia após o alerta e confirmamos que esferoides de câncer com um diâmetro de 600 µm ou mais foram obtidos em todos os poços (Figura 4).
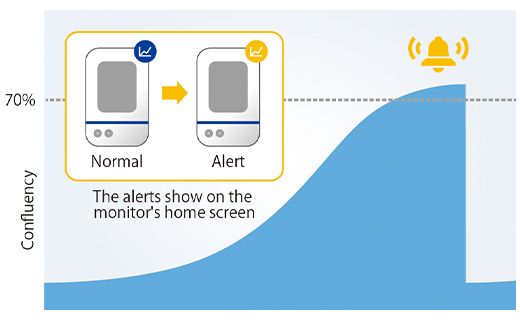 | 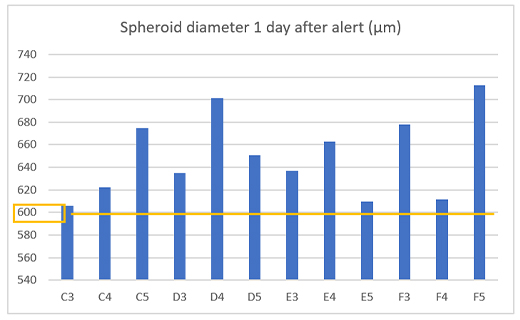 |
Figura 4. Tamanho do esferoide preparado um dia após o alerta.
(a) Exemplo de um alerta no sistema CM30 (b) Diâmetro dos esferoides preparados (n= 12).
Preparar os esferoides usando o sistema CM30 nos permitiu monitorar o status do crescimento sem ter que mover o recipiente para dentro e para fora da incubadora e sem o envolvimento do pesquisador. Além disso, o software de análise pôde quantificar o tamanho do esferoide e nos alertar quando o tamanho-alvo do esferoide foi atingido. Com o sistema CM30 implementado em seu processo de trabalho, os pesquisadores têm a liberdade de realizar outras tarefas com o tempo que antes era dedicado a monitorar a cultura de células.
Os esferoides de câncer que ultrapassaram um determinado tamanho foram tratados com um dos três fármacos anticancerígenos (Cisplatina, Paclitaxel ou 5-FU) com doses diferentes ou como um controle. Hoechst 33342, Iodeto de Propídio (PI) e Calceína-AM foram adicionados a todos os poços 24 horas depois. Hoechst 33342, PI e Calceína-AM podem tingir os núcleos de todas as células, núcleos de células mortas e de células viáveis nos
esferoides, respectivamente. Após a coloração, adquirimos os dados da imagem dos esferoides de câncer usando microscopia de rastreamento a laser.
2. Aquisição de imagem das células nos esferoides de câncer 3D
Usamos o microscópio confocal de rastreamento a laser FLUOVIEW™ FV3000 para adquirir imagens em alta resolução de esferoides de câncer espessos no nível da célula individual. O módulo de formação de imagem macro-para-micro do microscópio FV3000 tornou possível adquirir imagens sem ter que procurar pela amostra.
A Figura 5 mostra um diagrama esquemático do processo automático de aquisição de imagem usando o módulo de formação de imagem macro-para-micro. Os esferoides de câncer flutuam em posições inconsistentes dentro do poço em forma de U. Para tratar disso, o módulo de formação de imagem macro-para-micro primeiro registra a posição do esferoide de interesse fazendo a imagem do poço inteiro em baixa ampliação (imagem macro). Depois disso, o módulo pode adquirir automaticamente apenas a região do esferoide em alta ampliação (imagem micro). Este processo reduz o tamanho do arquivo da imagem adquirida. Também ajuda a reduzir a carga na memória do sistema.
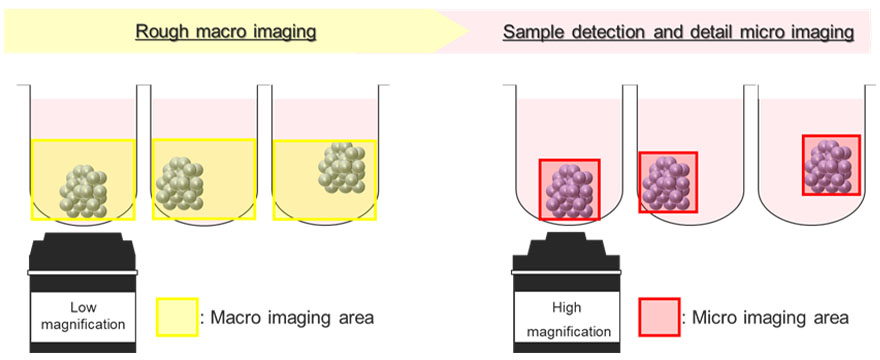
Figura 5. Diagrama esquemático do módulo de formação de imagem macro-para-micro do microscópio confocal de rastreamento a laser FV3000.
O microscópio adquiriu imagens consecutivas seccionadas em Z dos esferoides de câncer em 60 poços.
Conforme mostrado na Figura 6, foi adquirida uma imagem em alta resolução de cada célula no esferoide de câncer. Um grande número de células positivas para PI ficou visível no grupo tratado com Cisplatina em relação ao controle e a outros dois fármacos para câncer, sugerindo que este fármaco anticancerígeno causou a morte dessas células.

Figura 6. Imagens para constatar vida e morte da célula são automaticamente capturadas pelo módulo de formação de imagem macro-para-micro.
3. Análise estatística das células em esferoides de câncer 3D
Para determinar a viabilidade de cada célula no esferoide, analisamos imagens seccionadas em Z contínuas obtidas de vários poços usando o software de análise celular 3D NoviSight™. Sinais de fluorescência derivados de Hoechst 33342 foram usados para o reconhecimento de todos os núcleos celulares. Usando um processo de "gating" com base em um gráfico de dispersão, as células com baixa intensidade do sinal de fluorescência derivado da Calceína-AM e alta intensidade do sinal derivado de PI foram definidas como células mortas. Por outro lado, as células com alta Calceína-AM e baixo PI foram definidas como células viáveis (Figura 7). Foi possível então verificar a validade da nossa classificação usando a função de galeria. Isso demonstrou que ao usar o software NoviSight, pudemos classificar um grande número de células reconhecidas automaticamente de acordo com a intensidade do sinal de fluorescência.
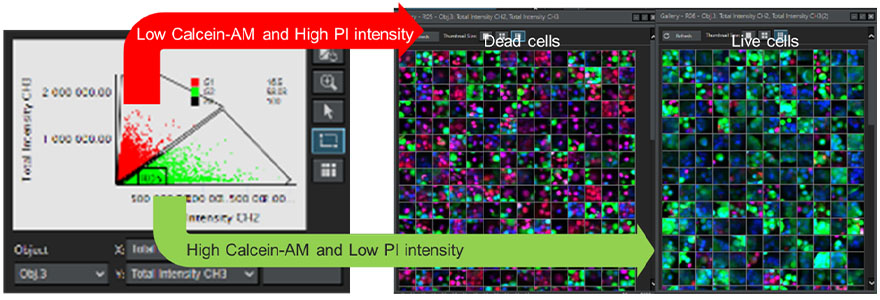
Figura 7. Determinação da viabilidade de todas as células usando o software NoviSight. Esquerda: Gráfico indicando a intensidade do sinal de fluorescência do canal de Calceína-AM e do canal de PI de cada célula. Direita: Imagens da galeria de células mortas e vivas.
Calculamos a porcentagem de células viáveis nos esferoides tratados com fármacos anticancerígenos, conforme mostrado na Figura 8. Quando Paclitaxel e 5-FU foram adicionados em diferentes concentrações, observamos células viáveis sem mudança significativa na proporção. No entanto, confirmamos uma diminuição na proporção de células viáveis à medida que a concentração de Cisplatina adicionada aumentou. O software NoviSight facilita a análise baseada na formação de imagem de ensaios baseados na célula em modelos de cultura de células 3D para avaliar a eficácia de vários fármacos candidatos simultaneamente.
Considerações da avaliação dos efeitos de fármacos anticancerígenos em esferoides de câncer
Neste estudo, confirmamos como soluções baseadas em formação de imagem podem auxiliar em cada etapa do processo para entender os efeitos de fármacos anticancerígenos em esferoides de câncer a nível celular.
Os esferoides de câncer são preparados através de um laborioso processo de cultura de células. Para confirmar os efeitos de fármacos anticancerígenos quantitativamente, os esferoides devem ter condições homogêneas (como o tamanho do esferoide neste estudo). Graças aos recursos de monitoramento remoto do sistema CM30, pudemos verificar como as células se proliferaram até o esferoide atingir um tamanho predeterminado, sem retirar a cultura da incubadora. Além disso, a função de alerta do sistema CM30 nos ajudou a controlar com precisão o tempo do tratamento com os fármacos anticancerígenos.
A microscopia confocal de rastreamento a laser é uma opção adequada para a observação da resposta dos esferoides de câncer aos fármacos anticancerígenos a nível celular. Costuma-se pensar que os esferoides de câncer cultivados em poços com fundo em forma de U ficam no centro do poço. Na verdade, eles geralmente se localizam ligeiramente fora do centro. Fazer a imagem do poço todo para capturar a área com os esferoides de câncer requer uma grande quantidade de dados de armazenamento e consome muito tempo. O módulo de formação de imagem macro-para-micro do microscópio FV3000 simplifica esse processo. O módulo faz uma imagem em baixa ampliação (imagem macro) do poço inteiro e determina automaticamente a posição ideal para a formação da imagem em alta ampliação (imagem micro). Ao fazer a imagem apenas da amostra (esferoides de câncer) em alta ampliação, o módulo reduz o tamanho do arquivo de imagem e o tempo gasto com a formação da imagem.
As imagens adquiridas com o microscópio FV3000 podem ser facilmente analisadas com o software de análise celular 3D NoviSight. O processamento estatístico dos sinais de viabilidade a nível celular mostrou que a adição de Cisplatina aumentou o número de células mortas de modo dependente da dosagem. O software NoviSight pode ser usado com parâmetros de análise como intensidade do sinal e informações sobre a posição da célula para realizar uma análise mais avançada. Ao analisar o comportamento de cada célula heterogênea dentro de um esferoide 3D, a avaliação do fármaco pode ser realizada em um ambiente que imita na perfeição o ambiente celular encontrado in vivo.
Este processo de trabalho usa tecnologias da Evident que podem automatizar, encurtar e economizar tempo e esforço em processos que os usuários acham difíceis ou complicados ao analisar modelos de cultura de células 3D. A combinação das soluções oferece um processo de trabalho de pesquisa otimizado do início ao fim.
Saiba mais sobre formação de imagem confocal e análise de imagem.
Referências
1)Elena M. Tosca et al., Replacement, Reduction, and Refinement of Animal Experiments in Anticancer Drug Development: The Contribution of 3D In Vitro Cancer Models in the Drug Efficacy Assessment. Biomedicines 2023, 11, 1058.
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.